酸碱中和滴定曲线绘制 正式版
- 格式:ppt
- 大小:634.00 KB
- 文档页数:28

酸碱中和滴定曲线的绘制通过实验的方法绘制酸碱中和滴定曲线,是新课程《普通高中化学课程标准(实验)》提出的新的要求,在“化学反应原理”和“实验化学”模块中都得到体现。
由教师现场演示绘制出一条滴定曲线或者由学生通过实验自己绘制滴定曲线,其教学效果与滴定曲线印在教材上让学生观察分析是大不相同的。
绘制酸碱中和滴定曲线的传统方法,是读出消耗滴定液的体积,同时利用pH计测量溶液的pH,利用坐标纸描点(或利用计算机)作图得到,操作过程复杂。
而使用pH传感器监测混合溶液在滴定过程中pH的变化情况,并借助计算机以图像形式显示出来,即可直接得到酸碱中和滴定曲线。
1.盐酸滴定氢氧化钠滴定曲线的绘制根据滴定曲线(如图),可以帮助学生理解滴定过程中的许多问题:(1)认识滴定过程的“突跃”是客观存在的。
(2)利用摄像头的拍摄功能,将实验现象和数据曲线在一个窗口中现实,实验数据和现象的有机结合,认识“突跃”和指示剂颜色变化的关系。
(3)酸碱指示剂的变色点不是反应终点,通过滴定曲线可以发现,变色点附近pH变化显著,虽然滴定终点pH不等于7,但引起的实验误差并不大,这也是酸碱中和滴定这一分析方法的科学性和准确性得以保证的原因所在。
(3)对于“食醋总酸量的测定”、“水果总酸量的测定”这一类结合生活实际的探究活动,由于样品多带有颜色,给滴定终点的判断带来不便,因此一般要对样品进行稀释或脱色处理,而使用pH传感器可以避免溶液颜色的影响。
(4)如果同时检测溶液的温度变化和pH变化,则可以同时得到温度曲线和滴定曲线,反应过程中的能量转换以及pH变化情况都得到体现。
如图:图滴定过程中pH和温度变化曲线2.滴定曲线的导数曲线如果对滴定曲线求导,得到导数曲线(如图),从导数曲线中可以确定出严格意义的滴定终点(导数曲线的极值点)。
图酸碱中和滴定曲线与导数曲线3.强碱滴定弱酸,强酸滴定弱碱利用同样的方法,还可以研究其他一些与酸碱中和反应相关的问题,例如:(1)由氢氧化钠滴定醋酸的滴定曲线(如图)可以说明,强碱滴定弱酸指示剂应该选用酚酞,如果使用甲基橙则会产生较大误差。







酸碱中和滴定曲线的绘制酸碱中和滴定曲线的绘制一、实验目的1、掌握酸式、碱式滴定管的使用;2、学习用pH计测定溶液的pH;3、通过滴定曲线的绘制指导指示剂的选择。
二、实验原理本实验采用NaOH溶液和HCl进行中和滴定,用NaOH滴定HCl 溶液:反应方程式:NaOH + HCl == NaCl + H2O滴定到达终点时,溶液的pH=7(常温下)。
反应开始时由于被中和的酸或碱的浓度相对较大,加入少量的碱或酸对其pH影响不大,此时滴定曲线变化基于平行于X轴直线。
当反应接近终点时,很少量的碱或酸就会引起溶液pH突变,酸、碱浓度不同,突变范围不同,这个突变点即是反应的终点。
利用pH计,可时刻监控溶液的pH,记录不同滴入体积所对应的pH,用pH对V作图,即可得到中和滴定曲线,并找出突变点。
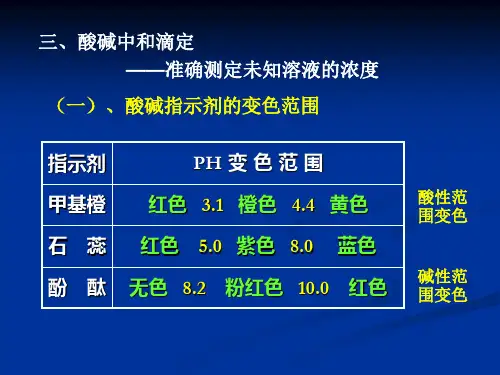
中和滴定曲线对于定量测量碱或酸的浓度实验中如何选择合适的酸碱指示剂有重要意义。
酸碱指示剂理论变色点应选择在pH突变范围内,这样才能比较准确地指示终点。
实验采用0.1mol/L NaOH滴定0.1mol/L HCl ,突跃范围在4.3-9.7,凡在突跃范围内(4.3-9.7)变色的指示剂按原理均可做指示剂,常用的指示剂如下:指示剂理论变色点pK pH变色范围颜色(酸色-碱色)甲基橙 3.3 3.1-4.4 红----黄甲基红 5.2 4.4-6.2 红----黄酚酞 9.1 8.0-9.6 无色—紫红选甲基红或酚酞作指示剂比较好,酚酞由于是从无色变到紫红(碱滴定酸),肉眼比较容易观察到,误差小,选酚酞最好。
滴定曲线绘制:三、仪器与试剂器材:pH计、100mL锥形瓶若干、50mL酸式和50mL碱式滴定管、蝴蝶夹,铁架台、25mL 移液管、洗耳球等药品:蒸馏水、0.1000mol/L盐酸溶液、0.1000mol/L NaOH溶液(待标定)酚酞指示剂、草酸等四、实验步骤1、监测准备(1)用电子天平称取4g左右NaOH固体配成约0.100mol/L的NaOH标准溶液。

