《酸碱中和滴定曲线
- 格式:ppt
- 大小:3.29 MB
- 文档页数:12

酸碱中和滴定曲线的综合分析图1是两强溶液的混合,关键点主要是起点,起点主要计算PH和物质的量浓度,终点和中性点重合,图像趋势主要是终点附近的“突变”。
图2是一元强碱滴定一元弱酸,是分析的重点,各个关键点的分析和结论都具有一定的代表性,下表即是图2各个关键点的详解。
2、变形分析(1)更改溶液滴加顺序或者溶质的成分①更改滴加顺序:图像变化趋势发生变化,分析的关键点没有改变,分析思路也没有变化。
②溶质为多元酸或者多元碱:由于酸的分步电离,导致中和反应的分步进行,所以分析出分步反应是关键。
关键点也只需要分析四个:起点、恰好生成酸式盐的点、中性点(酸性极弱的也可能是第二个点就是中性点)、恰好生成正盐的点。
例1、某二元弱碱B(OH)2(K1=5.9×10-2、K2=6.4×10-5)。
向10mL稀B(OH)2溶液中滴加等浓度盐酸溶液,B(OH)2、B(OH)+、B2+的浓度分数δ随溶液POH[POH=-lgc(OH)-]变化的关系如图3,以下说法正确的是A. 交点a处对应加入的盐酸溶液的体积为5mLB. 当加入的盐酸溶液的体积为10mL时存在c(Cl-)>c(B(OH)+)>c(H+)>c(OH-)>c(B2+)C. 交点b处c(OH)=6.4×10-5D. 当加入的盐酸溶液的体积为15mL时存在:c(Cl-)+c(OH-)= c(B2+)+c(B(OH)+)+ c(H+),【分析】答案:C。
图中曲线①B(OH)2,②为B(OH)+,③为B2+;交点a处对应加入的盐酸溶液的体积为5mL 图3时,反应生成等浓度的B(OH)Cl和B(OH)2混合液,由于两种溶质水解电离能力不同,所以B(OH)2、B(OH)+ 浓度分数δ不相等,A错误;当加入的盐酸溶液的体积为10mL时,溶液为B(OH)Cl,溶液显酸性,根据B(OH)2(K1=5.9×10-2、K2=6.4×10-5)可知,c(Cl-)>c(B(OH)+)>c(H+)> c(B2+)>c(OH-),B错误;交点b处时,c(B(OH)+)=c(B2+),根据B(OH)+ B2++ OH-,K2= c(OH-)=6.4×10-5, C正确;当加入的盐酸溶液的体积为15mL时,生成等体积等浓度B(OH)Cl和BCl2的混合液,存在电荷守恒为c(Cl-)+c(OH-)= 2c(B2+)+c(B(OH)+)+ c(H+),D错误。
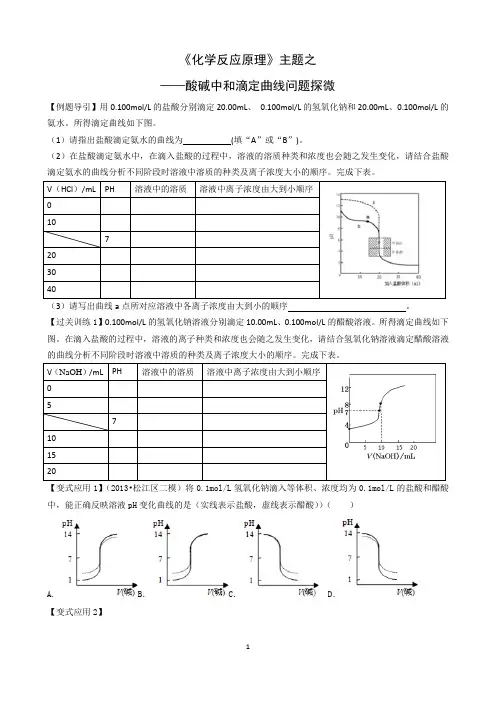
《化学反应原理》主题之——酸碱中和滴定曲线问题探微【例题导引】用0.100mol/L的盐酸分别滴定20.00mL、0.100mol/L的氢氧化钠和20.00mL、0.100mol/L的氨水。
所得滴定曲线如下图。
(1)请指出盐酸滴定氨水的曲线为(填“A ”或“B”)。
(2)在盐酸滴定氨水中,在滴入盐酸的过程中,溶液的溶质种类和浓度也会随之发生变化,请结合盐酸滴定氨水的曲线分析不同阶段时溶液中溶质的种类及离子浓度大小的顺序。
完成下表。
V(HCl)/mL PH 溶液中的溶质溶液中离子浓度由大到小顺序107203040(3)请写出曲线a点所对应溶液中各离子浓度由大到小的顺序。
【过关训练1】0.100mol/L的氢氧化钠溶液分别滴定10.00mL、0.100mol/L的醋酸溶液。
所得滴定曲线如下图。
在滴入盐酸的过程中,溶液的离子种类和浓度也会随之发生变化,请结合氢氧化钠溶液滴定醋酸溶液的曲线分析不同阶段时溶液中溶质的种类及离子浓度大小的顺序。
完成下表。
V(NaOH)/mL PH 溶液中的溶质溶液中离子浓度由大到小顺序57101520【变式应用1】(2013•松江区二模)将0.1mol/L氢氧化钠滴入等体积、浓度均为0.1mol/L的盐酸和醋酸中,能正确反映溶液pH变化曲线的是(实线表示盐酸,虚线表示醋酸))()A. B.C. D.【变式应用2】(2010·江苏,12)常温下,用0.100 0 mol ·L -1 NaOH 溶液滴定20.00 mL 0.1000 mol ·L-1 CH3COOH 溶液所得滴定曲线如右图。
下列说法正确的是 ( )A .点①所示溶液中:c (CH 3COO -)+c (OH -)=c (CH 3COOH)+c (H +)B .点②所示溶液中:c (Na +)=c (CH 3COOH)+c (CH 3COO -)C .点③所示溶液中:c (Na +)>c (OH -)>c (CH 3COO -)>c (H +)D .滴定过程中可能出现:c (CH 3COOH)>c (CH 3COO -)>c (H +)>c (Na +)>c (OH -)【变式应用3】已知常温下CH 3COOH 的电离平衡常数为K 。

酸碱中和滴定曲线图分析
酸碱中和是指一种涉及酸与碱之间反应的化学反应,反应后会形成一种新的盐类物质,并且产生相应的离子水合物,该反应是一种加成反应,可以直接把原来的酸或碱的原子或离子变成水的离子。
酸碱中和反应的滴定曲线是一种表示酸碱中和反应中溶液pH值随着反应的变化的曲线,能够直观地表示酸碱的反应情况,也能够更好地分析反应的最终结果。
酸碱中和滴定曲线图是由一组数据绘制出来的,其中包括了溶液中酸碱反应过程中PH值的变化情况,主要分为三个部分:滴定曲线中上升段、中间段和下降段。
滴定曲线的上升段指的是当溶液中的酸或碱慢慢加入时,pH值一直在上升,表明溶液中的酸或碱还没有发生反应。
滴定曲线中间段表明,随着酸或碱的加入,pH值达到最低点,表明酸碱发生了中和反应,反应的最终结果是pH值趋于7,表明溶液中的酸碱发生了中和反应,反应结束。
滴定曲线的下降段表明,随着酸或碱的继续加入,pH值开始下降,表明溶液中的酸碱发生了过量反应,反应的最终结果是pH值趋于小于7,表明溶液中的酸碱发生了过量反应,反应结束。
通过分析酸碱中和滴定曲线可以很清楚地看出,酸碱中和反应中的反应结果取决于酸碱的比例,如果酸碱的比例适当,
那么反应的最终结果就是pH值趋于7,表明溶液中的酸碱发生了中和反应,反应结束。
但是,如果酸碱的比例过大,那么反应的最终结果就是pH值趋于小于7,表明溶液中的酸碱发生了过量反应,反应结束。
以上就是关于酸碱中和滴定曲线图的分析,可以看出,酸碱中和滴定曲线图可以更加直观的表示酸碱中和反应中溶液pH值的变化情况,且可以更好地分析反应的最终结果,是一种非常有用的分析工具。

酸碱中和滴定曲线分析常温下,用0.1000mol·L-1NaOH溶液滴定20.00 mL 0.1000mol·L-1HA 溶液,溶液pH随NaOH溶液体积( V )的改变而变化的滴定曲线如图所示:【认识酸碱中和滴定曲线的相同点和不同点】高。
②突跃点变化范围不同:强碱与强酸反应(强酸与强碱反应)的突跃点变化范围大于强碱与弱酸反应(或强酸与弱碱反应) .③滴定终点的酸碱性不同,pH不同:室温下,当等体积、等浓度的一元强碱和一元强酸反应时,pH=7;但当等体积、等浓度的一元强碱和一元弱酸(或一元强酸和一元弱碱)反应时,pH>7(或pH<7) .④指示剂的选择不同:强酸滴定弱碱用甲基橙,强碱滴定弱酸用酚酞;强酸与强碱的滴定,用甲基橙和酚酞即学即用1.(2016·全国卷Ⅰ,12)298 K时,在20.0 mL 0.10 mol·L-1氨水中滴入0.10 mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。
已知0.10 mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是()A.该滴定过程应该选择酚酞作为指示剂B.M点对应的盐酸体积为20.0 mLC.M点处的溶液中c(NH+4)=c(Cl-)=c(H+)=c(OH-)D.N点处的溶液中pH<122.室温时,向20 mL 0.100 0 mol·L-1H2C2O4溶液中滴加0.100 0 mol·L-1NaOH溶液,混合溶液的pH随滴加NaOH溶液体积的变化关系如图所示。
下列有关叙述错误的是()A.忽略H2C2O4的第二步电离,由题给信息,可以计算出常温下H2C2O4的电离常数B.A、B、C三点所对应的溶液中,水的电离程度最小的是A点C.A、B、C三点所对应的溶液中,均有c(Na+)<c(OH-)+c(HC2O-4)+2c(C2O2-4)D.在B点溶液中,生成的含钠化合物有两种,且c(HC2O-4)+2c(C2O2-4)=0.100 0 mol·L-13.下列滴定中,指示剂的选择或滴定终点颜色变化有错误的是()提示:2KMnO4+5K2SO3+3H2SO4===6K2SO4+2MnSO4+3H2O、I2+Na2S===2NaI+S↓选项滴定管中的溶液锥形瓶中的溶液指示剂滴定终点颜色变化A NaOH溶液CH3COOH溶液酚酞无色→浅红色B HCl溶液氨水酚酞浅红色→无色C酸性KMnO4溶液K2SO3溶液无无色→浅紫红色【其他滴定】1.(2017·全国卷Ⅱ)草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为MnO-4+H++H2C2O4―→Mn2++CO2↑+H2O。


高中化学各种酸碱中和滴定曲线图的认识与应用1.滴定曲线的认识与应用酸碱中和滴定曲线图是以所滴入的酸或碱溶液的体积为横坐标、以中和反应后溶液的pH为纵坐标体现中和滴定过程的曲线图。
强酸与强碱互相滴定的曲线图,前半部分与后半部分形状变化不大,但中间突跃大(即酸或碱溶液一滴之差,溶液pH变化大,出现突变)。
a.分析强酸与强碱互相滴定时的离子浓度大小,只要关注水的电离平衡即可,没有其它平衡影响。
强酸滴定弱碱或强碱滴定弱酸的曲线图,突跃小,较平缓;强酸滴定弱碱的起点低(因弱碱pH相对较小),前半部分形状有差异;强碱滴弱酸的起点高(因弱酸pH相对较大),前半部分形状有差异。
b.分析强碱滴定弱酸或强酸滴定弱碱时的离子浓度大小,不仅要考虑生成盐的水解平衡,而且还要考虑过量弱酸或弱碱的电离平衡与水的电离平衡。
指示剂选择的原则:指示剂的选择不但要考虑变色明显、灵敏,而且要选择指示剂的变色范围与滴定时pH突跃范围相吻合,这样就能准确指示到达滴定终点(即酸碱恰好中和时的pH)。
强酸强碱互相滴定曲线图的应用例1.下图曲线a和b是盐酸与氢氧化钠的相互滴定的滴定曲线,下列叙述正确的是()A.盐酸的物质的量浓度为1.0mol·L-1B.P点时反应恰好完全,溶液呈中性C.曲线a是盐酸滴定氢氧化钠的滴定曲线D.酚酞不能用作本实验的指示剂解析:认识滴定曲线图是解题的关键,强酸与强碱相互滴定突跃大,且恰好中和时溶液pH=7,故酚酞、甲基橙均可作指示剂。
识图:滴定前pH=1,c(HCl)=0.1mol·L-1,pH=13,c(NaOH)=0.1mol·L-1。
显然a曲线为NaOH溶液滴定盐酸的曲线,曲线b为盐酸滴定NaOH溶液的曲线,P点表示盐酸与氢氧化钠恰好完全中和,溶液呈中性,唯B正确。
例2.298K时,在20.0mL0.10mol·L-1氨水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。


中和滴定曲线
中和滴定曲线是描述酸碱滴定过程中pH值随滴定剂加入量的
变化关系的曲线。
对于强酸强碱滴定,中和滴定曲线通常呈现
S型曲线的形式。
一般情况下,曲线的起点表示初始pH值,
滴定过程中的变化反映了溶液中酸碱物质的中和反应。
在曲线的起始阶段,溶液的pH值会随着滴定剂的加入而迅速
变化,这是因为滴定剂与溶液中存在的少量酸碱物质发生快速的反应。
此后,曲线会呈现出一个缓慢的变化阶段,直到滴定点附近。
滴定点是中和反应达到临界状态的时刻,此时溶液中的酸和碱物质的摩尔比接近1:1,pH值变化很小。
滴定点左侧曲线的变化速率较低,而滴定点右侧曲线的变化速率则加快。
最后,随着滴定剂的不断加入,溶液的pH值会迅速转变至碱性或酸性。
中和滴定曲线的形状和趋势受到滴定剂和被滴定物质性质的影响,因此可以通过观察滴定曲线来判断溶液中酸碱物质的浓度和反应的类型。

酸碱中和滴定曲线x酸碱中和滴定曲线酸碱中和滴定曲线是指,当滴定中和反应进行时,在反应过程中pH值的变化情况。
它是一条曲线,反映了酸碱反应过程中pH值的变化趋势。
酸碱中和曲线有6种不同形式:(1)单项酸型滴定:在单项酸型滴定过程中,滴定剂是一种基质,酸的浓度不会改变,pH值随着滴定剂的浓度增加而逐渐升高,直到它到达它的最大值(即弱酸碱点),然后稳定在一个水平,随着滴定剂的添加,pH值不再变化。
(2)单项碱型滴定:在单项碱型滴定过程中,滴定剂是一种碱,碱的浓度不会改变,pH值随着滴定剂的浓度增加而逐渐降低,直到它到达它的最低值(即弱酸碱点),然后稳定在一个水平,随着滴定剂的添加,pH值不再变化。
(3)酸碱双项滴定:在酸碱双项滴定中,酸和碱的浓度同时改变。
其中,随着滴定剂的添加,pH值先上升,直到达到它的最高值(即中和点),然后下降,直到达到它的最低值(即弱酸碱点),然后稳定在一个水平,随着滴定剂的添加,pH值不再变化。
(4)自发滴定:自发滴定是一种特殊的滴定反应,它可以用来表征该体系的自净能力。
在自发滴定过程中,pH值先上升,直到达到它的最高值(即中和点),然后下降,直到达到它的最低值(即弱酸碱点),然后稳定在一个水平,随着自发滴定反应的进行,pH值不会发生明显变化。
(5)复合滴定:复合滴定是一种复杂的滴定反应,参与滴定的物质不止一种,可能有多种酸、碱或其它物质同时参与滴定反应。
在复合滴定过程中,pH值先上升,直到达到它的最高值(即最弱碱中和点),然后下降,直到达到它的最低值(即最弱酸碱点),然后稳定在一个水平,随着滴定剂的添加,pH值不再变化。
(6)比较滴定:比较滴定是指将两种不同的滴定剂进行滴定,以获得滴定剂的酸碱力。
滴定剂的酸碱力越高,其pH值变化的范围就越大,也就是说,随着滴定剂的添加,pH值变化范围越大。
总之,酸碱中和滴定曲线主要表征滴定反应中pH值的变化趋势,可以为更准确地判断物质的酸碱性提供参考依据。

酸碱中和反应的滴定曲线实验及教学总结酸碱中和反应是化学实验中常见的一类实验,通过滴定曲线的分析可以了解反应的进程和终点,为实验结果的准确性提供参考。
本文将介绍酸碱中和反应的滴定曲线实验以及实验的教学总结。
一、实验原理酸碱滴定实验是通过滴定管分次滴加酸碱溶液,并记录滴定过程中溶液的pH值的变化,然后绘制出滴定曲线。
实验中一般会使用酸碱指示剂来标记反应的终点,通常使用的指示剂有酚酞、溴酚蓝等,当溶液的pH值与指示剂的酸碱转折点相同时,颜色会发生明显的变化。
二、实验步骤1. 准备实验材料:酸、碱溶液;酸碱指示剂;滴定管等。
2. 将酸碱溶液倒入两个容量瓶中,分别作为滴定溶液和被滴定溶液。
3. 在滴定瓶中取一定量的被滴定溶液,并加入几滴指示剂。
4. 使用滴定管将滴定溶液缓慢滴加到被滴定溶液中,同时记录每次滴定的体积和相应的pH值。
5. 当溶液的颜色发生明显改变时,记下此时的滴定体积,并停止滴定。
6. 重复实验多次,取平均值并绘制出滴定曲线。
三、实验结果与分析根据实验步骤进行酸碱滴定实验后,得到一系列滴定点的数据,可以利用这些数据绘制出滴定曲线。
滴定曲线常常分为三个区域:初始区、过渡区和饱和区。
1. 初始区:开始时,被滴定溶液的pH值较高,滴定溶液逐渐加入后,pH值会缓慢下降,这一段曲线比较平缓。
2. 过渡区:当反应接近中和终点时,pH值的变化会变得更加明显,滴定溶液的加入会导致pH值的剧烈变化,曲线会急剧上升或下降。
3. 饱和区:当滴定末端临近时,pH值的变化会非常缓慢,曲线逐渐趋于平缓,直至接近中和终点。
通过分析滴定曲线,可以了解滴定的中和终点、等当点以及反应的速率等信息。
实验中使用的酸碱指示剂也起到了至关重要的作用,它可以在反应中起到标记终点的作用。
四、实验总结与教学经验酸碱中和反应的滴定曲线实验是化学教学中常见的实验内容,通过这个实验可以培养学生的实验操作技能和数据处理能力,同时也对他们的实验设计和结果分析提出了一定要求。

酸碱滴定曲线的变化规律
酸碱滴定曲线的变化规律可以根据酸碱滴定反应的性质和滴定过程中的pH值变化来描述。
一般情况下,酸碱滴定曲线呈S型,可以分为以下几个阶段
来描述其变化规律:
1. 初始阶段:在开始滴定时,溶液中初始酸或碱的浓度较高,pH值迅速变化。
此时,滴定曲线呈现水平线段,代表酸碱的
初始pH值。
2. 垂直跃升阶段:当滴加碱滴加到与酸等量时,发生中和反应,溶液中的酸和碱被完全中和,pH值迅速跃升。
此时,滴定曲
线会出现一个明显的垂直线段,称为等价点。
3. 下降阶段:当继续滴加过量的碱时,溶液中的酸已经完全中和,多余的碱开始影响溶液的pH值。
此时,滴定曲线会再次
开始下降,表示溶液呈酸性。
4. 平坦阶段:在溶液中加入过量的碱后,溶液中的酸已经完全中和,多余的碱对溶液pH值的影响非常小,因此滴定曲线会
呈现一个平坦的线段,表示溶液呈碱性。
总之,酸碱滴定曲线的变化规律主要包括初始阶段、垂直跃升阶段、下降阶段和平坦阶段。
这些变化规律是由酸碱反应的性质和滴定过程中的pH值变化所决定的。
化学酸碱滴定反应的滴定曲线分析滴定是一种常用的化学分析方法,用于测定溶液中的酸碱浓度。
滴定过程中,根据滴定剂的加入量与反应物的摩尔比例,可以得到一条滴定曲线。
通过分析滴定曲线,可以进一步了解反应的特性和数值,以及反应物之间的摩尔比例。
本文将介绍化学酸碱滴定反应的滴定曲线分析方法及其应用。
一、滴定曲线的基本形状在化学酸碱滴定反应中,滴定剂以滴定管逐滴加入反应容器中的待测溶液。
滴定曲线是指在滴定过程中,记录草酸溶液体积与滴定剂加入量的关系所得的曲线。
根据滴定剂和反应物的化学性质,滴定曲线的基本形状可分为以下几种:1. 单斜线形:当滴定剂的滴定容量与反应物的化学计量数相等时,滴定曲线呈单斜线形。
这种情况下,滴定剂与反应物基本以一比一的比例反应,滴定曲线斜率始终保持不变。
2. S 形:当滴定剂的滴定容量大于或小于反应物的化学计量数时,滴定曲线呈 S 形。
在初始阶段,随着滴定剂加入量的增加,反应物浓度迅速下降,滴定曲线下降。
随后变得平缓,滴定曲线几乎呈水平状态。
最后,滴定点附近出现急剧下降,滴定曲线再次下降。
3. V 形:当滴定剂与反应物发生中和反应时,滴定曲线呈 V 形。
初始阶段,滴定剂加入量增加,反应物浓度迅速下降,滴定曲线下降。
随后,在滴定点附近,由于滴定剂与反应物中和反应达到平衡,滴定曲线出现水平段。
最后,滴定剂加入量继续增加,反应物浓度降至很低,滴定曲线再次下降。
二、滴定曲线分析方法分析滴定曲线主要有三个关键参数:起始点、滴定点和终点。
起始点为滴定剂加入量为0时反应物浓度的数值;滴定点为滴定剂加入量与反应物摩尔比例相等时的点;终点为滴定剂加入量达到理论滴定终点时的点。
通过分析这些关键点,可以计算出酸碱溶液的浓度。
1. 确定起始点:在滴定曲线的初始阶段,滴定剂加入量为0,反应物浓度为初始浓度。
应观察滴定曲线的起点,确定起始点的坐标。
2. 确定滴定点:滴定点是指滴定剂加入量等于反应物化学计量数时的点。
酸碱中和滴定曲线引言酸碱中和滴定曲线是化学分析中常用的一种实验方法,通过滴定过程中溶液的pH 值变化,可以推断酸碱溶液的浓度。
本文将对酸碱中和滴定曲线的原理、滴定曲线的类型和如何解读滴定曲线进行详细探讨。
原理酸碱滴定是一种定量分析方法,通过滴定溶液A(滴定液)与溶液B(被滴定液)反应,测定溶液B中的酸或碱的浓度。
滴定过程中,用一种称为指示剂的化学物质来指示滴定终点。
当滴定终点达到时,指示剂的颜色发生明显变化。
在滴定过程中,溶液A(或称为滴定剂)一般是已知浓度的酸或碱,溶液B是未知浓度的酸或碱溶液。
滴定过程中,溶液A先加入到溶液B中,然后通过滴定管滴加溶液A,同时不断搅拌,直到出现指示剂颜色变化的终点。
通过记录溶液A的用量和滴定过程中溶液B的pH值变化,可以绘制出酸碱中和滴定曲线。
酸碱中和滴定曲线的类型酸碱中和滴定曲线根据溶液B的性质可以分为以下几类:强酸强碱滴定曲线强酸强碱滴定曲线是最常见的滴定曲线类型。
在滴定的早期阶段,溶液B中的酸性物质呈现出快速的pH变化,直到滴定终点出现。
滴定终点时,溶液B的pH值迅速增加。
强酸弱碱滴定曲线强酸弱碱滴定曲线与强酸强碱滴定曲线相似,但在滴定终点的pH值上升速度更缓慢。
这是因为弱碱的缓冲能力较强,使得pH值变化的速率减慢。
弱酸强碱滴定曲线弱酸强碱滴定曲线与强酸弱碱滴定曲线相似,但在滴定终点的pH值上升速度更快。
这是因为强碱可以更快地中和弱酸,使得溶液B的pH值快速增加。
弱酸弱碱滴定曲线弱酸弱碱滴定曲线是变化最为缓慢的一种类型,滴定终点的pH变化较小,很难观察到明显的颜色变化。
如何解读滴定曲线解读滴定曲线是分析滴定过程中酸碱浓度变化的一种重要方法。
以下是解读滴定曲线的一般步骤:1.确定滴定终点:滴定终点是指溶液B中的酸碱中和反应完成的位置。
在滴定曲线上,滴定终点通常是曲线最陡峭的位置,对应于pH值的最大变化。
2.计算滴定终点的pH值:根据滴定曲线,可以通过查找滴定终点对应的体积和pH值来计算滴定终点的pH值。
酸碱中和滴定曲线分析及溶液中粒子浓度
大小的比较难点剖析
酸碱中和滴定曲线分析是一种用来评价溶液中粒子浓度大小的重要方法,它反映了溶液中酸碱的结合反应,可以用来判断酸碱的强度,以及其它物质的浓度。
由于这种分析方法的重要性,许多学者和研究人员都在探索它的原理,以及如何利用它来解决实际问题。
酸碱中和滴定曲线分析的基本原理是,将一定量的酸和碱一起混合,采用pH试纸或电子称来测量溶液的pH值,从而得到溶液中粒子浓度的变化情况。
在滴定曲线中,当pH值从低到高时,粒子浓度会逐渐增加,表示酸碱反应加剧,直至pH值达到中和点,表示反应已经达到平衡,此时粒子浓度最大,可以作为评价溶液中粒子浓度大小的参考。
要想分析溶液中粒子浓度的大小,需要熟练掌握酸碱中和滴定曲线分析的基本原理。
首先要准确测量溶液的pH值,以及根据pH值的变化来判断酸碱的强度,即酸碱反应的程度。
然后,根据滴定曲线的变化规律,从而分析溶液中粒子浓度的大小。
此外,在实际分析中,还需要注意溶液中的其它物质,如有机物和无机物等,它们也会影响酸碱反应的程度,从而影响溶液中粒子浓度的大小。
因此,在分析酸碱中和滴定曲线时,
要考虑到溶液中其它物质的存在,以便更准确地分析溶液中粒子浓度的大小。
总之,酸碱中和滴定曲线分析是一种重要的分析方法,可以用来评价溶液中粒子浓度的大小。
要想掌握这种分析方法,不仅要熟练掌握其基本原理,还要考虑到溶液中其它物质的存在,以便更准确地分析溶液中粒子浓度的大小。