专题09强碱滴定三元酸曲线 2019高考复习专题——酸碱中和滴定曲线大全Word版含解析
- 格式:doc
- 大小:1.65 MB
- 文档页数:13
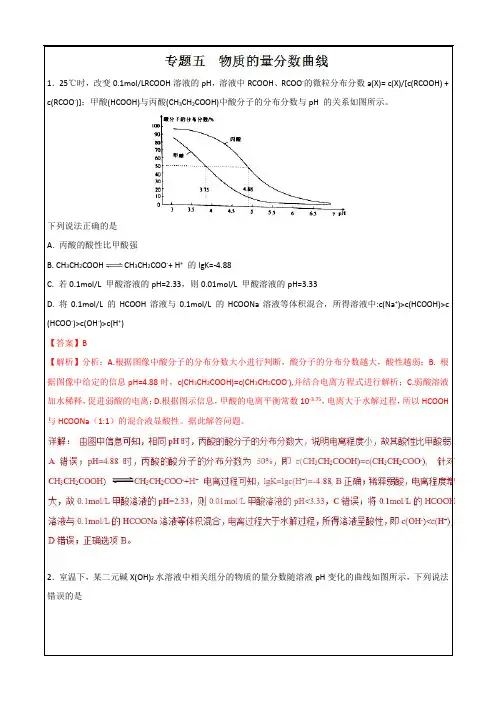



1.砷(As)是一些工厂和矿山废水中的污染元素。
常温下,H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与加NaOH溶液调节pH的关系如图所示(已知:p K a=-lg K a),下列说法错误的是A. Na2HAsO4溶液显碱性B. H3AsO4溶液p K a2为2.2C. m点对应溶液中由水电离出的c(OH-)为10-2.5mol·L-1D. n点对应溶液中离子浓度关系为:c(Na+)>c(HAsO42-)=c(H2AsO4-)>c(H+)=c(OH-)2.25℃时,向10mL0.1mol·L-1H3AsO4水溶液滴加0.1 mol·L-1NaOH溶液,含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如下图,下列说法错误的是A. H3AsO4H2AsO4-+H+的电离常数为10-2.2B. b点所处溶液中:c(Na+)=3c(H2AsO4-)+3c(AsO43-)C. 水的电离程度:a>b>cD. HAsO4-的水解程度大于电离程度3.亚砷酸(H3AsO3)可用于治疗白血病,在溶液中存在多种微粒形态。
向1L0.1mol·L-1 H3AsO3溶液中逐滴加入0.1mol·L-1KOH溶液,各种微粒物质的量分数与溶液的pH 关系如下图所示。
下列说法正确的是( )A. H3AsO3的电离常数K a1的数量级为10-9B. pH在8.0~10.0时,反应的离子方程式:H3AsO3+OH-=H2AsO3-+H2OC. M点对应的溶液中:c(H2AsO3-)+c(HAsO32-)+c(AsO33- )+c(H3AsO3)= 0.1mol·L-1D. pH=12时,溶液中:c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(H3AsO3)>c(H+)+c(K+)4.常温下,某酸H3A水溶液中含A的各种粒子的分布分数(平衡时某种粒子的浓度占各粒子浓度之和的分数)与pH关系图如下所示,下列说法正确的是A. NaH2A水溶液呈碱性B. H3A溶液中存在:c(H+)=c(OH-)+c(H2A-)+c(HA2-)+c(A3-)C. 向H3A溶液中加入一定量的NaOH溶液至pH=5时,D. 向H3A溶液中加入氨水使PH从5→9发生的主要离子反应是:H2A-+OH-=HA2-+H2O5.亚砷酸(H3AsO3)可以用于治疗白血病,在溶液中存在多种微粒形态。
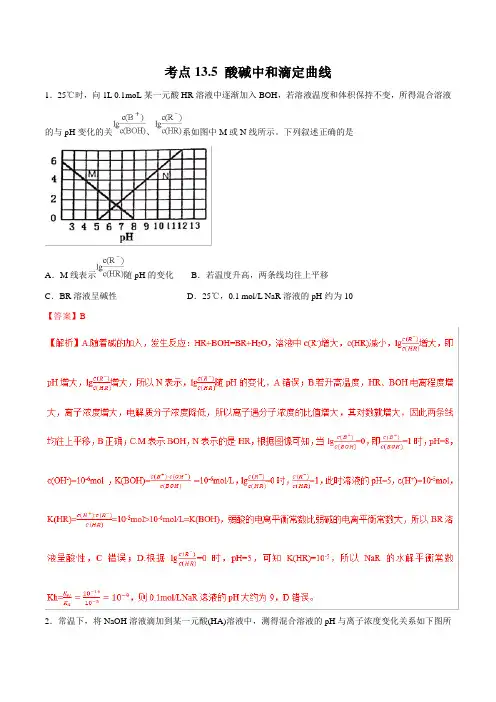
考点13.5 酸碱中和滴定曲线1.25℃时,向1L 0.1moL某一元酸HR溶液中逐渐加入BOH,若溶液温度和体积保持不变,所得混合溶液的与pH变化的关、系如图中M或N线所示。
下列叙述正确的是A.M线表示随pH的变化B.若温度升高,两条线均往上平移C.BR溶液呈碱性D.25℃,0.1 mol/L NaR溶液的pH约为10【答案】B2.常温下,将NaOH溶液滴加到某一元酸(HA)溶液中,测得混合溶液的pH与离子浓度变化关系如下图所示[已知:]。
下列叙述不正确...的是A.K a(HA) = 10-4.76B.滴加NaOH溶液过程中,保持不变C.m点所示溶液中:c(H+) = c(HA)+c(OH-)-c(Na+)D.n点所示溶液中可能:c((Na+) = c(A-)+c(HA)【答案】D3.25℃时,向20mL 0.1 mol·L -1二元弱酸H2A 溶液中逐滴加入0.1 mol·L -1NaOH 溶液,混合溶液中H2A、HA-、A2-的物质的量分数随pH 的变化如图所示(混合时不考虑体积变化)。
下列叙述正确的是A.H2A 溶液中存在微粒浓度关系:2c(A2-) + c(HA- )+ c(OH-) = c(H2A) + c(H+)B.N 点pH=4.2 时,c(A2-) = c(HA-),A2-水解程度与HA-电离程度相等C.0.1 mol·L-1H2A 溶液与0.1 mol·L-1NaOH 溶液混合后,溶液中HA- 物质的量分数位于曲线 b 的最大值D.滴加氢氧化钠的体积为10mL时,c(A2-) + c(HA-) + c(H2A)+ c(Na+) = 0.1 mol·L-1【答案】D4.25℃时,向某Na2CO3溶液中加入稀盐酸,溶液中含碳微粒的物质的量分数(φ)随溶液pH变化的部分情况如图所示。
下列说法中正确的是A.pH=7时,c(Na+)=(Cl-)+c(HCO3-)+2c(CO32-)B.pH=8时,c(Na+)=c(C1-)C.pH=12时,c(Na+ )>c(OH-)>c(CO32-)>c(HCO3-)>c(H+)D.25℃时,CO32-+H2O HCO3-+OH-的水解平衡常数K h=10-10mol·L-1【答案】A【解析】A、由电荷守恒:c(Na+)+c(H+)=(OH-)+Cl-)+c(HCO3-)+2c(CO32-), pH=7时,c(H+)=(OH-),c(Na+)=(Cl-)+c(HCO3-)+2c(CO32-),故A正确;B、pH=8时溶液为碳酸氢钠和氯化钠,溶液中c(Cl-)<c(Na+),故B错误;C、pH=12时,溶液为Na2CO3溶液,先电离,然后碳酸根离子水解生成碳酸氢根离子和氢氧根离子,碳酸氢根离子水解生成碳酸和氢氧根离子,c(Na+ )>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),故C错误;D、CO32-的水解常数Kh=c(HCO3-)c(OH-)/c(CO32-),当溶液中c(HCO3-):c(CO32-)=1:1时,图象可知PH=10,c(H+)=10-10mol·L-1,由Kw可知c(OH-)=10-4mol·L-1,则Kh=c(HCO3-)c(OH-)/c(CO32-)=c(OH-)=10-4mol·L-1,故D错误。

专题09 强碱滴定三元酸曲线1.砷(As)是一些工厂和矿山废水中的污染元素。
常温下,H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与加NaOH溶液调节pH的关系如图所示(已知:p K a=-lg K a),下列说法错误的是A. Na2HAsO4溶液显碱性B. H3AsO4溶液p K a2为2.2C. m点对应溶液中由水电离出的c(OH-)为10-2.5mol·L-1D. n点对应溶液中离子浓度关系为:c(Na+)>c(HAsO42-)=c(H2AsO4-)>c(H+)=c(OH-)【答案】B【解析】分析:A.根据Na2HAsO4溶液pH大于7判断;B.根据H3AsO4的电离平衡常数计算;C.m点对应溶液为HAsO42-和AsO43-的混合溶液,溶液显碱性,说明是盐的水解的原因;D.n点对应溶液pH=7,溶液呈中性,据此解答。
详解:A.根据图象分析可知,HAsO42-溶液pH大于7,溶液显碱性,A正确;B.H3AsO4的K a2=,pH=7时c(HAsO42-)=c(H2AsO4-),K a2=c(H+)=10-7,pK a2=7,B错误;C.m点对应溶液为HAsO42-和AsO43-的混合溶液,溶液显碱性,盐类水解促进水的电离,m点溶液的pH=11.5,则对应溶液中由水电离出的c(OH-)为10-2.5mol·L-1,C正确;D.n点对应溶液pH=7,溶液中c(Na+)>c(HAsO42-)=c(H2AsO4-)>c(H+)=c(OH-),D正确;答案选B。
2.25℃时,向10mL0.1mol·L-1H3AsO4水溶液滴加0.1 mol·L-1NaOH溶液,含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如下图,下列说法错误的是A. H3AsO4H2AsO4-+H+的电离常数为10-2.2B. b点所处溶液中:c(Na+)=3c(H2AsO4-)+3c(AsO43-)C. 水的电离程度:a>b>cD. HAsO4-的水解程度大于电离程度【答案】C3.亚砷酸(H3AsO3)可用于治疗白血病,在溶液中存在多种微粒形态。





1.砷(As)是一些工厂和矿山废水中的污染元素。
常温下,H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与加NaOH溶液调节pH的关系如图所示(已知:p K a=-lg K a),下列说法错误的是
A. Na2HAsO4溶液显碱性
B. H3AsO4溶液p K a2为2.2
C. m点对应溶液中由水电离出的c(OH-)为10-2.5mol·L-1
D. n点对应溶液中离子浓度关系为:c(Na+)>c(HAsO42-)=c(H2AsO4-)>c(H+)=c(OH-)
【答案】B
【解析】分析:A.根据Na2HAsO4溶液pH大于7判断;
B.根据H3AsO4的电离平衡常数计算;
C.m点对应溶液为HAsO42-和AsO43-的混合溶液,溶液显碱性,说明是盐的水解的原因;D.n点对应溶液pH=7,溶液呈中性,据此解答。
详解:A.根据图象分析可知,HAsO42-溶液pH大于7,溶液显碱性,A正确;
B.H3AsO4的K a2=,pH=7时c(HAsO42-)=c(H2AsO4-),K a2=c(H+)=10-7,pK a2=7,B错误;
C.m点对应溶液为HAsO42-和AsO43-的混合溶液,溶液显碱性,盐类水解促进水的电离,m 点溶液的pH=11.5,则对应溶液中由水电离出的c(OH-)为10-2.5mol·L-1,C正确;
D.n点对应溶液pH=7,溶液中c(Na+)>c(HAsO42-)=c(H2AsO4-)>c(H+)=c(OH-),D正确;答案选B。
2.25℃时,向10mL0.1mol·L-1H3AsO4水溶液滴加0.1 mol·L-1NaOH溶液,含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如下图,下列说法错误的是
A. H3AsO4H2AsO4-+H+的电离常数为10-2.2
B. b点所处溶液中:c(Na+)=3c(H2AsO4-)+3c(AsO43-)
C. 水的电离程度:a>b>c
D. HAsO4-的水解程度大于电离程度
【答案】C
3.亚砷酸(H3AsO3)可用于治疗白血病,在溶液中存在多种微粒形态。
向1L0.1mol·L-1 H3AsO3溶液中逐滴加入0.1mol·L-1KOH溶液,各种微粒物质的量分数与溶液的pH 关系如下图所示。
下列说法正确的是( )
A. H3AsO3的电离常数K a1的数量级为10-9
B. pH在8.0~10.0时,反应的离子方程式:H3AsO3+OH-=H2AsO3-+H2O。