实验一盐酸含量的测定(精)
- 格式:ppt
- 大小:224.50 KB
- 文档页数:28

盐酸含量国标检测方法盐酸含量是衡量盐酸产品质量的重要指标之一。
为了确保盐酸产品的质量符合国家标准,需要进行盐酸含量的检测。
本文将介绍盐酸含量国标检测方法。
一、检测原理盐酸含量的检测原理是利用酸碱滴定反应。
盐酸溶液与碱溶液进行滴定反应,当酸碱滴定到等量点时,酸碱中和反应完全,通过测定滴定液的消耗量,可以计算出盐酸含量。
二、实验仪器和药品1.实验仪器:滴定管、容量瓶、酸碱滴定仪等。
2.实验药品:盐酸溶液、酸碱指示剂、标准碱溶液等。
三、操作步骤1.样品准备:将待检测的盐酸样品取一定量放入容量瓶中。
2.酸碱滴定:将待测盐酸样品溶液加入滴定管中,加入适量的酸碱指示剂,开始进行滴定。
滴定过程中,需要慢慢滴入标准碱溶液,同时不断摇晃容量瓶,直到溶液颜色发生明显改变。
3.记录结果:记录标准碱溶液滴定的体积,根据滴定液的消耗量,计算盐酸溶液的含量。
四、计算公式盐酸含量的计算公式如下:盐酸含量(%)=(标准碱溶液滴定体积×标准碱溶液的浓度×36.46)/(样品的质量×100)五、结果分析根据计算得出的盐酸含量,与国家标准进行比较。
如果盐酸含量符合国家标准要求,则产品合格;如果盐酸含量低于国家标准要求,则产品质量不合格。
六、注意事项1.实验操作时需要严格按照实验室操作规范进行,确保实验安全。
2.使用的实验仪器和药品要干净、无污染,以免影响实验结果。
3.滴定过程中需要缓慢滴加标准碱溶液,避免滴加过快导致误差。
4.计算时要注意单位的换算和数值的精确性,避免计算错误。
七、总结盐酸含量国标检测方法是一种简单、快速、准确的检测方法,能够有效地评估盐酸产品的质量。
通过严格按照国家标准进行检测,可以保证盐酸产品的质量符合国家要求,并确保产品的安全使用。
通过本文的介绍,相信大家对盐酸含量国标检测方法有了更加深入的了解。
在实际操作中,我们应该严格遵循操作规范,确保检测结果的准确性,以提高盐酸产品的质量水平。


盐酸溶液浓度的标定盐酸溶液浓度的标定是化学分析实验中常见的一种实验操作,旨在确定盐酸溶液中盐酸的含量,从而获得溶液的浓度值。
本文将介绍盐酸溶液浓度的标定实验的操作流程、注意事项以及实验结果处理方法。
实验原理盐酸是一种无色透明易挥发的液体,具有强酸性。
盐酸溶液的浓度通常用摩尔浓度表示,即每升溶液中所包含的盐酸的物质的量。
盐酸溶液浓度的标定实验是通过与已知浓度的氢氧化钠溶液反应,测定反应后剩余的氢氧化钠浓度来确定盐酸的浓度。
该反应为酸碱滴定反应,反应式为:HCl + NaOH → NaCl + H2O在盐酸溶液中加入苯酚指示剂,使溶液呈现出酸性环境时的颜色,然后再以氢氧化钠溶液滴定至中性。
当盐酸与氢氧化钠滴定剂的物质的量相等时,称为终点,此时溶液中的酸碱物质的量相等,反应已达到完全中和的状态。
通过计算加入氢氧化钠溶液的体积和浓度,可以计算出盐酸溶液的浓度。
实验操作流程1. 实验器材准备:氧化钠粉末、盐酸标定溶液、已知浓度的氢氧化钠溶液、苯酚指示剂、滴定管、烧杯、容量瓶、量筒、移液管、胶头滴管、玻璃棒等。
2. 测定已知浓度氢氧化钠溶液的体积 V1 :用移液管取出一定体积的已知浓度氢氧化钠溶液加入烧杯中,在其中加入一滴苯酚指示剂,然后开始以盐酸标定溶液进行滴定至溶液呈现出粉红色,标志着滴定已达到终点。
4. 实验数据处理:用已知浓度氢氧化钠溶液的体积 V1 和浓度计算出加入滴定管中的氢氧化钠物质的量n1;用盐酸标定溶液的体积 V2 和滴定到终点所加入的氢氧化钠溶液体积 V3 计算出被滴定溶液中氢氧化钠的物质的量n2。
由于酸碱滴定反应是一种1:1的反应,因此n1=n2,再根据摩尔浓度的定义,计算出盐酸的浓度。
注意事项1. 操作前需认真阅读实验方法,理解实验原理与需要达到的实验目的。
2. 选择合适的荧光杯和荧光检测器对溶液进行检测。
3. 滴定剂的浓度应该确保准确,避免对实验结果产生影响。
4. 实验操作应该严格按照指定步骤进行,避免出现误差。

盐酸含量的测定方法盐酸含量的测定是一项极为重要的实验,它可以帮助我们确定盐酸的准确含量。
本文从实验室分析测定盐酸含量的原理以及实施步骤入手,给出细致的说明,以期可以帮助读者更好地了解盐酸含量测定的过程。
一、盐酸含量测定的原理盐酸是一种碱性无机氯离子水溶液,由氯离子和氢离子组成,表达式HCl。
其含量可以用滴定法测定。
盐酸测定使用的主要试剂是burette,可以精确控制氯离子的添加量,并根据氯离子的增加量来测定氢离子的总量。
在滴定过程中,在加入滴定液之前,我们需要将硫酸钠溶液放入磨机中,然后通过滴定装置,每次滴加0.1ml的硫酸钠溶液,经过一段时间搅拌,直到获得指定颜色。
二、实验步骤1、准备实验构成物:(1)准备试剂:90ml氯离子析出液(10%),4ml硫酸钠溶液;(2)准备设备:100ml容量的烧杯,滴定装置,磨机等。
2、实验过程(1)将硫酸钠溶液倒入烧杯内,搅拌均匀;(2)将滴定装置放入磨机中,每次滴定加入0.1ml硫酸钠溶液,搅拌至变色;(3)将氯离子析出液慢慢加入,记录滴定法加入的氯离子析出液的量;(4)计算和分析测定结果:示例:盐酸的总含量=(滴定液总量÷总体积)×1000其中:滴定液总量=硫酸钠溶液滴定量+氯离子析出液滴定量总体积=硫酸钠溶液体积+氯离子析出液体积3、实验结果根据实验,我们可以获得本次实验的实际盐酸含量测定结果,可以作为对该样品的准确报告。
三、安全措施1、操作前应先熟悉实验程序,做到了解每个步骤的含义。
2、准备好实验室操作安全设备,避免受到任何伤害。
3、加入试剂时,应慢慢加入,防止试剂突然喷出,从而造成事故。
4、实验室操作时应穿防护服装,防止试剂对身体的伤害。
五、总结本文的目的是介绍盐酸含量的测定,从实验室实验原理以及实施步骤入手,为读者细致描述盐酸含量的测定,以期使读者更加全面地了解该实验的过程。
随着科技的进步,我们可以从更多的角度测定盐酸含量,例如电化学滴定等,从而更准确地测定盐酸含量,为后续科学研究奠定基础。

盐酸-氯化铵混合溶液各组分含量的测定摘要通过用NaOH溶液测定盐酸-氯化铵混合溶液中各组分的含量。
掌握配制NaOH标准溶液的方法,学会用甲醛法进行弱酸的强化,掌握分步滴定的原理与条件。
其中HCl为一元强酸,NH4Cl为强酸弱碱盐,两者Ka之比大于10,固可分步滴定。
根据混合酸连续滴定的原理,盐酸是强酸,第一步可直接对其滴定,用NaOH滴定,以甲基红为指示剂。
氯化铵是弱酸,其Cka≤10,无法直接滴定,但可用甲醛将其强化,加入酚酞指示剂,再用NaOH标准溶液滴定。
通过两次滴定可分别求出HCl与NH4Cl的浓度。
该方法简便易行且准确度高,基本符合实验要求。
关键词盐酸-氯化铵混合溶液,甲醛法,酸碱滴定法,指示剂-851引言目前国内外测定盐酸-氯化铵混合溶液中各组分含量的方法有三种:+第一种方案:是蒸汽法:即取一份混合溶液往其中加入适量的NaOH溶液加热使NH4全部转化为氨气,用2%硼酸溶液吸收,用氢氧化钠标准溶液滴定NH3的体积,再用酸碱滴定法测定HCl的含量,[1]这种方法实验误差较小。
第二种方案:先测总氯离子的浓度,可用已知浓度的AgNO3溶液滴定待测液,至溶液中出现砖红+色沉淀停止,记录所用AgNO3溶液的体积。
然后用甲醛法测定NH4离子的浓度,最后根据计算得盐酸[2]的浓度�v若对相对误差要求较高,可做空白实验以减小蒸馏水中氯离子带来的系统误差�w。
第三种方案:先用甲基红作指示剂,用氢氧化钠标准溶液滴至混合溶液呈黄色,即为盐酸的终点。
加中性甲醛试剂,充分摇动并放置1分钟,加酚酞指示剂,仍用氢氧化钠滴至溶液由黄色变为金黄色即为氯化铵的终点。
根据所消耗NaOH的体积计算各组分的含量,这种方法简便易行,且准确[3]度较高。
本实验采用第三种方案进行盐酸-氯化铵混合溶液中各组分含量的测定。
�v本方法的相对误差约为0.1%,在误差要求范围之内�w。
2实验原理HCl和NH4Cl都可以和NaOH反应,反应方程式为:NaOH + HCl= NaCl + H2O 、NH4Cl+NaOH=NH3+H2O+NaCl。


盐酸标准溶液浓度的标定及碱灰中总碱度的测定实验报告摘要:练习了配制盐酸,以Na2CO3为基准物质标定盐酸,并以该盐酸滴定来测定碱灰总碱度的实验操作。
熟悉了滴定操作,学习了将酸碱滴定运用于实际测定的方法.关键词:标定盐酸酸碱滴定碱灰总碱度测定1、综述:标定盐酸溶液的常用基准物质是硼砂或污水碳酸钠.考虑到碱灰的测定实验要用本实验制备的盐酸标准溶液测定混合碱(Na2CO3/NaOH、Na2CO3/ NaHCO3),因此本实验选用无水碳酸钠作为基准物质标定盐酸,以保证标定和测量条件一致,减少实验误差.无水碳酸钠容易提纯,价格便宜,但具有吸湿性。
因此Na2CO3固体需先在烘箱中于180℃高温下烘2~3h,然后置于干燥器中冷却后备用.Na2CO3与HCl的反应如下:Na2CO3+2HCl= 2NaCl+H2O+CO2↑计量点时溶液的pH值约为4,可选用甲基橙作指示剂。
滴定终点,溶液由黄色变为橙色.根据Na2CO3的质量和所消耗的HCl的体积,即可计算出准确浓度.碱灰为不纯的Na2CO3,其中混有少量的NaOH或NaHCO3杂质。
用酸滴定,以甲基橙为指示剂,以上组分均被中和,测定的结果是碱的总量,常用Na2O含量来表示。
HCl滴定Na2CO3的反应如下Na2CO3+HCl====NaHCO3+NaCl NaHCO3+HCl====NaCl+CO2+H2O可见反应到第一化学计量点pH值约为8。
3,第二化学计量点pH值约为3.9。
测定总碱度时,化学计量点的pH值突跃在3。
9附近。
2、仪器与试剂:0.1mol/L的HCl标准溶液、无水碳酸钠、甲基橙指示剂、碱灰试样。
3、试验方法:(1)盐酸标定:配制0。
1mol/LHCl500mL:取6nol/L浓盐酸8。
3mL稀释至500mL转移至细口瓶中。
Na2CO3标定HCl:称取适量Na2CO3(消耗HCl20—30mL,0.106~0.16g),加入约30mL水溶解,若不溶可加热;加入两滴甲基橙指示剂,以0.1MOL/LHCl滴定至黄色转变为橙色为终点。

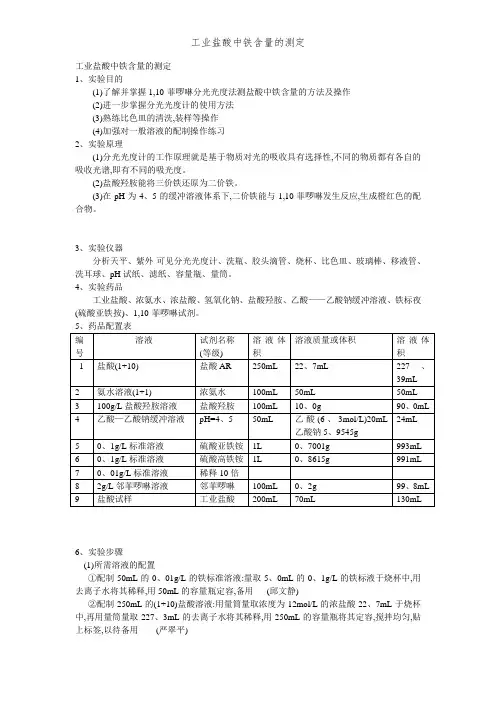
工业盐酸中铁含量的测定1、实验目的(1)了解并掌握1,10-菲啰啉分光光度法测盐酸中铁含量的方法及操作(2)进一步掌握分光光度计的使用方法(3)熟练比色皿的清洗,装样等操作(4)加强对一般溶液的配制操作练习2、实验原理(1)分光光度计的工作原理就是基于物质对光的吸收具有选择性,不同的物质都有各自的吸收光谱,即有不同的吸光度。
(2)盐酸羟胺能将三价铁还原为二价铁。
(3)在pH为4、5的缓冲溶液体系下,二价铁能与1,10-菲啰啉发生反应,生成橙红色的配合物。
3、实验仪器分析天平、紫外-可见分光光度计、洗瓶、胶头滴管、烧杯、比色皿、玻璃棒、移液管、洗耳球、pH试纸、滤纸、容量瓶、量筒。
4、实验药品工业盐酸、浓氨水、浓盐酸、氢氧化钠、盐酸羟胺、乙酸——乙酸钠缓冲溶液、铁标夜(硫酸亚铁按)、1,10-菲啰啉试剂。
6、实验步骤(1)所需溶液的配置①配制50mL的0、01g/L的铁标准溶液:量取5、0mL的0、1g/L的铁标液于烧杯中,用去离子水将其稀释,用50mL的容量瓶定容,备用(邱文静)②配制250mL的(1+10)盐酸溶液:用量筒量取浓度为12mol/L的浓盐酸22、7mL于烧杯中,再用量筒量取227、3mL的去离子水将其稀释,用250mL的容量瓶将其定容,搅拌均匀,贴上标签,以待备用(严翠平)③配制100mL的(1+1)氨水溶液(第二次用的就是氢氧化钠):用量筒量取浓氨水50mL于烧杯中再用量筒量取50mL去离子水将其稀释,搅拌均匀,贴上标签,备用(任云杰)④配制100mL的盐酸羟胺溶液:准确称取10、0g的盐酸羟胺试剂于烧杯中,再用适宜量的去离子水将其溶解,搅拌均匀,用100mL的容量瓶将其定容,贴上标签,备用(蒋滟耀)⑤配制100mL的1,10-菲啰啉溶液:准确称取0、2g的1,10-菲啰啉试剂于烧杯中,再用适宜量的去离子水将其溶解,搅拌均匀,用100mL的容量瓶将其定容,贴上标签,以待备用(邱文静)⑥配制100mLHAc--NaAc缓冲溶液(pH=4、5):准确称取11、8908g的乙酸钠,再用量筒量取40mL的冰醋酸于烧杯中,用去离子水稀释,用100mL容量瓶定容贴上标签,以待备用(严翠平)⑦配制200mL的试样溶液:称取早已洗净烘干的空具塞锥形瓶的质量为m mL,在量取70mL的工业盐酸于瓶中,再次称量,在置于内装100mL去离子水的200mL容量瓶中,再用水定容,备用(任云杰)(2)标准曲线绘制——测定铁标液的吸光度②向每个容量瓶中加入10mL的(1+1)的盐酸溶液,加水至20mL处,用氨水溶液调至pH 为2~3,再加入1mL盐酸羟胺溶液,5mLHAc--NaAc缓冲溶液与2mL1,10—菲啰啉溶液,再用水稀释至刻度,摇匀,静置15min。


盐酸浓度有关实验报告引言盐酸是一种广泛应用于化学实验和工业生产中的强酸,常用于酸碱中和反应和金属腐蚀实验等。
在实际应用中,盐酸的浓度对其性质和反应速率有着重要影响。
因此,本实验旨在通过实验验证盐酸浓度与其酸性的关系,以及探究浓盐酸对金属反应反应速率的影响。
实验目的1. 了解盐酸浓度对其酸性的影响;2. 探究盐酸浓度对金属反应速率的影响。
实验材料和仪器- 盐酸溶液(不同浓度)- 快速反应金属(如锌片)- 装有盐酸溶液的试管- 酸性指示剂(如酚酞溶液)- 实验平台- 配套实验器材实验步骤和数据记录1. 将10mL盐酸溶液(浓度为0.1mol/L)倒入装有盐酸溶液的试管中;2. 按一定时间间隔记录试管中酸性指示剂的颜色变化,并记录下时间和颜色;3. 将锌片放入试管中,观察和记录金属腐蚀反应的起始时间和过程;4. 按照相同步骤,重复上述实验,但盐酸溶液浓度分别为0.05mol/L和0.01mol/L。
实验结果和分析根据实验记录,我们得到了盐酸浓度与其酸性的关系和盐酸浓度对金属反应速率的影响。
盐酸酸性与浓度的关系随着盐酸浓度的增加,酸性指示剂颜色变化的时间越短,颜色变化也更为明显。
具体数据如下表所示:盐酸浓度(mol/L)颜色变化时间(分钟)0.1 40.05 70.01 10由上表可见,随着盐酸浓度的增加,酸性指示剂颜色变化所需的时间减少。
这表明盐酸的浓度与其酸性呈正相关关系,浓度越高,酸性越强。
盐酸浓度对金属反应速率的影响随着盐酸浓度的增加,金属腐蚀反应的速率也随之增加,反应发生的时间更短。
以锌片反应为例,不同盐酸浓度下的反应时间如下表所示:盐酸浓度(mol/L)反应时间(分钟)-0.1 20.05 50.01 8可以观察到,随着盐酸浓度的增加,锌片与盐酸的反应速率逐渐增加。
这是因为盐酸浓度越高,其中的氢离子浓度也越高,与金属反应的速率也随之增加。
结论通过实验我们得出以下结论:1. 盐酸浓度与其酸性呈正相关关系,浓度越高,酸性越强;2. 盐酸浓度对金属反应速率有明显影响,浓盐酸反应速率更快。
工业盐酸中铁含量的测定1、实验目的(1)了解并掌握1,10-菲啰啉分光光度法测盐酸中铁含量的方法及操作(2)进一步掌握分光光度计的使用方法(3)熟练比色皿的清洗,装样等操作(4)加强对一般溶液的配制操作练习2、实验原理(1)分光光度计的工作原理是基于物质对光的吸收具有选择性,不同的物质都有各自的吸收光谱,即有不同的吸光度。
(2)盐酸羟胺能将三价铁还原为二价铁。
(3)在pH为4.5的缓冲溶液体系下,二价铁能与1,10-菲啰啉发生反应,生成橙红色的配合物。
3、实验仪器分析天平、紫外-可见分光光度计、洗瓶、胶头滴管、烧杯、比色皿、玻璃棒、移液管、洗耳球、pH试纸、滤纸、容量瓶、量筒。
4、实验药品工业盐酸、浓氨水、浓盐酸、氢氧化钠、盐酸羟胺、乙酸——乙酸钠缓冲溶液、铁标夜(硫酸亚铁按)、1,10-菲啰啉试剂。
6、实验步骤(1)所需溶液的配置①配制50mL的0.01g/L的铁标准溶液:量取5.0mL的0.1g/L的铁标液于烧杯中,用去离子水将其稀释,用50mL的容量瓶定容,备用(邱文静)②配制250mL的(1+10)盐酸溶液:用量筒量取浓度为12mol/L的浓盐酸22.7mL于烧杯中,再用量筒量取227.3mL的去离子水将其稀释,用250mL的容量瓶将其定容,搅拌均匀,贴上标签,以待备用(严翠平)③配制100mL的(1+1)氨水溶液(第二次用的是氢氧化钠):用量筒量取浓氨水50mL 于烧杯中再用量筒量取50mL去离子水将其稀释,搅拌均匀,贴上标签,备用(任云杰)④配制100mL的盐酸羟胺溶液:准确称取10.0g的盐酸羟胺试剂于烧杯中,再用适宜量的去离子水将其溶解,搅拌均匀,用100mL的容量瓶将其定容,贴上标签,备用(蒋滟耀)⑤配制100mL的1,10-菲啰啉溶液:准确称取0.2g的1,10-菲啰啉试剂于烧杯中,再用适宜量的去离子水将其溶解,搅拌均匀,用100mL的容量瓶将其定容,贴上标签,以待备用(邱文静)⑥配制100mLHAc--NaAc缓冲溶液(pH=4.5):准确称取11.8908g的乙酸钠,再用量筒量取40mL的冰醋酸于烧杯中,用去离子水稀释,用100mL容量瓶定容贴上标签,以待备用(严翠平)⑦配制200mL的试样溶液:称取早已洗净烘干的空具塞锥形瓶的质量为m mL,在量取70mL的工业盐酸于瓶中,再次称量,在置于内装100mL去离子水的200mL容量瓶中,再用水定容,备用(任云杰)(2)标准曲线绘制——测定铁标液的吸光度②向每个容量瓶中加入10mL的(1+1)的盐酸溶液,加水至20mL处,用氨水溶液调至pH为2~3,再加入1mL盐酸羟胺溶液,5mLHAc--NaAc缓冲溶液和2mL1,10—菲啰啉溶液,再用水稀释至刻度,摇匀,静置15min。
混合酸各组分含量的测定实验报告一、实验目的本实验旨在通过测定混合酸中不同的组分含量,掌握酸性物质浓度的测定方法,并加深对化学计量学原理的理解。
二、实验原理混合酸的组成通常包括硫酸、盐酸和硝酸等,其浓度的测定可以通过滴定法来实现。
滴定法的基本原理是利用一种标准溶液与待测液体反应,从而推算出待测液体中目标化合物的含量。
三、实验步骤1. 预实验将分别称取25mL的硫酸、盐酸和硝酸,放置于烧杯内,加入少量酚酞指示剂,进行酸碱中和反应,测定所需的NaOH标准溶液的用量。
2. 正式实验(1)称取5mL混合酸置于烧杯内,加入50mL蒸馏水稀释,加入酚酞指示剂。
(2)利用标准NaOH溶液滴定,记录消耗NaOH溶液的体积。
(3)重复以上步骤三次,记录数据。
四、实验结果在预实验中,硫酸、盐酸和硝酸对应的NaOH标准溶液的用量分别为16.2mL、13.6mL、25.0mL。
正式实验中,第一次滴定消耗NaOH标准溶液的体积为11.8mL,第二次为11.9mL,第三次为11.7mL。
五、数据处理1. 计算出NaOH标准溶液的平均用量:NaOH标准溶液用量的平均值=(16.2mL+13.6mL+25.0mL)/3=18.3mL 2. 计算出混合酸中不同组分的摩尔浓度:在一次滴定中,NaOH标准溶液与混合酸中存在的H+离子反应,由于不同酸的H+离子浓度不同,因此实验中测定出的NaOH标准溶液用量仅能反应出混合酸中全部酸性物质的总量,而不能分别推算出每种酸的含量。
由于硫酸、盐酸和硝酸分别含有2、1和1个H+离子,因此混合酸中不同组分的摩尔浓度可通过以下公式计算:(1)硫酸摩尔浓度=总酸浓度×2/3(2)盐酸摩尔浓度=总酸浓度×1/3(3)硝酸摩尔浓度=总酸浓度×1/3总酸浓度=NaOH标准溶液摩尔浓度×NaOH标准溶液体积/混合酸用量。
因此,可得出混合酸中不同组分的摩尔浓度如下:硫酸摩尔浓度=18.3mM×18.3mL/11.8mL×5mL×2/3=2.46M盐酸摩尔浓度=18.3mM×18.3mL/11.9mL×5mL×1/3=1.43M硝酸摩尔浓度=18.3mM×18.3mL/11.7mL×5mL×1/3=1.52M六、实验结论通过本实验,我们成功地测定了混合酸中硫酸、盐酸和硝酸的摩尔浓度,为进一步分析混合酸的组成和性质提供了有力的依据。
盐酸百分含量计算公式盐酸是一种常见的无机酸,在化学实验和工业生产中都有着广泛的应用。
要计算盐酸的百分含量,这可少不了一个关键的公式。
咱先来说说这个公式哈,盐酸百分含量的计算公式是:盐酸的百分含量 = (盐酸的质量÷溶液的总质量)× 100% 。
听起来好像挺简单,是吧?但实际运用的时候,那可得小心谨慎,每一个数据都得测量准确,不然得出的结果可就差之千里啦。
我给您讲讲我曾经遇到的一件事儿。
有一次在化学实验室里,学生们正在做一个测定盐酸百分含量的实验。
其中有个小组特别认真,他们小心翼翼地量取盐酸溶液,用精密的天平称出质量,眼睛都不敢眨一下,生怕出错。
可是呢,到了计算的时候,他们却慌了神,把数据都弄混了。
这可把他们急坏了,一个个抓耳挠腮的。
我走过去,看着他们着急的样子,笑着说:“别慌别慌,咱们重新理一理数据。
”然后我带着他们一步一步地重新测量、记录,再按照公式去计算。
最后得出正确结果的时候,他们那高兴劲儿,就像解开了一道超级难题一样。
在实际操作中,要得到准确的盐酸质量和溶液总质量可不简单。
比如说,量取盐酸溶液的时候,得用合适的量具,像移液管、滴定管这些,而且读数一定要准确。
称质量的时候,天平得先校准,保证精度。
再比如说,如果是通过化学反应来测定盐酸的含量,那反应得完全进行,不然得到的数据就不准确啦。
就像有一次,一个同学做实验的时候,反应时间不够,结果算出来的盐酸百分含量比实际的低了好多。
还有哦,如果溶液里有杂质,那也会影响计算结果。
所以在实验前,得把溶液处理干净,去除杂质。
总之啊,计算盐酸百分含量看起来简单,实际上需要我们认真仔细,每一个步骤都不能马虎。
只有这样,才能得到准确可靠的结果,让我们在化学的世界里畅游无阻。
希望通过我的这些讲解,您对盐酸百分含量的计算公式能有更清晰的理解和认识,在以后的学习和实验中能够运用自如,不出差错!。
hcl-nh4cl混合液中各组分含量的测定实验报告HCl-NH4Cl混合液是由盐酸(HCl)和氯化铵(NH4Cl)两种化合物混合而成。
在这种混合液中,HCl和NH4Cl的浓度可以通过测定溶液的酸度和离子浓度来确定。
实验报告的相关参考内容如下:引言部分:1. 介绍HCl-NH4Cl混合液的化学性质和应用领域。
2. 阐述测定HCl-NH4Cl混合液中组分含量的重要性和目的。
实验部分:1. 描述实验所用的实验仪器和试剂,例如:PH计、浓盐酸(HCl)、浓氯化铵(NH4Cl)等。
2. 详细说明实验步骤,包括:a. 首先,准备HCl-NH4Cl混合溶液,可以按照不同比例的HCl和NH4Cl来配制不同浓度的混合液。
b. 使用PH计测量溶液的酸度,记录HCl-NH4Cl混合液的PH值。
c. 采用酸碱滴定法,用NaOH标准溶液对HCl-NH4Cl混合溶液进行滴定,并记录滴定消耗的NaOH溶液体积。
d. 根据酸碱反应的化学方程式,计算HCl和NH4Cl的质量或摩尔浓度。
结果与讨论部分:1. 清楚地列出实验中得到的数据,并做好实验误差的评估。
2. 根据实验得到的数据,计算出HCl和NH4Cl的浓度,可以通过PH值和滴定体积得到。
3. 解释实验结果与预期相符或不符的原因,可能涉及到HCl-NH4Cl的反应平衡性质等方面的知识。
4. 分析实验的可靠性和局限性,例如实验条件的限制、实验误差的原因等。
结论部分:总结实验的目的、方法和结果,并得出结论,例如:通过PH 值测定和酸碱滴定法,我们成功测定了HCl和NH4Cl在混合溶液中的浓度,并验证了实验的可行性。
参考文献部分:列出参考所用的相关文献资料,包括书籍、期刊论文、实验方法手册等。
以上是关于HCl-NH4Cl混合液中各组分含量测定的实验报告的参考内容,可根据实际情况进行适当扩充和修改。
注意,文中不得出现链接,报告内容应以简洁、准确的文字表达实验过程、数据和结论。
实验五电位滴定法测定盐酸的浓度一、实验目的1、掌握电位酸碱滴定法测量盐酸的原理2、掌握电位滴定法测量离子浓度的操作方法3、掌握对测量数据进行微分处理的近似数值处理方法。
二、实验原理电位滴定法是在滴定过程中通过测量电位变化以确定滴定终点的方法,准确度优于直接电位滴定法电位法。
电位滴定法是靠电极电位的突跃来指示滴定终点。
可解决普通滴定法待测溶液有颜色或浑浊时,终点的指示就比较困难,或者根本找不到合适的指示剂时的终点确定问题。
被测成分的含量仍然通过消耗滴定剂的量来计算。
使用不同的指示电极,电位滴定法可以进行酸碱滴定,氧化还原滴定,配合滴定和沉淀滴定。
酸碱滴定时使用pH玻璃电极为指示电极。
在滴定过程中,随着滴定剂的不断加入,反应液pH不断发生变化,pH发生突跃时,说明滴定到达终点。
进行电位滴定时,被测溶液中插入一个参比电极,一个指示电极组成工作电池。
随着滴定剂的加入,由于发生化学反应,被测离子浓度不断变化,指示电极的电位(本实验为pH)也相应地变化。
在等当点附近发生电位(本实验为pH)的突跃。
因此测量工作电池电动势(本实验为pH)的变化,可确定滴定终点。
从图2和图3很容易看出,用微分曲线比普通滴定曲线更容易准确地确定滴定终点。
这要求在临近滴定终点时数据比较密集,即临近ep时应每加入一小体积滴定剂就记录一次pH。
判断何时临近滴定终点的方法:(1):通过理论估算。
①:体积理论估算法。
即根据试液待测物估计含量、标准溶液浓度和滴定反应方程式来估算滴定剂理论估算消耗量,当滴定剂滴加量临近滴定剂时视为临近滴定终点。
②:指示电极的电位(本实验为pH)理论估算法。
即根据试液待测物估计含量、标准溶液浓度和滴定反应方程式来估算化学计量点时的指示电极的电位(本实验为pH≈4)理论估算值,当滴定至该值附近即视为临近滴定终点(2):粗略实验法。
每次加入一个较大体积的滴定剂体积(如1.00mL)并记录相应指示电极的电位(本实验为pH)。