热学课件2-3-4 用迭代法求范德瓦耳斯气体的摩尔体积
- 格式:ppt
- 大小:564.00 KB
- 文档页数:3








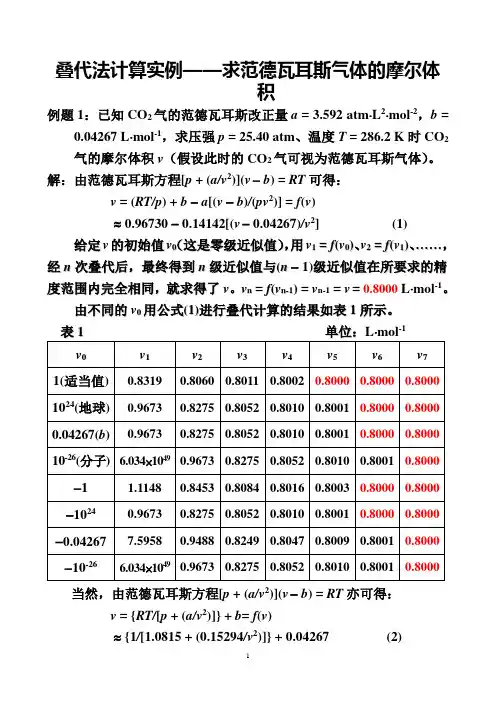
叠代法计算实例——求范德瓦耳斯气体的摩尔体积例题1:已知CO2气的范德瓦耳斯改正量a = 3.592 atm⋅L2⋅mol-2,b =0.04267 L⋅mol-1,求压强p = 25.40 atm、温度T = 286.2 K时CO2气的摩尔体积v(假设此时的CO2气可视为范德瓦耳斯气体)。
解:由范德瓦耳斯方程[p + (a/v2)](v-b) = RT可得:v = (RT/p) + b-a[(v -b)/(pv2)] = f(v)≈ 0.96730 - 0.14142[(v- 0.04267)/v2](1)给定v的初始值v0(这是零级近似值),用v1=f(v0)、v2=f(v1)、……,经n次叠代后,最终得到n级近似值与(n- 1)级近似值在所要求的精度范围内完全相同,就求得了v。
v n=f(v n-1)=v n-1=v=0.8000L⋅mol-1。
由不同的v0用公式(1)进行叠代计算的结果如表1所示。
表1单位:L⋅mol-1当然,由范德瓦耳斯方程[p + (a/v2)](v-b) = RT亦可得:v = {RT/[p + (a/v2)]} + b= f(v)≈ {1/[1.0815 + (0.15294/v2)]} + 0.04267(2)由于公式(2)中仅有v2项,故当v取正值时与取负值时的结果完全相同。
用以上两个公式计算v的过程中首先得到0.8000 L⋅mol-1的结果的v n-1如表2所示。
表2 单位:L⋅mol-1但用左面的(1)式未必总能比用右面的(2)式更快地得到结果。
例题2,求压强p = 1000 atm、温度T = 286.2 K时CO2气的摩尔体积。
解:若取v0= 1 L⋅mol-1,则由(1)、(2)两式所得结果如表3所示。
表3 单位:L⋅mol-1例题3:求压强p = 100.0 atm、温度T = 286.2 K时CO2气的摩尔体积。
解:若取v0=1 L⋅mol-1,则由(1)、(2)两式所得结果如表4所示。
