试论范德瓦耳斯气体(1)
- 格式:pdf
- 大小:513.60 KB
- 文档页数:2

范德瓦耳斯气体相变范德瓦耳斯气体相变是一种物理现象,涉及到气体在特定条件下的相变过程。
下面将从几个方面详细阐述这一现象:1、范德瓦耳斯方程的提出范德瓦耳斯方程是描述气体相变的重要理论工具。
该方程考虑了分子间的相互作用,引入了范德瓦耳斯状态方程来修正理想气体方程,以更准确地描述气体的行为。
范德瓦耳斯方程能够描述气体的压缩性和热容,从而为气体相变的研究提供了基础。
2、气体相变的特征当气体受到低温或高压的影响时,气体分子间的平均距离会发生变化。
由于分子间的相互作用,气体逐渐变得不均匀,并最终发生相变。
在相变过程中,气体的性质会发生显著变化,如密度、热容和分子运动速度等。
这些特征的变化使得气体相变成为一个值得研究的物理现象。
3、范德瓦耳斯气体相变的实验验证为了验证范德瓦耳斯气体相变的存在和理论预测的准确性,科学家们进行了大量的实验研究。
通过测量气体在不同温度和压力下的性质,并与范德瓦耳斯方程的理论预测进行比较,可以得出气体相变的实验证据。
这些实验不仅证实了范德瓦耳斯方程的正确性,也为气体相变的研究提供了宝贵的数据。
4、范德瓦耳斯气体相变的应用范德瓦耳斯气体相变在多个领域中都有实际应用。
例如,在石油工业中,人们利用气体相变来提高石油的采收率。
通过调整温度和压力条件,使油藏中的气体从液态转变为气态,从而增加油藏的流动性,提高石油的开采效率。
此外,在制冷技术、化学反应和材料科学等领域,范德瓦耳斯气体相变也有着广泛的应用。
5、未来研究展望尽管范德瓦耳斯气体相变已经得到了广泛的研究和应用,但仍有许多未知领域值得探索。
随着科学技术的不断进步,未来可以进一步深入研究气体相变的机制、影响因素以及潜在的应用前景。
此外,通过探索更精确的模型和理论工具,有望更深入地理解气体的行为和性质,为相关领域的发展提供更多支持。
综上所述,范德瓦耳斯气体相变是一种重要的物理现象,涉及到气体在特定条件下的相变过程。
这一现象不仅在理论上具有重要意义,而且在实践应用中也具有广泛的价值。



对范德瓦耳斯气体的热力学函数及热容量的研究范德瓦耳斯气体是一种理想气体的延伸,它在描述实际气体的热力学性质方面更准确。
本文将对范德瓦耳斯气体的热力学函数及热容量进行研究,并探讨范德瓦耳斯方程的应用。
1.范德瓦耳斯气体的热力学函数:范德瓦耳斯气体可以用以下方程描述:P(V-b)=nRT其中,P为气体的压强,V为气体的体积,n为气体的物质的量,R为气体常数,T为气体的温度,b为修正系数。
从这个方程中可以得到范德瓦耳斯气体的热力学函数。
首先,我们可以计算出范德瓦耳斯方程的状态方程:PV=nRT/(V-b)然后,根据理想气体的状态方程,可以知道热力学函数U与范德瓦耳斯方程的关系:dU = C_vdT = TdS - PdV其中,C_v为定容热容量,T为温度,S为熵,dU表示内能的微分。
将前面推导的范德瓦耳斯方程代入上述等式,可以得到范德瓦耳斯气体的热力学函数:dU = C_vdT = TdS - (nRT)/(V - b)dV2.范德瓦耳斯气体的热容量:根据上一节的推导,范德瓦耳斯气体的定容热容量C_v可以表示为:C_v=T(∂S/∂T)V现在来计算这个偏导数。
假设范德瓦耳斯气体满足简单的状态方程:P = nkT其中,k为玻尔兹曼常数。
由于S与V无关,我们可以得到:dS=(∂S/∂T)VdT将以上两式代入定容热容量的表达式中:C_v = T(dS/dT)V = T(1/T)kndT从而可以化简为:C_v = kn即范德瓦耳斯气体的定容热容量与物质的量成正比。
3.范德瓦耳斯方程的应用:范德瓦耳斯方程可以广泛应用于研究气体的行为和性质,特别是高压下的气体。
它可以用于计算气体的物质的量、压强、温度和体积之间的关系。
通过范德瓦耳斯方程,我们可以定量地描述气体的压力、体积和温度之间的关系。
例如,在常温常压下,我们可以计算气体的物质的量。
另外,范德瓦耳斯方程还可以用于计算气体的体积在不同压力和温度下的变化。
总结:本文对范德瓦耳斯气体的热力学函数及热容量进行了研究。

目 录摘 要 ................................................................................................... 1 Abstract ................................................................................................. 1 1 引 言 ................................................................................................. 1 2 范德瓦耳斯气体的热力学函数 (2)2.1范德瓦耳斯气体的熵(S ) (3)2.2 范德瓦耳斯气体的内能(U ) (4)2.3 范德瓦耳斯气体的焓(H ) (4)2.4 范德瓦耳斯气体的自由能(F ) ......................................................... 5 3范德瓦耳斯气体的摩尔容量 (5)3.1 范德瓦耳斯气体的P C 与V C 之差 (5)3.2 范德瓦耳斯气体的V C 与V 的关系 (7)3.3 范德瓦耳斯气体的P C 与P 的关系 ...................................................... 7 4结束语 ................................................................................................. 8 参考文献 (8)对范德瓦耳斯气体的热力学函数及热容量的研究摘 要:范德瓦耳斯方程是描述真实气体行为的基础。
本文从热力学函数的定义出发,结合范德瓦耳斯方程,推导出范德瓦耳斯气体的几个基本热力学函数,分析了其特性并研究了范德瓦耳斯气体的定容摩尔热容量和定压摩尔热容量的性质,指出了其同理想气体的区别。

范德瓦耳斯和他的状态方程顾韶晖宁波工程学院化学工程与工艺精化071班摘要:在物理学发展史上,范德瓦耳斯对气一液流体系统做了开创性的研究工作,建立了人类历史上第一个既能反映气、液各相性质,又能描述相变和临界现象的状态方程。
范德瓦耳斯的理论成就和研究方法对热力学、统计力学和低温物理学的发展产生了重要而深远的影响。
关键词:范德瓦耳斯,状态方程前言状态方程是描述热力学系统平衡态的独立参量与温度之间的函数关系式,是物理学的一个重要研究内容。
人类对状态方程的研究可以追溯到很早的年代。
早在1662年和1679年,英国化学家玻意耳(Boyle R)和法国物理学家马略特(Mariotte)就分别提出了描述理想气体性质的状态方程。
两个世纪后,范德瓦耳斯在克劳修斯热力学理论的启发下,通过考虑分子体积和分子间引力的影响,导出了描述实际气体性质的状态方程,即著名的范德瓦耳斯方程。
范德瓦耳斯方程在历史上具有莫大的重要性,它是人类历史上第一个既能描述气、液各相性质,又能显示出相变的状态方程。
由于它形式简单,物理意义清楚,成为热力学和统计物理学的重要应用对象。
范德瓦耳斯也是第一个定量研究分子间相互作用的物理学家,他所使用的研究方法实际上就是后来所说的平均场方法,这一方法对铁磁、超导、超流等众多物理系统相变和临界现象的研究,对热力学和统计物理论的发展产生了重大影响[1]。
1 范德瓦耳斯的生平及科学成就范德瓦耳斯(Johannes Diderik van der Waals),荷兰人,1837年1月23日生于荷兰莱顿一个普通工人家庭。
范德瓦耳斯早年家境不甚宽裕,在出生地完成了他的初等教育后,便做了一名小学教师。
按照荷兰当时的法律,要进一步接受他所喜爱的自然科学的教育,就必须首先通过希腊文和拉丁文的考试。
范德瓦耳斯在这方面的基础不够好,未能获得参加考试的资格。
尽管如此,范德瓦耳斯并未放弃自己的努力。
在1862-1865年期间,他利用业余时间在莱顿大学继续学业,并获得了数学和物理的教学资格。

范德瓦尔斯气体的绝热自由膨胀咱们今天聊聊一个挺有意思的物理现象——范德瓦尔斯气体的绝热自由膨胀。
你听说过这个吗?名字一听就觉得有点高深莫测,实话说,刚开始接触这个概念时,我也觉得它离我们日常生活有点远。
不过,你看,物理本来就得跟我们生活紧密结合才能不那么枯燥,是吧?所以今天我们就轻松点,来聊聊这个有点像“魔法”一样的过程。
放心,咱们不是要挑战什么高深的理论,只是想搞明白这背后的小故事。
什么叫做“绝热自由膨胀”呢?好家伙,一听这名字就感觉很复杂,实际上它说的就是气体在不跟外界交换热量的情况下,自己在一个容器里膨胀开来。
想象一下,你拿一个气球,吹得满满的,然后戳破它,气体就会迅速散开,膨胀,空气迅速充满周围的空间。
听起来是不是很简单?但实际上,这个“绝热”这一点就让它跟平常我们理解的膨胀有些不同了。
要明白这一点,咱们得先搞清楚一个核心概念——温度。
在我们的常规认知中,气体膨胀的时候温度应该下降,尤其是那种“自由膨胀”——气体无拘无束地迅速扩展,能量和温度都应该有所变化。
可问题是,如果气体的膨胀是绝热的(也就是说,没有热量进出),它怎么可能在膨胀的过程中改变温度呢?哎,这就是范德瓦尔斯气体的特别之处。
它不像理想气体那么简单,理想气体会按照很简单的公式来运行,而范德瓦尔斯气体的行为就更复杂了。
它不仅考虑了气体分子之间的相互作用力,还考虑了气体分子的体积。
所以,当它膨胀时,除了温度的变化,还会有一些额外的因素在起作用。
说到这里,可能你会有点儿疑惑:咱们不就是讨论气体膨胀吗,怎么一会儿聊温度变化,一会儿又聊分子间的相互作用?这不都没什么关系吗?其实不然!想象一下,如果是理想气体,咱们就简单地按照理想气体方程来算,它的膨胀就是一个完美的过程——没有能量损失,没有相互作用,一切都井井有条。
但是范德瓦尔斯气体不同,它的分子间有吸引力,尤其是在气体膨胀的过程中,分子之间的这种吸引力会让气体不那么“乖乖地”膨胀,反而会导致一些额外的“乱象”。
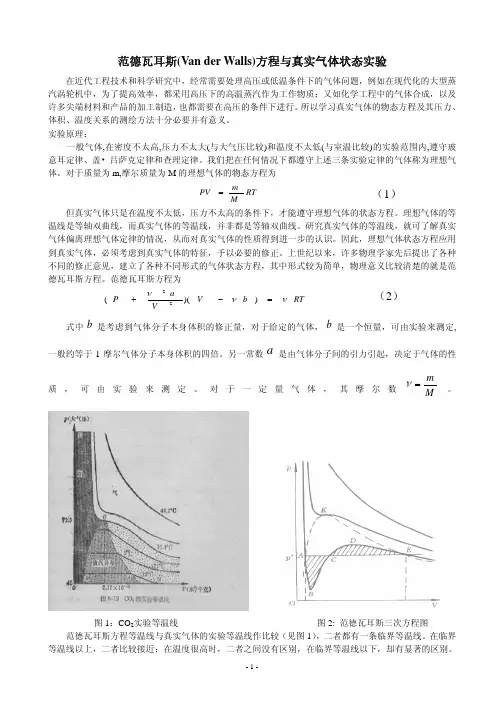
范德瓦耳斯(Van der Walls)方程与真实气体状态实验在近代工程技术和科学研究中,经常需要处理高压或低温条件下的气体问题,例如在现代化的大型蒸汽涡轮机中,为了提高效率,都采用高压下的高温蒸汽作为工作物质;又如化学工程中的气体合成,以及许多尖端材料和产品的加工制造,也都需要在高压的条件下进行。
所以学习真实气体的物态方程及其压力、体积、温度关系的测绘方法十分必要并有意义。
实验原理:一般气体,在密度不太高,压力不太大(与大气压比较)和温度不太低(与室温比较)的实验范围内,遵守玻意耳定律、盖•吕萨克定律和查理定律。
我们把在任何情况下都遵守上述三条实验定律的气体称为理想气体。
对于质量为m,摩尔质量为M 的理想气体的物态方程为RT M m PV = (1)但真实气体只是在温度不太低,压力不太高的条件下,才能遵守理想气体的状态方程。
理想气体的等温线是等轴双曲线,而真实气体的等温线,并非都是等轴双曲线。
研究真实气体的等温线,就可了解真实气体偏离理想气体定律的情况,从而对真实气体的性质得到进一步的认识。
因此,理想气体状态方程应用到真实气体,必须考虑到真实气体的特征,予以必要的修正。
上世纪以来,许多物理学家先后提出了各种不同的修正意见,建立了各种不同形式的气体状态方程,其中形式较为简单,物理意义比较清楚的就是范德瓦耳斯方程。
范德瓦耳斯方程为RT b V V a P ννν=−+))((22 (2)式中是考虑到气体分子本身体积的修正量,对于给定的气体,是一个恒量,可由实验来测定,一般约等于1摩尔气体分子本身体积的四倍。
另一常数是由气体分子间的引力引起,决定于气体的性质,可由实验来测定。
对于一定量气体,其摩尔数b b a M m =ν。
图1:CO 2实验等温线 图2: 范德瓦耳斯三次方程图范德瓦耳斯方程等温线与真实气体的实验等温线作比较(见图1),二者都有一条临界等温线。
在临界等温线以上,二者比较接近;在温度很高时,二者之间没有区别,在临界等温线以下,却有显著的区别。


范德瓦耳斯方程的气体动理论推导荷兰物理学家范德瓦耳斯(Johannes Diderik Van der Waals,1837—1923)改进了气体的状态方程,把分子间的作用力和分子的有限体积放进方程中去。
他论证了,分子间距离较远时,它们间必定存在吸引力,这一作用附加到容器壁施加的压强上去。
他进一步提供论据,假设附加产生的压强反比于气体比容的平方。
还有,由于分子占有体积,它们可利用的空间必须减少,或者说得更明白些,减少的总体积就正比于分子在相互接触时所占有的体积。
于是一摩尔真实气体的状态方程变成(p+an2/V2)(V-nb)=RT。
这简单方程包含两个常数,即a和b,对于每一种物质它们可由实验确定。
R是普适气体数学。
1873 年在博士论文《论气态和液态的连续性》中考虑了分子体积和分子间吸力的影响,推出了著名的物态方程:(p+a/V2)(V-b)=RT 后来人们称之为范德瓦耳斯方程。
他还导出了b 是分子体积的4 倍。
这个方程不仅能解释安德纽斯的实验结果及J.汤姆生的见解,而且能从常数a、b 值计算出临界参数,这对“永久气体”液化的理论起了指导作用。
下面以理想气体状态方程为基础,推导范氏方程。
若把气体视为由体积无限小、相互之间无作用力的分子组成,这种模型便是理想气体模型,与其相对应的状态方程是:p=kT/V.若抛弃前一个的假设,把组成气体的分子视为有一定大小的刚性球(其半径称为范德瓦尔斯半径),用b 表示这些“球”的体积,上面的方程便改写为:p=kT/(V-b).在这里,每个分子的“占有体积”v 被所谓“排斥体积”v - b 代替,反映了分子在空间中不能重叠。
若气体被压缩至体积接近分子体积之和(即分子间空隙v - b 趋向于0),那么其压强将趋于无穷大。
下一步,我们考虑原子对之间的引力。
引力的存在会使分子的平均亥姆霍兹自由能下降,减少量正比于流体的密度。
但压强的大小满足热力学关系。
综述:范德瓦耳斯方程的产生是这样的:先由范德瓦耳斯提出假设,再通过计算证明假设的成立,因此当初方程的产生并不是由于数学推导,而是一种经验性的假设,通过计算,符合事实,便成为一个结论。
范德瓦尔斯方程范德瓦尔斯方程1分子固有体积修正2分子吸引力修正3范德瓦尔斯方程1873年荷兰物理学家范德瓦尔斯(Waals,van der )在克劳修斯论文启发下,对理想气体的两条基本假定(即忽略分子固有体积、忽略除碰撞外分子间相互作用力)作出两条重要修正,得出了能描述真实气体行为的范德瓦耳斯方程。
pRT b V m =-(1) 分子固有体积修正理想气体不考虑分子的固有体积,说明理想气体方程中容器的体积V 就是每个分子可以自由活动的空间。
如果把分子看作有一定大小的刚性球,则每个分子能有效活动的空间不再是V 。
若1mol 气体占有V m 体积,分子能自由活动空间的体积为V m -b。
则有b V RT p m -=当压强p→∞ 时,气体体积V m →b(2) 分子吸引力修正设分子在相互分离时的吸引力为球对称分布,吸引力作用半径为R 0,每一分子均有以R 0为半径的吸引力作用球,内p p =理气体分子只发生俩俩成对碰撞,而三个分子或更多分子同时碰在一起的情况几乎不发生。
4b =⨯分子固有体积思考:4b =⨯分子固有体积?2d器壁实际受到压强要比气体内部的压强小,使气体施于器壁的压强减少了一个量值,这称为气体内压修正量。
i p ∆ 若仪器所测出的气体压强为p ,气体内部的压强为p 内,则内p p p i =∆+RT b V p m =-)(内b V RT p p m i -=∆+同时考虑到分子固有体积修正及分子间吸引力修后得到的真实气体状态方程?=∆i p若令△k 表示每一分子进入界面层时由于受到指向气内部的平均拉力作用所产生的平均动量减少量( )。
kp i ∆⨯=∆2}{积上平均分子数单位时间内碰在单位面126n k =⨯∆v x k m ∆=∆v 由于分子与器壁作完全弹性碰撞,使气体分子每与器壁碰撞一次所导致器壁的冲量减少了2△k 的数值。
因为△p i 为分子吸引力存在而导致的压强修正量,故△k 与分子数密度n 成正比,设比例系数为K , 则△k= Kna 是与温度及气体种类有关的常数.211()66A i m N p n Kn K V ∆=⨯=v v 2mi V a p =∆RT b V V a p m m=-+))((2b V RT p p m i -=∆+(3)范德瓦尔斯方程(Van der Waals equation of state )这是表示1mol 气体的范德瓦耳斯方程。
范德瓦尔斯气体分子中扰动运动特性研究范德瓦尔斯气体是一种在自然界中广泛存在的气体,由于其分子间存在范德瓦尔斯力,因此其分子运动特性与理想气体有所不同。
扰动运动作为气体分子的重要运动形式之一,在范德瓦尔斯气体中具有独特的性质。
本文将从分子动力学模拟的角度,探讨范德瓦尔斯气体分子中扰动运动的特性。
一、范德瓦尔斯气体分子运动特性简介范德瓦尔斯气体是一种非理想气体,其分子间存在范德瓦尔斯力,在气体状态下,范德瓦尔斯力与动能相同的情况下,会产生相对于理想气体更强的相互作用。
因此,范德瓦尔斯气体的动态特性与理想气体有所不同。
在范德瓦尔斯气体中,分子的运动形式一般分为平动、转动和振动。
其中平动是指分子在三维空间中的直线运动;转动是指分子在三维空间中绕着自己的轴进行旋转运动;振动则是指分子内部原子之间的相互作用,导致分子产生微小的振动。
除了以上常见的运动形式外,扰动运动也是气体分子运动的一个重要表现形式。
在扰动运动中,气体分子会受到周围分子的碰撞作用,产生微小的扰动,从而影响气体的动态特性和热力学性质。
二、范德瓦尔斯气体分子扰动运动的模拟方法范德瓦尔斯气体分子中扰动运动的模拟方法主要有两种:分子动力学模拟和玻尔兹曼方程模拟。
分子动力学模拟是一种基于经典力学的数值计算方法,可以模拟气体分子的运动轨迹和相互作用等动力学特性。
该方法基于分子间作用势函数,通过数值计算得到分子的位置、速度和受力情况。
相比而言,玻尔兹曼方程模拟则是一种更为复杂的数学模型。
该模型描述了气体分子在空间中的运动状态,以及其在碰撞过程中能量、动量等物理量的变化。
通过求解玻尔兹曼方程,可以得到气体的宏观状态量,如压力、温度等。
三、范德瓦尔斯气体分子扰动运动特性的研究进展在范德瓦尔斯气体分子的扰动运动特性研究方面,国内外学者们已经取得了不少成果。
以下是一些典型的研究成果:(一)范德瓦尔斯气体分子扰动运动的时间尺度在范德瓦尔斯气体中,气体分子的扰动运动的时间尺度与其它运动形式相比较短,通常为纳秒级别。