键的极性举例
- 格式:ppt
- 大小:358.00 KB
- 文档页数:2

1.共价键的极性共价键有两类,极性键和非极性键。
(1)极性键由不同原子形成的共价键,电子对会发生偏移,电负性较大的原子呈负电性,电负性较小的原子呈正电性,这样的共价键称为极性键。
如,HF中的共价键就是极性键。
(2)非极性键由同种原子形成的共价键,电子对不发生偏移,称为非极性键。
如,氢气分子中的共价键就是非极性键。
说明:判断键的极性主要看组成该分子的原子种类。
如果是由同种原子组成(A-A),那么就为非极性键;如果是由不同种原子组成(A-B),那么就为极性键。
2.分子的极性分子也有两种类型,极性分子和非极性分子。
(1)极性分子在极性分子中,正电中心和负电中心不重合,使分子中的某一个部分呈正电性,另一部分呈负电性。
如,HCl。
(2)非极性分子非极性分子中,正电中心和负电中心重合,整个分子不显电性。
如,氢气分子。
说明:只含非极性键的分子不一定是非极性分子,如臭氧分子;只含极性键的分子也有可能是非极性分子,如甲烷分子。
3.分子极性的判断(1)根据所含键的类型判断对于由两个原子组成的分子,如果是由同种原子组成(A-A型分子),那么它就是非极性分子;如果是由不同种原子组成(A-B型分子),那么它就属于极性分子。
例如:(2)根据分子的空间构型判断对于由三个原子组成的分子,除了直线形结构为非极性分子,其他结构都为极性分子。
如:对于由四个原子组成的分子,除了平面三角形结构的分子为非极性分子,其他构型的分子都属于极性分子。
如:对于由五个原子组成的分子,除正四面体形和平面正四边形结构的分子为非极性分子,其他都为极性分子。
(3)根据中心原子最外层电子是否全部成键判断分子中的中心原子最外层电子若全部成键,一般为非极性分子;如果没有全部成键,一般为极性分子。
例如:(4)根据化合价判断对于ABm型分子,中心原子的化合价的绝对值等于该元素的价电子数(最高正价)时,该分子为非极性分子。
大家可以算一算上面给出的非极性分子,是不是符合这个规律。

浅谈共价键的极性和分子的极性判断
共价键是指两个非金属原子共享一对电子,通过电子的共享形成的化学键。
共价键有极性和非极性之分。
极性共价键是指两个原子共享电子时,由于原子的电负性差异,共享电子对呈现不对称的电荷分布,即电子负离子围绕较电负原子形成的局部负电荷区域被称为极性键或偏极性键。
在化学物质中,共价键的极性可以通过数值上反映出来。
电负性差异越大,共价键的极性越强。
当两个原子的电负性相等时,共价键没有极性。
以氯化钠为例,它的化学式为NaCl,化学键为离子键,由钠离子和氯离子组成,不存在共价键的极性。
分子的极性判断则需要看整个分子的电子密度分布。
如果分子中原子发生互相勾股,那么分子为极性分子。
当分子中原子等效排列时,分子为非极性分子。
对于极性分子,其电子密度不均匀分布,通常由正负极不等的两部分构成。
比如水分子(H2O)就是一个极性分子,分子中氧原子电负性高于氢原子,分子中带有正电荷和负电荷的极性键,整个分子呈现出极性,以至于水分子可用于溶解极性物质。
相反,非极性分子的原子的电负性相等或相近,整个分子的电子密度均匀分布,不具有正负极性。
以甲烷(CH4)为例,其化学式为CH4,整个分子原子等效排列,没有多余的电荷,为非极性分子。
总的来说,共价键的极性和分子的极性是两个不同的概念。
共价键的极性是由原子电负性大小不均造成的,而分子的极性概念主要包含阳性分子和阴性分子。
要分析分子的极性,必须分析分子的电子密度分布,以判断分子的电荷是否均匀分布。

浅谈共价键的极性和分子的极性判断共价键是化学中常见的一种化学键,是由两个元素之间共享电子而形成的化学键。
在共价键中,电子对会以一对一对地共享,以使得每个原子能够达到稳定的最外层电子结构。
并非所有的共价键都是非极性的,有些共价键是极性的,这种极性主要取决于各个原子的电负性差异。
分子的整体极性也可以通过共价键的极性来判断。
本文将围绕共价键的极性和分子的极性进行探讨和分析。
共价键的极性是由原子间的电负性差异引起的。
在共价键中,当两个不同元素的原子结合时,它们的电负性差异将会导致电子对的偏向性。
电负性是原子对外基本吸引电子的能力的度量,通常来说,原子的电负性越大,对外吸引电子的能力就越强。
而且,通过化学元素周期表的分布规律可以知道,元素在周期表上越往右上方,电负性越大。
当两个不同元素的原子结合形成共价键时,电子对会偏向电负性较大的原子。
这种偏向性导致了共价键的极性。
举例来说,氢氟分子的共价键是极性的,因为氢原子的电负性较小,而氟原子的电负性较大,因此在共价键中电子对会偏向氟原子。
而且,这个偏向性也可以用向化学键箭头的形式来表示,箭头指向电负性较大的原子。
为了更好地判断共价键的极性和分子的极性,我们可以采用一种简单的方法,即通过化学元素的电负性差异来确定。
一般来说,当两个原子之间的电负性差异大于0.5时,这个共价键就可以被认为是极性的。
而当电负性差异小于0.5时,共价键就被认为是非极性的。
通过这种方法可以很容易地判断共价键的极性。
但需要注意的是,某些情况下,共价键虽然电负性差异较小,但由于分子结构的影响,会导致分子整体呈现极性。
判断分子的极性还需要考虑到分子整体结构的影响。
分子整体极性的判断主要受到分子几何结构的影响。
当分子的几何结构对称时,分子通常是非极性的,因为各个共价键的偏向性可以互相抵消。
二氧化碳分子的几何结构是线性的,氧原子对碳原子的偏向性会互相抵消,因此整个分子是非极性的。
而当分子的几何结构不对称时,分子通常是极性的,因为各个共价键的偏向性无法互相抵消。


高考化学常见物质化学键极性化学键是在化学反应中形成的一种电磁力,它可以将原子、离子或分子之间联系在一起。
在化学键中,极性是一个重要的概念。
极性描述了化学键中正负电荷分布的不平衡程度。
极性分为两种类型,即极性键和非极性键。
这两种类型的极性键的形成主要是由原子之间的电负性差异所引起的。
电负性是一个描述原子吸引电子能力的物理量。
在化学键中,电负性差异越大,化学键就越极性。
极性键通常是由两个不同的原子组成的。
例如,氢和氧之间的共价键就是一种极性键。
在H2O这个分子中,每个氧原子都与两个氢原子共享一个共价键。
由于氧原子比氢原子的电负性大,氧原子吸引的电子比氢原子更多,因此氧原子的一侧会带有负电荷,而氢原子的一侧会带有正电荷。
因此,H2O分子是一个极性分子,它具有一个正电荷的氢端和一个负电荷的氧端。
相反,非极性键通常是由相同的原子组成的。
例如,氧气分子(O2)中的氧-氧键就是一种非极性键。
由于氧气中的氧原子的电负性相等,它们对电子的吸引力也相等,因此氧气分子是一个非极性分子。
极性键和非极性键在化学反应中起着不同的作用。
由于极性键的不平衡电荷分布,它们能够产生较强的分子间相互作用力。
这些相互作用力可以使分子聚集在一起形成更为稳定的结构。
例如,在水中,由于H2O分子的极性,分子之间形成了氢键,这使得水分子在液态时具有相对较高的沸点和熔点。
另一方面,非极性键的电荷分布均匀,因此它们在化学反应中通常不会产生强烈的分子间相互作用力。
在化学反应中,了解物质的化学键极性对理解反应机制和性质具有重要意义。
例如,在有机化学中,如醇和酚的反应性质与它们分子中的氧-氢键的极性程度有关。
醇中的氧-氢键较强极性,使得醇具有强烈的亲水性。
而酚中的氧-氢键非常弱极性,使得酚相对于醇具有较差的亲水性。
此外,极性键的存在也对化学反应的速率具有影响。
极性键会降低分子之间的反应活性,从而使得反应速率减慢。
这是因为极性键使分子更加稳定,需要更多的能量来打破这些键。

浅谈共价键的极性和分子的极性判断共价键是化学中一种常见的化学键类型,常见于非金属元素之间的化合物中。
在共价键中,两个原子共享一对电子以形成化学键。
由于原子中的电子在不同程度上被吸引到原子核,因此共价键并非总是非极性的。
有些共价键是非极性的,有些是极性的。
而分子的极性则与其中的原子之间的共价键的极性密切相关。
在本篇文章中,我们将就共价键的极性和分子的极性进行一番浅谈。
让我们回顾一下共价键的极性。
共价键的极性取决于相互作用的原子的电负性差异。
电负性是原子倾向于吸引共享电子对的能力,根据元素周期表的位置来确定。
通常来说,原子的电负性与位置的靠近程度成正比。
在化学键中,如果两个原子的电负性差异较小,那么它们共享的电子对就会均匀地分布在两个原子之间,形成非极性共价键。
如果两个原子的电负性差异较大,那么共享的电子对就会更多地偏向电负性较高的原子,形成极性共价键。
以氢氟化氢(HF)为例,氢原子的电负性为2.20,氟原子的电负性为3.98,二者的电负性差异较大。
在HF分子中,由氢和氟原子形成的共价键是极性的。
氢原子的电子密度会更多地偏向氟原子,形成部分正电荷和部分负电荷,从而使得整个分子具有极性。
极性共价键的极性程度还可以通过测量分子中键的偶极矩大小来了解。
偶极矩是用来描述分子极性程度的物理量,它是由分子中所有极性共价键的偶极矩矢量之和得到的。
偶极矩的方向指向带有部分负电荷的原子。
通过测量偶极矩的大小和方向,可以判断分子的极性程度。
接下来,让我们谈一谈如何通过共价键的极性来判断分子的极性。
在一个分子中,如果存在一个或多个极性共价键,那么就需要考虑这些极性共价键对整个分子的影响。
在大部分情况下,分子的极性可以从其构成的共价键的极性推断出来。
如果一个分子中所有的共价键都是非极性的,那么这个分子就是非极性的。
二氧化碳(CO2)分子中,碳和氧之间形成的是非极性共价键。
整个二氧化碳分子是非极性的。
另外一个例子是甲烷(CH4)分子,其中碳与氢之间形成的也是非极性共价键,因此整个甲烷分子也是非极性的。
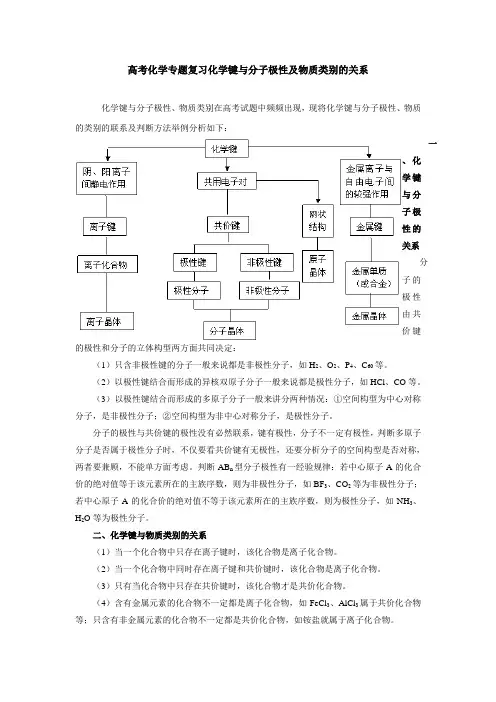
高考化学专题复习化学键与分子极性及物质类别的关系化学键与分子极性、物质类别在高考试题中频频出现,现将化学键与分子极性、物质的类别的联系及判断方法举例分析如下:一、化学键与分子极性的关系分子的极性由共价键的极性和分子的立体构型两方面共同决定:(1)只含非极性键的分子一般来说都是非极性分子,如H2、O2、P4、C60等。
(2)以极性键结合而形成的异核双原子分子一般来说都是极性分子,如HCl、CO等。
(3)以极性键结合而形成的多原子分子一般来讲分两种情况:①空间构型为中心对称分子,是非极性分子;②空间构型为非中心对称分子,是极性分子。
分子的极性与共价键的极性没有必然联系,键有极性,分子不一定有极性,判断多原子分子是否属于极性分子时,不仅要看共价键有无极性,还要分析分子的空间构型是否对称,两者要兼顾,不能单方面考虑。
判断AB n型分子极性有一经验规律:若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子,如BF3、CO2等为非极性分子;若中心原子A的化合价的绝对值不等于该元素所在的主族序数,则为极性分子,如NH3、H2O等为极性分子。
二、化学键与物质类别的关系(1)当一个化合物中只存在离子键时,该化合物是离子化合物。
(2)当一个化合物中同时存在离子键和共价键时,该化合物是离子化合物。
(3)只有当化合物中只存在共价键时,该化合物才是共价化合物。
(4)含有金属元素的化合物不一定都是离子化合物,如FeCl3、AlCl3属于共价化合物等;只含有非金属元素的化合物不一定都是共价化合物,如铵盐就属于离子化合物。
(5)非金属单质只含共价键(稀有气体除外)。
(6)含共价键的化合物不一定都是由非金属元素组成,如AlCl3属于共价化合物。
(7)氢化物不一定都是共价化合物,如NaH。
(8)NaHSO4熔融时电离生成Na+和HSO4-,而溶于水时电离成Na+、H+和SO42-,因此熔融时只破坏离子键,而溶于水时即破坏离子键又可以破坏共价键。

化学键的极性极性键非极性键化学键的极性和非极性键化学键是由原子之间的相互作用形成的连接,它决定了分子的性质和化学反应的进行。
根据成键电子对的共享情况,化学键可分为极性键和非极性键。
极性键是指由两个具有不同电负性的原子之间形成的键。
电负性是原子对电子吸引能力的一种度量,常用来描述原子对电子云的吸引能力强弱。
在极性键中,电子云的共享并不均匀,而是偏向于电负性较大的原子。
极性键的代表例子是水分子中的氧氢键。
在氧原子和氢原子之间的成键过程中,氧气分子的氧原子比氢原子的电负性高,因此会对电子云施加更强的吸引力。
这导致氧原子周围的电子云偏向氧原子,使氧原子部分带负电,氢原子部分带正电。
这种分布造成了水分子的极性,使得水分子具有较高的溶解性和较大的极性溶剂特性。
另一个例子是氯化钠晶体中的钠氯键。
在氯离子和钠离子之间的成键过程中,氯原子的电负性高于钠原子。
这导致氯离子带负电,钠离子带正电。
虽然钠氯键中的电子云也有偏移,但由于离子之间的吸引力较大,所以这种偏移相对较小。
因此,钠氯键仍被认为是极性键。
相反,非极性键是指由具有相似电负性的原子之间形成的键。
在非极性键中,成键电子对的共享较均匀,没有明显的电荷分布。
典型的非极性键是由两个相同原子之间形成的键,如氧氧键或碳碳键。
由于相同原子具有相似的电负性,电子云共享均匀,没有电荷分离。
这使得非极性化合物具有较小的溶解度和较低的极性溶剂特性。
需要注意的是,极性和非极性键并非是绝对的,而是存在于一个连续的谱系中。
有些化学键可能在极性和非极性之间具有中间的特性,称为部分极性键。
总结起来,化学键的极性和非极性直接影响分子的性质和反应。
极性键具有明显的电荷分布,使得分子具有极性和溶解性。
非极性键具有较均匀的电子云共享,使得分子具有非极性和较小的溶解度。
理解化学键的极性与非极性有助于我们理解和解释化学反应和分子性质。


键的极性与分子的极性1. 共价键的极性(1)共价键的种类及存在同种元素的原子形成共价键时,它们吸引电子对的能力相同,共用电子对处在正中间,不偏向任何一个原子,由于电荷在两个原子核附近均匀分布,因此成键的分子不显电性。
这样的共价键叫非极性键。
非极性键可以存在于单质之中,如中的H—H键、P4中的P—P键;也可以存在于共价化合物之中,如中的O—O键;还可以存在于离子化合物之中,如中的O—O键。
不同种元素的原子形成共价键时,由于它们吸引电子对的能力不同,共用电子对必然偏向吸引电子能力强的原子一方,因而吸引电子能力强的原子一方相对地显负电性,吸引电子能力弱的原子一方相对地显正电性。
这样的共价键叫极性共价键,简称极性键。
极性键既可以存在于共价化合物之中,如HCl、,也可以存在于离子化合物之中,如NaOH中的O—H键、中的S—O键。
(2)共价键极性的判断凡由同种非金属元素的原子之间形成的共价键一定是非极性键;凡由不同种非金属元素的原子之间形成的共价键一定是极性键。
2. 分子的极性(1)非极性分子和极性分子的定义电荷分布对称,正负电荷重心重合的分子称为非极性分子,如CO2、H2。
电荷分布不对称,正负电荷重心不重合的分子称为极性分子,如NO、NH3。
(2)非极性分子和极性分子的判断①同种元素的原子形成的双原子分子一定是非极性分子,如H2、O2。
②不同种元素的原子形成的双原子分子一定是极性分子,如HCl、NO、CO。
③不同种元素的原子形成的多原子分子的极性主要取决于分子的空间构型,若为对称结构,则是非极性分子;若为不对称结构,则为极性分子。
如直线型的CO2、CS2、C2H2,平面正三角形的BF3,正四面体的CH4、CCl4,都是非极性分子,因为它们的分子结构是对称的。
而折线型的H2O、H2S,三角锥型的NH3,都是极性分子,它们的分子结构都不对称。
3. 键的极性与分子极性的关系(1)只含有非极性键的分子一定是非极性分子,如P4。

键的极性与电负性的关系
在共价化合物中,由于不同元素的原子吸引电子的能力不同,共用电子对就必然或多或少地偏向于对它吸引力较大的那个原子,所以形成的键就具有不同程度的极性。
两种元素的电负性相差越大,它们之间键的极性就越强,其中,电负性较大的原子为负极,电负性较小的原子为正极。
例如,卤素中氟的电负性为4.0,氯为3.0,溴为2.8,碘为2.5,而氢的电负性为2.1。
显然,卤化氢分子中键的极性强弱的顺序为HF﹥HCl﹥HBr﹥HI,其中前两种为强极性键,H—I为弱极性键,而H—Br则介于两者之间。
卤素原子是负极,氢原子是正极。
那么电负性差值达到什么程度,极性键就转变为离子键呢?实际上,在离子键和共价键之间没有一条绝对分明和固定不变的界限。
一般地,当两个原子电负性差值约为1.7时,单键的离子性和共价性各约为50%,所以当两个原子电负性差值大于1.7时,可认为它们形成的是离子键,该物质是离子型化合物;而当两个原子电负性差值小于1.7时,则形成的是共价键,该物质是共价化合物。
了解有机化学中的键的极性和解离度導論:有機化學中的化學鍵種類繁多,其中的極性和解離度是理解有機化合物特性的重要方面。
本文將介紹有機化學中的鍵的極性和解離度,並探討其對化學反應和分子結構的影響。
一、鍵的極性鍵極性是指化學鍵中電子的共享程度。
根據電負性差異,化學鍵可以分為非極性鍵、極性鍵和離子鍵。
1. 非極性鍵:非極性鍵是指在化學鍵中兩個原子之間的電負性沒有明顯的差異,共享電子對均勻分布。
非極性鍵通常出現在兩個相同原子之間,如氧氣分子中的氧氧鍵。
2. 極性鍵:極性鍵是指在化學鍵中兩個原子之間的電負性有明顯的差異,共享電子對偏向電負性較大的原子。
在分子中,極性鍵會產生極性分子,其中正負電荷分布不均勻。
例如,水分子中的氧氮鍵就是一個極性鍵。
3. 離子鍵:離子鍵是由電負性差異非常大的金屬和非金屬元素形成的一種鍵。
在離子鍵中,電子完全地從金屬原子轉移到非金屬原子,形成陰離子和陽離子。
常見的例子是鹽中的鈉氯鍵。
二、解離度解離度是指某一個物質水溶液中溶解的程度。
根據解離度,化合物可以分為不解離物質、部分解離物質和完全解離物質。
1. 不解離物質:不解離物質是指在水溶液中不發生離子的形成,分子完全存在。
例如,蔗糖在水中的溶液中不會解離。
2. 部分解離物質:部分解離物質是指在水溶液中只有部分分子發生解離,形成少量離子。
例如,醋酸在水中以醋酸根離子和氫離子的形式部分解離。
3. 完全解離物質:完全解離物質是指在水溶液中幾乎所有的分子都會解離成離子。
例如,氯化鈉在水中完全解離成鈉離子和氯離子。
解離度與鍵的極性密切相關。
極性較大的鍵更容易解離,因為其形成的離子更穩定。
此外,溫度、濃度和物質的性質也會影響解離度。
結論:有機化學中的鍵的極性和解離度是理解有機化合物特性的重要方面。
鍵的極性分為非極性鍵、極性鍵和離子鍵,其中極性鍵和離子鍵易於解離。
解離度則根據物質在水溶液中的解離程度分為不解離物質、部分解離物質和完全解離物質。
這些概念對於解釋有機化合物的性質和進行相關研究至關重要。
化学键的极性与键能化学键的极性与键能是化学领域中的重要概念。
本文将探讨化学键的极性和它们与键能之间的关系。
1. 极性与化学键的定义化学键是由原子间的电子共享或转移形成的力,可以将原子们紧密地结合在一起。
在化学键中,原子通过共享或转移电子以达到更稳定的电子构型。
化学键的极性是指共享电子对在空间上分布不均匀,导致形成局部电荷差异的现象。
有两种类型的化学键极性:- 偏极性键:其中一个原子对电子的亲和力较强,使得它在共享电子对中拥有更大的电子密度。
常见的例子是C-O键和C-N键。
- 离子键:电子从一个原子转移到另一个原子,形成一个阴离子和一个阳离子之间的相互吸引力。
典型的例子是NaCl中的钠阳离子和氯阴离子之间的键。
2. 极性对化学键能的影响化学键能是指在形成和解离化学键时所涉及的能量变化。
极性对化学键能有着重要的影响。
对于偏极性键,较强的原子吸电子能力导致共享电子对整体上更接近该原子。
这导致原子间的吸引力增强,从而增加了化学键的稳定性和键能。
这种极性越强的键能越高。
离子键是由电子转移而形成的,其中有一个离子具有正电荷,另一个具有负电荷。
这种极性特别强的键能非常高,因为它涉及到电子在离子间的较大移动。
3. 应用与示例极性和键能的概念在许多化学领域中起着重要作用。
在有机化学中,了解键的极性有助于预测化合物的反应性和化学性质。
例如,在考虑亲核取代反应时,一个偏极性键的高键能使其更容易被取代。
在生物化学中,极性和键能对于理解酶催化过程至关重要。
极性键能够提供所需的稳定性和亲合性,从而促使酶催化所需的化学反应发生。
总之,极性与键能是化学键中不可忽视的重要因素。
极性决定了键的电荷分布,而键能则涉及到键在形成和解离时所涉及的能量变化。
通过研究这两个概念,我们可以更好地理解分子间相互作用和化学反应的本质。
化学键的极性与离子键的形成化学键是构成分子和化合物的基本单位之一,它的性质和类型对于物质的性质和反应具有重要的影响。
其中,极性和离子键是化学键中的两个重要概念。
极性是指化学键中电子的分布是否对称。
当两个原子之间的电子云分布不对称时,就会形成极性键。
极性键可分为两种类型:极性共价键和极性离子键。
极性共价键是指电子云被偏移到一个原子附近,使其具有部分正电荷或负电荷,而另一个原子则具有相反的电荷。
这种不对称的电子云分布造成了化合物中的局部电荷差异,影响着分子的空间结构和性质。
例如,氯化氢(HCl)中的氢原子部分正电荷,氯原子则部分负电荷,由于氢氯键的极性,使得HCl具有较高的溶解度和电导性。
极性离子键是指电子云完全转移到一个原子上,形成电荷相反的离子。
典型的例子是氯化钠(NaCl),其中钠原子失去一个电子,形成正离子(Na+),而氯原子获得一个电子,形成负离子(Cl-)。
这两种电荷相互吸引,形成离子晶格结构。
离子键的形成也导致离子化合物的高熔点和导电性,因为在固态中,离子已经失去了自由运动的能力。
极性键的形成与原子的电负性有关。
电负性是指原子吸引和保持电子的能力。
在共价键中,如果两个原子的电负性相等,它们会共享电子对并形成非极性共价键。
然而,当原子的电负性存在差异时,电子云会被偏向电负性较强的原子,从而形成极性共价键。
离子键的形成则不同于共价键。
在离子化合物中,原子通过失去或获得电子,达到稳定的电子构型。
对于金属元素,它们往往失去电子,形成正离子。
而非金属元素则倾向于接受电子,形成负离子。
正负离子之间由于电荷相互吸引而形成离子键。
总结起来,化学键的极性与离子键的形成密切相关。
极性键的形成是由于原子间电子云的不对称分布,而离子键的形成则是通过离子之间的电荷相互吸引。
这些化学键的类型和性质决定了分子和化合物的物理性质和化学反应,对于理解和解释物质行为具有重要意义。
通过深入探究化学键的极性与离子键的形成,我们可以更好地理解分子和化合物的性质,并为材料科学和化学工程领域的研究提供了基础。
极性键在化合物分子中,不同种原子形成的共价键,由于两个原子吸引电子的能力不同,共用电子对必然偏向吸引电子能力较强的原子一方,因而吸引电子能力较弱的原子一方相对的显正电性。
这样的共价键叫做极性共价键,简称极性键。
举例:HCl分子中的H-Cl键属于极性键判别同种原子之间的是非极性键极性键存在于不同种元素间但是存在极性键的物质不一定是极性分子.区分极性分子和非极性分子的方法:非极性分子的判据:中心原子化合价法和受力分析法1、中心原子化合价法:组成为ABn型化合物,若中心原子A的化合价等于族的序数,则该化合物为非极性分子.如:CH4,CCl4,SO3,PCl52、受力分析法:若已知键角(或空间结构),可进行受力分析,合力为0者为非极性分子.如:CO2,C2H4,BF33、同种原子组成的双原子分子都是非极性分子。
不是非极性分子的就是极性分子了常见极性分子:HX,CO,NO,H2O,H2S,NO2,SO2,SCl2,NH3,H2O2,CH3Cl,CH2Cl2,CHCl3,CH3 CH2OH非极性键=由同种元素的原子间形成的共价键,叫做非极性键。
同种原子吸引共用电子对的能力相等,成键电子云对称地分布在两核之间,不偏向任何一个原子,成键的原子都不显电性。
非极性键可存在于单质分子中(如H2中H—H键、O2中O=O键、N2中N≡N键),也可以存在于化合物分子中(如C2H2中的C—C键)。
非极性键的键偶极矩为0。
以非极性键结合形成的分子都是非极性分子。
存在于非极性分子中的键并非都是非极性键,如果一个多原子分子在空间结构上的正电荷几何中心和负电荷几何中心重合,那么即使它由极性键组成,那么它也是非极性分子。
由非极性键结合形成的晶体可以是原子晶体,也可以是混合型晶体或分子晶体。
例如,碳单质有三类同素异形体:依靠C—C非极性键可以形成正四面体骨架型金刚石(原子晶体)、层型石墨(混合型晶体),也可以形成球型碳分子富勒烯C60(分子晶体)。