键的极性和分子的极性
- 格式:ppt
- 大小:824.00 KB
- 文档页数:17

化学键的极性与分子极性化学键的极性和分子极性是化学中重要的概念,它们对于理解分子的性质和化学反应起着关键的作用。
细致地了解这些概念,能帮助我们更好地解释分子之间的相互作用和化学反应的发生。
一、化学键的极性在化学键中,原子之间的电子分布可能是不均匀的,这种不均匀的电子分布就导致了化学键的极性。
化学键的极性可以分为两种类型:极性共价键和离子键。
1. 极性共价键极性共价键是指在共价键中,两个原子之间的电子云不对称,导致电子密度在空间上的分布不平均。
这种不均匀的电子分布可以形成带正电荷的极性极和带负电荷的极性极,即δ+和δ-。
最典型的例子就是氢氟化合物(HF)。
氢原子的电子云被氟原子的电子云所吸引,形成了一个δ+的氢原子和一个δ-的氟原子。
这种带有极性共价键的分子具有分子极性,因为它们在空间上有正负极。
2. 离子键离子键是由正离子和负离子之间的静电力所形成的化学键。
在离子键中,电子从一个原子转移到另一个原子,形成了正离子和负离子。
典型的例子是氯化钠(NaCl)。
钠原子失去一个电子并形成正离子Na+,而氯原子接受一个电子并形成负离子Cl-,通过静电作用相互吸引形成离子键。
离子键通常是无极性的,因为它们不具有电荷分布的不均匀性。
二、分子极性分子极性是指整个分子在空间中分布着正负极的性质。
分子的极性取决于分子内部的化学键极性和分子的几何结构。
在判断分子极性时,需要考虑分子的对称性以及分子中各个化学键的极性。
1. 非极性分子非极性分子是指分子中的化学键都是非极性键,或者分子的几何结构使得正负极相互抵消。
例如,氧气(O2)分子是一个非极性分子,其中的氧氧键是非极性共价键,而且氧气分子是线性分子,正负极完全抵消。
2. 极性分子极性分子是指分子中至少存在一个极性键或者其几何结构导致正负极不能完全抵消。
例如,水分子(H2O)是一个极性分子。
它的氢氧键是极性共价键,氧原子相对于氢原子更加电负,所以在氧原子周围形成了部分负电荷,而氢原子周围形成了部分正电荷。

化学键的极性与分子极性化学键是构成分子的基本单位,它的极性与分子的极性密切相关。
在化学中,极性是指分子中正电荷和负电荷的分布不均匀,导致分子具有正极和负极的性质。
本文将探讨化学键的极性如何影响分子的极性,并介绍几种常见的化学键。
1. 极性化学键在化学键中,原子间的电子云分布不均匀会导致极性化学键的形成。
极性化学键可以分为两类:偏极性键和离子键。
偏极性键形成于两个不同原子间,其中一个原子的电负性较高,吸引了电子云,使得电子云更加偏向该原子。
例如,氯气(Cl2)中的化学键就是偏极性键。
氯原子的电负性较高,吸引了电子云,使得氯分子中的电子云偏向氯原子一侧。
离子键是由具有相反电荷的离子间形成的。
离子之间的吸引力非常强大,导致离子键通常具有很高的熔点和沸点。
例如,氯化钠(NaCl)中的化学键就是离子键。
氯离子和钠离子之间的电荷吸引力很强,使得它们形成了一个稳定的晶体结构。
2. 分子极性分子极性是由分子中各个化学键的极性所决定的。
分子可以是极性的,也可以是非极性的。
当分子中的化学键为非极性键时,分子通常是非极性的。
例如,氢气(H2)和氧气(O2)都是非极性分子。
它们的化学键都是非极性键,因此整个分子中的正电荷和负电荷分布均匀,没有正极和负极的区分。
当分子中存在极性化学键时,分子通常是极性的。
例如,水分子(H2O)是一个极性分子。
水分子中的氧原子比氢原子更加电负,吸引了电子云,使得氧原子周围的电子云密度更高,形成一个负极。
而氢原子周围的电子云密度较低,形成一个正极。
因此,水分子具有正极和负极的特性。
3. 影响分子极性的因素除了化学键的极性外,还有其他因素会影响分子的极性。
分子的几何形状是一个重要因素。
当分子呈线性形状时,即原子围绕中心原子排列成一条直线,分子通常是非极性的。
例如,二氧化碳(CO2)是一个非极性分子,因为氧原子和两个碳原子形成了一条直线。
然而,当分子呈非线性形状时,分子通常是极性的。
例如,氨(NH3)是一个极性分子。

化学键的极性与分子的极性在化学中,极性是指化学键或分子本身在空间中的偏向性。
化学键的极性和分子的极性密切相关,它们对于物质的性质和行为起着重要的影响。
本文将探讨化学键的极性和分子的极性之间的关系以及它们在实际中的应用。
一、化学键的极性化学键的极性是指化学键两端原子之间电荷分布的不均匀性。
在化学键中,存在着共价键和离子键两种类型。
1.1 共价键的极性共价键是由两个非金属原子共享电子而形成的化学键。
根据共享的电子对数目和电负性差异,共价键可以分为非极性共价键和极性共价键。
非极性共价键:当两个原子间的电负性相等或者差异很小时,所形成的共价键为非极性共价键。
这种共价键中电子对的共享相对均匀,电荷分布较平衡。
极性共价键:当两个原子间的电负性差异较大时,所形成的共价键为极性共价键。
这种共价键中电子对的共享不均匀,使得一个原子相对于另一个原子具有部分正或负的电荷。
1.2 离子键的极性离子键是由阳离子和阴离子之间的静电吸引力而形成的化学键。
由于离子中阳离子和阴离子间电荷差异较大,离子键一般为极性的。
在离子键中,正离子的电子云被阴离子所抽引,使得离子键中正离子相对于阴离子带有正电荷。
二、分子的极性分子的极性是指整个分子在空间中电荷分布的不均匀性。
分子的极性取决于其中的化学键的极性以及分子的几何构型。
2.1 区分非极性分子和极性分子非极性分子:当分子中所有化学键均为非极性共价键时,分子为非极性分子。
这样的分子中电荷分布均匀,无正负电荷的积累。
极性分子:当分子中至少存在一个极性共价键或离子键时,分子为极性分子。
这样的分子中电荷分布不均匀,存在正负电荷的积累。
2.2 分子的几何构型对极性的影响分子的几何构型对于极性有着重要的影响。
在一些分子中,虽然化学键可能是极性的,但由于分子整体的几何构型对称,导致分子整体呈非极性。
相反,几何构型不对称的分子通常是极性的。
三、极性与分子性质的关系分子极性的不同对于分子的性质和行为产生了重要影响,其中包括溶解性、沸点和熔点、分子间作用力等。

键的极性和分子的极性在H2(或I2)分子中,两个成键的H原子(或I原子)对共用电子对的吸引能力是相等的,整个分子的正电荷中心和负电荷中心是重合的,这种分子为非极性分子,H-H(或I-I)键为非极性共价键。
但HI分子则是极性分子,H-I键是极性共价键。
因为I的电负性(2.5)大于H(2.1),所以H-I键的共用电子对偏向于I的一端。
或者说HI分子中,I端显负性,而H端为正性。
凡由电负性不同的两个原子形成的共价键为极性共价键,它们的共用电子对偏向电负性大的一方,使电负性大的原子带部分负电荷,电成键原子的电负性差值(△χ)越大,键的极性就越大。
当0<△χ<1.7时,为极性共价键;当△χ>1.7时,电子对将完全偏于电负性大的原子一边,这就和离子键一样了。
例如Cl的电负性为3.0,Na为0.9,Mg为1.2,Na和Cl,Mg和Cl之间△χ值都大于1.7,因而都形成离子键。
由此可见离子键和共价键虽然是两种不同的化学键,但它们之间有联系,从离子键到共价键有递变关系。
例如BeCl2中的Be(χ=1.5)和Cl之间△χ为1.5,Be和Cl 原子形成极性很强的共价键,BeCl2在室温虽是固体,但熔点(405℃)比离子化合物如MgCl2(714℃),CaCl2(782℃)低得多,BeCl2的性质可以说是介于离子化合物和共价化合物之间的过渡状态。
键的极性是一种“矢量”,不但有大小,还有方向,它的方向用从正极到负极的方向表示。
分子的极性与键的极性有关,在双原子分子中,键有极性,分子就有极性,如HI,HCl等。
但以极性键结合的多原子分子,是否有极性,还要看分子的空间构型,因为它决定键的方向。
若分子结构的对称性使键的极性互相抵消,则分子没有极性。
如CO2分中的C=O键是极性键,但由于CO2分子呈直线型对称结构,两个C=O键的极性大小相等,方向相反,互相抵消,整个分子就成了没有极性的非极性分子:下图列举了CH4,NH3和H2O分子的构型和键角。


化学键的极性与分子的极性化学键的极性是指共享电子对在共有的原子核周围的分布不均,从而导致电子密度不对称的现象。
而分子的极性则是由于化学键的极性而导致的分子整体偏向某一方向的性质。
1. 介电常数与分子极性在讨论化学键的极性与分子极性之前,首先需要了解介电常数的概念。
介电常数是衡量物质中电场影响程度的物理性质。
分子中的极性取决于介电常数,具有较高介电常数的分子通常具有较高的极性。
2. 极性共价键与无极性共价键化学键可以分为极性共价键和无极性共价键两种类型。
极性共价键中,电子密度更大的一端带有较负电荷,而电子密度较小的一端带有较正电荷。
这是由于较负电性的原子对电子有较强的吸电子能力。
而无极性共价键则是指两个相同或相似电负性的原子之间共享电子对的现象,电子密度均匀分布。
3. 极性分子与非极性分子极性分子是指分子整体呈现正负电荷分离的状态,而非极性分子则是指分子整体呈现电荷均匀分布的状态。
一个分子的极性取决于化学键的极性及分子的分子式和空间结构。
4. 极性分子的特点极性分子具有一些特点:首先,极性分子在电场中会受到电场力的作用,在电场中会有定向效应;其次,在溶液中,极性分子由于电荷差异,会与溶剂分子发生作用,导致分子分散。
此外,在极性分子的内部,由于分子极性,可以发生分子内的氢键和范德华力相互作用。
5. 影响分子极性的因素分子极性的大小受到多种因素的影响。
其中,电负性差异是影响分子极性的重要因素,电负性差异越大,分子极性越大。
此外,分子的空间结构、分子的对称性以及分子内部的氢键也会影响分子的极性。
总结:化学键的极性决定了分子的极性,分子极性的大小取决于化学键的极性以及分子的分子式和空间结构。
极性分子具有正负电荷分离的特点,并在电场中表现出定向效应。
分子极性的大小受到电负性差异、分子的空间结构、分子的对称性以及分子内部的氢键等因素的影响。
以上就是关于化学键的极性与分子的极性的相关内容。
通过对化学键极性和分子极性的了解,我们可以更好地理解分子间的相互作用以及物质在化学反应和溶液中的行为。

键的极性与分子的极性化键的极性和分子的极性化是化学中一个重要的概念。
键的极性是指化学键中元素的电子密度分布是否不均匀,导致在键两端形成电荷分布不对称。
而分子的极性化则是指整个分子中所有键的极性叠加而形成的整体电荷分布不对称现象。
本文将探讨键的极性与分子的极性化之间的关系以及在化学中的应用。
一、键的极性及其影响键是化学反应中原子之间的相互作用,可以是共价键、离子键或金属键。
共价键中,电子是共享的,但并非始终是等量共享的,导致的结果是键两端带有部分正电荷和部分负电荷。
这就形成了键的极性。
键的极性对物质的性质有着重要的影响。
1. 电负性差异键的极性主要由连接原子的电负性差异所决定。
电负性是一个描述原子对电子亲和力的化学概念,描述的是原子吸引电子对的能力。
电负性差异越大,键的极性越强。
2. 极性化电子云键的极性导致了电子云分布的不对称。
较电负的原子更吸引电子云,导致在键两端形成一个部分正电荷,而较电负的原子附近则形成一个部分负电荷。
二、分子的极性化当一个分子中存在多个键,并且这些键的极性方向不同,这些极性会叠加而导致分子整体的极性化。
分子的极性化对分子的性质具有重要的影响。
1. 极性分子如果一个分子中所有键的极性都叠加为同一方向,那么这个分子就是极性分子。
一个极性分子往往具有部分正电荷和部分负电荷的极性部分。
2. 非极性分子如果一个分子中的键的极性叠加相互抵消,也就是说正电荷和负电荷的分布相互平衡,那么这个分子就是非极性分子。
非极性分子中并没有明显的电荷分布不均。
三、键的极性与分子的性质键的极性和分子的极性化在化学中的应用非常广泛,并且对于分子的性质有着重要的影响。
1. 溶解性极性分子通常在极性溶剂中具有较好的溶解性。
这是因为具有极性的分子可以与溶剂中的极性分子产生相互作用,从而更好地溶解。
2. 极性物质的沸点和熔点极性物质通常具有较高的沸点和熔点。
这是因为在极性分子中,分子间的作用力更强。
通过增加键的极性,可以提高分子间的作用力,进而提高沸点和熔点。
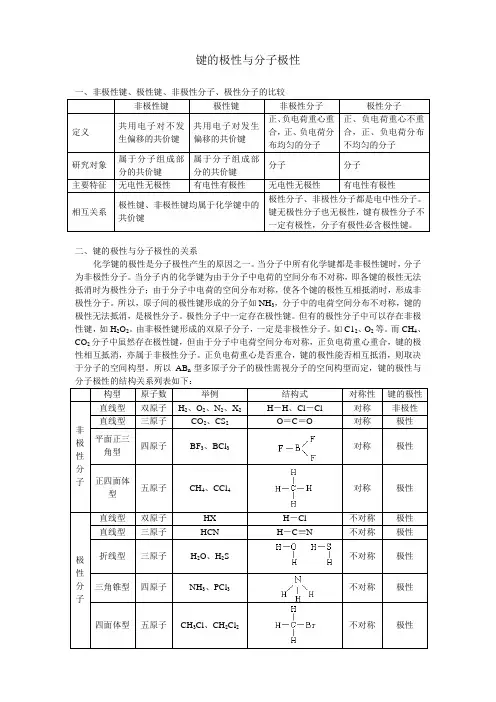
键的极性与分子极性一、非极性键、极性键、非极性分子、极性分子的比较非极性键极性键非极性分子极性分子定义共用电子对不发生偏移的共价键共用电子对发生偏移的共价键正、负电荷重心重合,正、负电荷分布均匀的分子正、负电荷重心不重合,正、负电荷分布不均匀的分子研究对象属于分子组成部分的共价键属于分子组成部分的共价键分子分子主要特征无电性无极性有电性有极性无电性无极性有电性有极性相互关系极性键、非极性键均属于化学键中的共价键极性分子、非极性分子都是电中性分子。
键无极性分子也无极性,键有极性分子不一定有极性,分子有极性必含极性键。
二、键的极性与分子极性的关系化学键的极性是分子极性产生的原因之一。
当分子中所有化学键都是非极性键时,分子为非极性分子。
当分子内的化学键为由于分子中电荷的空间分布不对称,即各键的极性无法抵消时为极性分子;由于分子中电荷的空间分布对称,使各个键的极性互相抵消时,形成非极性分子。
所以,原子间的极性键形成的分子如NH3,分子中的电荷空间分布不对称,键的极性无法抵消,是极性分子。
极性分子中一定存在极性键。
但有的极性分子中可以存在非极性键,如H2O2。
由非极性键形成的双原子分子,一定是非极性分子。
如C12、O2等。
而CH4、CO2分子中虽然存在极性键,但由于分子中电荷空间分布对称,正负电荷重心重合,键的极性相互抵消,亦属于非极性分子。
正负电荷重心是否重合,键的极性能否相互抵消,则取决于分子的空间构型。
所以AB n型多原子分子的极性需视分子的空间构型而定,键的极性与构型原子数举例结构式对称性键的极性非极性分子直线型双原子H2、O2、N2、X2 H-H、Cl-Cl 对称非极性直线型三原子CO2、CS2 O=C=O 对称极性平面正三角型四原子BF3、BCl3 对称极性正四面体型五原子CH4、CCl4 对称极性极性分子直线型双原子HX H-Cl 不对称极性直线型三原子HCN H-C≡N 不对称极性折线型三原子H2O、H2S 不对称极性三角锥型四原子NH3、PCl3 不对称极性四面体型五原子CH3Cl、CH2Cl2 不对称极性对于上述AB n型分子极性的判断也可用以下规律:⑴若中心原子(A)的化合价的绝对值等于该元素的主族序数,则为非极性分子;若不相等,则为极性分子。

化学键的极性与分子的极性化学键的极性是指在共享结构中电子的不均匀分布程度。
根据共享电子对的吸引能力差异,化学键可以分为极性键和非极性键。
分子的极性则是指整个分子的电荷分布对称性。
一、化学键的极性化学键的极性是由于原子的电负性差异造成的。
电负性是用来描述原子吸引电子对的能力的化学性质指标。
原子的电负性越大,其对共享电子对的吸引能力越强,化学键的极性越大。
1. 非极性键非极性键是指原子之间电负性差异很小,共享电子对的分布均匀的化学键。
共享的电子对在两个原子之间均匀分布,没有明显的正负电荷分离。
例如氢气(H2)分子中两个氢原子的电负性相等,共享电子对不会偏向其中任何一方,因此H2分子的键是非极性的。
2. 极性键极性键是指原子之间电负性差异较大,共享电子对的分布不均匀的化学键。
共享电子对更倾向于电负性较高的原子,造成正负电荷分离。
例如氯化氢(HCl)分子中,氯原子的电负性比氢原子大,共享电子对更接近氯原子,使氯离子部分带负电荷,氢离子部分带正电荷,因此HCl分子的键是极性的。
二、分子的极性分子的极性由分子内键的极性和分子的几何结构共同决定。
分子的极性可以通过以下几个方面进行分析:1. 键的极性分子内的极性键对于分子的极性起重要作用。
如果分子中的所有化学键都是非极性键,那么整个分子也是非极性的。
但如果分子中只有一个或部分键是极性键,那么整个分子就有极性。
2. 分子的对称性如果分子中的化学键的极性相互抵消,整个分子可以达到对称分布,那么分子就是非极性的。
但如果分子中的化学键的极性不能相互抵消,那么分子就是极性的。
3. 分子的几何结构分子的几何结构对其极性也有一定的影响。
如果分子呈线性结构,即化学键的方向在一个直线上,那么分子很可能是非极性的。
而如果分子呈非线性结构,即化学键的方向不能在一个直线上,那么分子很可能是极性的。
总结起来,化学键的极性决定了分子的极性。
化学键极性越大,分子极性越明显。
分子的极性通过键的极性、分子的对称性和分子的几何结构来决定。

键的极性与分子极性键的极性和分子极性是化学中重要的概念。
键的极性指的是化学键中电子的分布不均匀,导致键两侧电荷不平衡的现象。
分子极性则是指整个分子中键的极性矢量之和。
键的极性和分子极性对于分子的性质和反应具有重要影响。
在接下来的文章中,我们将分析键的极性和分子极性的原因以及它们对化学性质的影响。
一、键的极性的原因键的极性有两个主要的原因:电负性差异和几何结构。
1. 电负性差异电负性是元素吸引共用电子对的能力。
当两个不同元素形成共用键时,由于它们的电负性不同,会导致电子在键中的分布不均匀。
电负性大的元素吸引周围的电子,形成负部分,而电负性小的元素则形成正部分。
例如,氯气(Cl2)中的氯原子具有相似的电负性,因此它们共享电子对平均分布,形成非极性分子。
但是,在氯甲烷(CH3Cl)中,氯原子比碳原子更具电负性,使得电子密度偏向氯原子,形成部分负电荷。
2. 几何结构另一个影响键的极性的因素是分子的几何结构。
当分子呈现对称结构时,即使键中存在电负性差异,分子仍可是非极性。
例如,二氧化碳(CO2)是一个线性分子,氧原子比碳原子具有更高的电负性。
然而,由于氧原子位于碳原子两侧,呈线性排列,两个键的极性互相抵消,导致CO2成为非极性分子。
二、分子极性的确定分子极性是由分子的几何结构以及键的极性决定的。
1. 对称分子当分子的几何结构具有对称性时,分子极性为0。
这是因为分子内的键的极性互相抵消,导致分子整体没有极性。
例如,甲烷(CH4)的四个碳-氢键极性相同,呈四面体结构,使得分子无净极性。
2. 非对称分子当分子的几何结构不对称时,分子极性不为0。
这是因为键的极性无法完全抵消,导致分子具有净极性。
例如,水分子(H2O)中的氧原子比氢原子更具电负性,使得水分子成为带有极性的分子。
氧原子部分带负电荷,而两个氢原子部分带正电荷。
三、键的极性和分子极性对性质的影响键的极性和分子极性对分子的性质和反应有重要影响。
1. 溶解度极性分子通常与其他极性分子或离子发生相互作用,因此具有较好的溶解度。

键的极性与分子的极性性质键的极性是指化学键中电子密度偏离共有电子对数较多的原子,使得分子或晶体的两端带有正负电荷,产生极性分子。
而分子的极性性质则决定了分子在化学反应中的行为以及与其他分子之间的相互作用。
一、键的极性键的极性由键的成分决定,在分子中,通常包括非极性键和极性键两种类型。
1. 非极性键非极性键是由两个原子间共用电子对称分布导致的,其中最常见的例子是碳-碳键和碳-氢键。
由于这些键中电子密度对称分布,所以非极性键没有带电性,电子云的电荷分布对称,也不会发生极性分子的形成。
2. 极性键极性键是由两个原子间共用电子偏向某一方向所导致的,导致电子云在空间上不对称分布,并且使得分子带有局部电荷。
典型的例子是含有氧、氮、氢和氟等元素的化合物中的氧键、氮键、氢键和氟键。
在这些键中,由于电子云的极性分布,分子会具有正负性电荷的偏离。
二、分子的极性性质分子的极性性质对于分子之间的相互作用、物理性质和化学性质都具有重要影响。
1. 相互作用极性分子之间的相互作用更强烈,因为带电的分子极端会与其他带异性电荷的分子相互吸引。
这种相互作用可以导致分子聚集形成固体晶体或液态聚集体,并影响其物理性质,如熔点和沸点等。
2. 溶解性极性分子通常溶解于其他极性溶剂中,因为它们之间能够建立氢键和疏水作用等强相互作用力。
相反,非极性分子通常溶解于非极性溶剂中,如疏水性溶剂,因为它们之间没有相互吸引力。
3. 化学反应极性分子更容易发生化学反应,因为极性键的活性较高,更容易参与反应。
此外,极性键也对分子的稳定性和反应路径产生重要影响。
总结:键的极性与分子的极性性质密切相关。
通过了解和研究化学键的极性性质,我们可以更好地理解化学反应的本质,并预测分子之间的相互作用和物理性质。
对于化学和材料科学的研究和应用具有重要意义。
化学键的极性与分子极性化学键的极性是指化学键中电子的偏移程度或电子云的不对称性。
根据键的极性,可以判断分子的极性。
1. 极性化学键极性化学键是指由两种不同元素构成的原子通过共用电子对形成的化学键。
在极性化学键中,一种元素的电负性更强,吸引共用电子对的电子更多,从而使电子分布不均匀。
由于电子云密度的不对称分布,形成了极性化学键。
2. 非极性化学键非极性化学键是指由相同元素构成的原子通过共用电子对形成的化学键。
在非极性化学键中,两种原子的电负性相等,吸引共用电子对的电子平衡,电子云密度均匀分布。
3. 分子极性分子极性是指整个分子中所有化学键的极性综合考虑后的结果。
分子极性与分子的对称性、分子中的原子类型和电负性有关。
3.1 极性分子极性分子中,化学键的极性叠加形成分子整体的部分正电荷和部分负电荷。
这种分子呈现出明显的正负极性,即分子两端存在局部正电荷和局部负电荷,如H2O(水分子)。
水分子是由两个氢原子和一个氧原子通过共用电子对形成的,氧原子的电负性更大,吸引电子更多,从而使氧原子周围的电子云密度较大,形成局部负电荷;而氢原子周围的电子云密度较小,形成局部正电荷。
因此,水分子是极性分子。
3.2 非极性分子非极性分子中,化学键的极性互相抵消,分子整体不显示明显的正负极性。
这种分子的形状对称,或者化学键的极性之间矢量合成为零,如CO2(二氧化碳)分子。
CO2分子由一个碳原子和两个氧原子通过共用电子对形成的,碳原子和氧原子的电负性相等,由于CO2分子的线性结构,两个极性化学键的极性矢量合成为零,使得CO2分子整体不呈现出正负极性,因此CO2是非极性分子。
总结:化学键的极性决定了分子的极性。
极性化学键一般导致分子的极性,非极性化学键一般导致分子的非极性。
在分子中,各种化学键的极性叠加决定了分子的整体极性。
分子的极性对于物质的性质和相互作用具有重要影响,也对化学反应和生命活动起到关键作用。
化学键的极性和分子极性化学键的极性和分子极性是化学中重要的概念。
化学键的极性指的是共享电子对在化学键中的分布情况,而分子极性则是整个分子在空间中的总体极性。
一、化学键的极性化学键可以分为两种类型:共价键和离子键。
共价键是通过相互共享电子对来形成的,而离子键是通过正负电荷之间的作用而形成的。
共价键的极性取决于元素的电负性差异,电负性较大的原子将对电子有更强的吸引力。
极性较大的共价键被称为极性共价键,极性较小的称为非极性共价键。
1. 极性共价键当两个不同化学元素之间形成共价键时,由于它们的电负性不同,形成的共价键会有极性。
其中,电负性较大的原子会获得更多的电子密度,而电负性较小的原子则会失去一部分电子密度。
这导致了共享电子对的不均匀分布,形成了极性共价键。
例如,在水分子(H2O)中,氧原子的电负性较大,吸引了氢原子的电子密度,因此水分子中的氧原子部分带负电,氢原子部分带正电。
2. 非极性共价键如果两个相同化学元素之间形成共价键,它们的电负性相同,共享电子对的分布也就相对均匀。
这种共价键被称为非极性共价键。
例如,氧气分子(O2)中的氧原子之间形成的共价键就是非极性共价键。
二、分子极性分子极性受到所有化学键的极性以及分子的几何构型的影响。
在分子中,如果每个化学键都是非极性共价键,那么整个分子就是非极性分子。
同样,如果分子中至少有一个极性共价键,那么这个分子就是极性分子。
分子极性的产生还与分子的空间结构有关。
1. 非极性分子非极性分子的化学键都是非极性共价键,并且分子的几何构型使得所有极性共价键的极性相互抵消。
例如,甲烷(CH4)是一个非极性分子,因为碳与氢之间的化学键都是非极性共价键,并且分子的构型使得所有化学键的极性相互抵消。
2. 极性分子对于极性分子,至少有一对非相等的极性共价键,或者分子的几何构型使得化学键的极性不能完全抵消。
例如,氯化氢(HCl)是一个极性分子,因为氢和氯之间的化学键是极性共价键,氢原子部分带正电,氯原子部分带负电。
化学键的极性和分子极性的计算化学键的极性是指化学键中电子的共享程度,以及分子中正负电荷分布的不均匀程度。
分子的极性则是由分子中各个化学键的极性所决定的,它描述了整个分子的正负电荷分布情况。
在化学中,极性和分子极性的计算对于了解分子性质和反应机理具有重要意义。
一、化学键的极性的计算1. 电负性差异法:化学键的极性可以通过计算键中两个原子的电负性差异来确定。
电负性差异越大,键的极性越大。
一般来说,当电负性差异小于0.4时,化学键被认为是非极性的;当电负性差异在0.4-1.7之间时,化学键被视为极性的;而当电负性差异大于1.7时,可以认为是离子键。
2. 电子云密度分布法:化学键的极性也可以通过考察共价键中电子云密度的分布情况来确定。
如果一个原子周围的电子云较为密集,而另一个原子周围的电子云相对较稀疏,则可以认为这个化学键是极性的。
3. 几何构型法:化学键的极性还与化学键的几何构型有关。
当共价键中间有孤对电子或者多个不同原子构成化学键时,这些几何特点会导致化学键的极性。
二、分子极性的计算1. 同向分子极性计算:计算分子中各个化学键的极性,并根据它们的分布情况来确定分子的总极性。
如果分子中的极性键的数量多于非极性键的数量,并且这些极性键的位置分布不均匀,则可以认为这个分子是极性的。
2. 几何构型法:分子极性还与分子的几何构型有关。
当一个分子的分子形状不对称,或者分子中存在具有孤对电子的原子时,这些几何特点都会导致分子的极性。
3. 整体电荷计算法:通过计算分子中正负电荷的总量来确定分子极性。
如果分子中正电荷多于负电荷,则分子是带正电的;如果负电荷多于正电荷,则分子是带负电的。
综上所述,化学键的极性和分子极性的计算可以通过多种方法来确定,其中主要考察了电负性差异、电子云密度分布、几何构型和整体电荷等因素。
这些计算方法为我们理解分子性质,研究化学反应机理等提供了有力的工具。
化学键的极性和分子的极性化学键的极性和分子的极性是化学中重要的概念,它们对于理解分子的性质和化学反应具有重要的意义。
本文将从化学键的极性、分子的极性以及它们之间的关系三个方面进行阐述。
一、化学键的极性化学键的极性指的是化学键两端原子之间电荷分布的不均匀性。
根据原子间电子云密度的差异,化学键可以分为非极性键和极性键两种。
非极性键:当两个原子间电子云密度均匀分布,共享电子对等量时,形成的化学键为非极性键。
非极性键通常存在于相同原子之间或电负性相近的原子之间。
例如氢气分子(H2),氧气分子(O2)中的氧气分子。
极性键:当化学键两端原子间电子云密度不均匀分布,无机物中最典型的有极性键的原子是氮、氧、氯等。
极性键通常形成于不同原子之间,其中一个原子的电负性更大,吸引更多的电子密度,使其带有部分负电荷,另一个原子则带有部分正电荷。
例如氢氧化钠(NaOH)中的氧原子和氢原子之间的化学键即为一个极性键。
二、分子的极性分子的极性指的是分子整体的电荷分布情况。
根据分子的对称性和化学键的极性,分子可以分为非极性分子和极性分子。
非极性分子:当一个分子中化学键均为非极性键,或化学键的极性相互抵消时,该分子为非极性分子。
非极性分子通常具有对称的几何结构,其中电荷中心和电荷分布均匀。
例如甲烷(CH4)分子中四个碳氢化合物键都是非极性键,因此甲烷是非极性分子。
极性分子:当一个分子中至少存在一个极性键时,或化学键的极性不能完全互相抵消时,该分子为极性分子。
极性分子通常具有非对称的几何结构,其中电荷中心和电荷分布不均匀。
例如水分子(H2O)中氧原子和氢原子之间的化学键是极性键,使整个水分子呈现极性。
三、化学键的极性对分子的极性的影响化学键的极性直接影响着分子的极性。
当分子中存在极性键时,整个分子会有一定的分子极性,这导致了分子在化学反应中的性质和行为的变化。
极性分子的特点:1. 极性分子在极性溶剂中溶解度较高,而在非极性溶剂中溶解度较低。