极性键与非极性键的区别
- 格式:doc
- 大小:29.50 KB
- 文档页数:2

怎么区分非极性键和极性键
化学中的共价键可以被分为两种类型:极性键和非极性键。
极性键是指在化学键中由于电子云分布不均而形成的部分正电荷和部分负电荷的化学键。
相反,非极性键是指在化学键中电子云分布均匀的化学键。
区分非极性键和极性键的方法如下:
1.分子几何形状:极性分子通常具有不对称的分子几何形状,例如水分子(H2O)是一个具有极性键的分子,因为氧原子吸引电子的能力更强,所以它带有部分负电荷,而氢原子则带有部分正电荷。
相反,二氧化碳(CO2)是一个非极性分子,因为氧原子和碳原子之间的电子云分布是均匀的。
2.原子电负性差异:在一个化学键中,如果两个原子之间的电负性差异较大,则会形成一个极性键。
例如,氧气分子(O2)是一个非极性分子,因为两个氧原子具有相同的电负性,它们之间的电子云分布是均匀的。
而在水分子中,氢原子的电负性较低,因此与氧原子之间形成了一个极性键。
3.溶解性:极性分子通常具有良好的溶解性,因为它们可以通过分子间的极性相互作用与其他分子进行相互作用。
相反,非极性分子通常只能溶解于其他非极性分子中。
举例来说,CH4是一个非极性分子,因为它的所有碳-氢化学键都是非极性键。
相反,氯气(Cl2)是一个非极性分子,因为两个氯原子之间的电子云分布是均匀的。
相反,HCl是一个极性分子,因为氢原子和氯原子之间的电负性差异会导致形成极性键。

含极性键的非极性物质
1.区分极性键和非极性键:
看原子的种类.同种为非极性键,如Cl2中Cl—Cl键是非极性键;不同种为极性键,如BF3中B——F键是极性键.
2.区分极性分子和非极性分子:
极性分子和非极性分子,如果由极性键构成的物质,还要看其排列,如果正电荷的中心和负电荷的中心重叠,那么他也是非极性分子原子种类不同的双原子分子,是极性分子,如HCl。
若为ABn型分子,中心原子A的化合价/最外层电子数是整数,是非极性分子,如甲烷CH4,四氯化碳CCl4。
不为整数是极性分子,如SO2.(此为经验方法)。

极性键和非极性键的定义
极性键是在化合物分子中,不同种原子形成的共价键,由于两个原子吸引电子的能力不同,共用电子对必然偏向吸引电子能力较强的原子一方,因而吸引电子能力较弱的原子一方相对的显正电性。
这样的共价键叫做极性共价键,简称极性键。
当电子对两边的原子不同时,对电子的吸引力就不同,就会使电子对偏向于电负性大的原子。
形成极性。
当电子对两边的原子相同时,对电子的吸引了就相同,电子就不偏向哪边原子。
形成非极性。

极性键在化合物分子中,不同种原子形成的共价键,由于两个原子吸引电子的能力不同,共用电子对必然偏向吸引电子能力较强的原子一方,因而吸引电子能力较弱的原子一方相对的显正电性。
这样的共价键叫做极性共价键,简称极性键。
举例:HCl分子中的H-Cl键属于极性键判别同种原子之间的是非极性键极性键存在于不同种元素间但是存在极性键的物质不一定是极性分子.区分极性分子和非极性分子的方法:非极性分子的判据:中心原子化合价法和受力分析法1、中心原子化合价法:组成为ABn型化合物,若中心原子A的化合价等于族的序数,则该化合物为非极性分子.如:CH4,CCl4,SO3,PCl52、受力分析法:若已知键角(或空间结构),可进行受力分析,合力为0者为非极性分子.如:CO2,C2H4,BF33、同种原子组成的双原子分子都是非极性分子。
不是非极性分子的就是极性分子了常见极性分子:HX,CO,NO,H2O,H2S,NO2,SO2,SCl2,NH3,H2O2,CH3Cl,CH2Cl2,CHCl3,CH3 CH2OH非极性键=由同种元素的原子间形成的共价键,叫做非极性键。
同种原子吸引共用电子对的能力相等,成键电子云对称地分布在两核之间,不偏向任何一个原子,成键的原子都不显电性。
非极性键可存在于单质分子中(如H2中H—H键、O2中O=O键、N2中N≡N键),也可以存在于化合物分子中(如C2H2中的C—C键)。
非极性键的键偶极矩为0。
以非极性键结合形成的分子都是非极性分子。
存在于非极性分子中的键并非都是非极性键,如果一个多原子分子在空间结构上的正电荷几何中心和负电荷几何中心重合,那么即使它由极性键组成,那么它也是非极性分子。
由非极性键结合形成的晶体可以是原子晶体,也可以是混合型晶体或分子晶体。
例如,碳单质有三类同素异形体:依靠C—C非极性键可以形成正四面体骨架型金刚石(原子晶体)、层型石墨(混合型晶体),也可以形成球型碳分子富勒烯C60(分子晶体)。

极性与非极性是针对分子说的。
首先化学共价键分为极性键与非极性键。
非极性键就是共用电子对没有偏移,出现在单质中比如O2;极性键就是共用电子对有偏移比如HCl。
而当偏移的非常厉害之后,看上去一边完全失电子另一边得到了电子,就会变成离子键了,如NaCl再说极性分子与与非极性分子。
由于极性键的出现,所以就使某些分子出现了电极性,但是并不是说所有有极性键的分子都是极性分子。
比如CH4,虽然含有4个极性的C-H键,但是因为其空间上成对称的正四面体结构,所以键的极性相消,整个分子没有极性对与H2O,虽然与CO2有相同类型的分子式,也同样有极性共价键,但二者分子的极性却不同。
CO2是空间对称的直线型,所以分子是非极性分子,H2O是折线型,不对称,所以是极性分子,作为溶剂称为极性溶剂常用溶剂的极性顺序:水(最大) > 甲酰胺> 乙腈> 甲醇> 乙醇> 丙醇> 丙酮>二氧六环> 四氢呋喃> 甲乙酮> 正丁醇> 乙酸乙酯> 乙醚> 异丙醚> 二氯甲烷>氯仿>溴乙烷>苯>四氯化碳>二硫化碳>环己烷>己烷>煤油(最小)常见问题1:两个相同的原子之间形成的共价键一定是非极性键吗?问题:两个相同的原子之间形成的共价键一定是非极性键吗?解答:两个相同的原子之间形成的共价键不一定是非极性键.例如乙醇分子:两个碳原子两边结构不对称,两边对共用电子对的吸引能力不同,则共用电子对不在两个C原子之间的中心位置,即偏向一方,因而形成的共价键不是非极性键.常见问题2:键的极性和分子的极性问题:键的极性和分子的极性解答:1.键的极性键的极性取决于成键的两原子非金属性强弱.一般说,成键的两原子是同种元素的原子,键为非极性键.如果成键的两原子是不同种元素的原子,键为极性键.2.分子的极性在同一分子中,可以同时存在极性键和非极性键.分子的极性取决于键的极性和分子中的键的空间排列.双原子分子的极性与键的极性是一致的,即以极性键结合的双原子分子一定是极性分子.以非极性键结合的双原子分子一定是非极性分子.对于多原子分子的极性除与键的极性有关系外,还与键的空间排列有关.若键的空间排列对称,为对称分子,分子中正、负电荷重心重合,则是非极性分子.如二氧化碳,四氯化碳等.若键的空间排列不对称,分子中正、负电荷重心不重合,分子中出现了带部分正、负电荷的两极,则是极性分子,如水分子.常见问题3:分子极性的判断问题:分子极性的判断解答:判断是否极性分子,进行判断可从分子空间构型是否对称,即分子中各键的空间排列是否对称,若对称,则正负电荷重心重合,分子为非极性分子,反之,是极性分子。

化学键的极性与分子的极性化学键的极性是指在共享结构中电子的不均匀分布程度。
根据共享电子对的吸引能力差异,化学键可以分为极性键和非极性键。
分子的极性则是指整个分子的电荷分布对称性。
一、化学键的极性化学键的极性是由于原子的电负性差异造成的。
电负性是用来描述原子吸引电子对的能力的化学性质指标。
原子的电负性越大,其对共享电子对的吸引能力越强,化学键的极性越大。
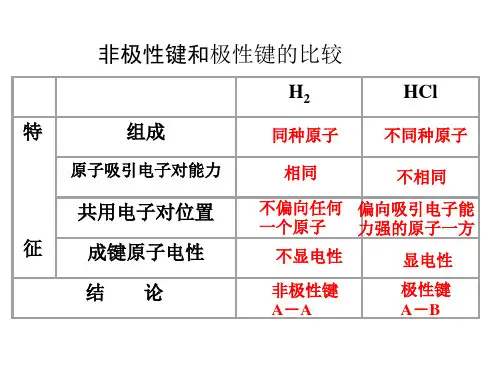
1. 非极性键非极性键是指原子之间电负性差异很小,共享电子对的分布均匀的化学键。
共享的电子对在两个原子之间均匀分布,没有明显的正负电荷分离。
例如氢气(H2)分子中两个氢原子的电负性相等,共享电子对不会偏向其中任何一方,因此H2分子的键是非极性的。
2. 极性键极性键是指原子之间电负性差异较大,共享电子对的分布不均匀的化学键。
共享电子对更倾向于电负性较高的原子,造成正负电荷分离。
例如氯化氢(HCl)分子中,氯原子的电负性比氢原子大,共享电子对更接近氯原子,使氯离子部分带负电荷,氢离子部分带正电荷,因此HCl分子的键是极性的。
二、分子的极性分子的极性由分子内键的极性和分子的几何结构共同决定。
分子的极性可以通过以下几个方面进行分析:1. 键的极性分子内的极性键对于分子的极性起重要作用。
如果分子中的所有化学键都是非极性键,那么整个分子也是非极性的。
但如果分子中只有一个或部分键是极性键,那么整个分子就有极性。
2. 分子的对称性如果分子中的化学键的极性相互抵消,整个分子可以达到对称分布,那么分子就是非极性的。
但如果分子中的化学键的极性不能相互抵消,那么分子就是极性的。
3. 分子的几何结构分子的几何结构对其极性也有一定的影响。
如果分子呈线性结构,即化学键的方向在一个直线上,那么分子很可能是非极性的。
而如果分子呈非线性结构,即化学键的方向不能在一个直线上,那么分子很可能是极性的。
总结起来,化学键的极性决定了分子的极性。
化学键极性越大,分子极性越明显。
分子的极性通过键的极性、分子的对称性和分子的几何结构来决定。

极性键在化合物分子中,不同种原子形成的共价键,由于两个原子吸引电子的能力不同,共用电子对必然偏向吸引电子能力较强的原子一方,因而吸引电子能力较弱的原子一方相对的显正电性。
这样的共价键叫做极性共价键,简称极性键。
举例:HCl 分子中的H-Cl 键属于极性键判别同种原子之间的是非极性键极性键存在于不同种元素间但是存在极性键的物质不一定是极性分子. 区分极性分子和非极性分子的方法: 非极性分子的判据:中心原子化合价法和受力分析法1、中心原子化合价法:组成为ABn 型化合物,若中心原子A 的化合价等于族的序数,则该化合物为非极性分子.如:CH4,CCI4,SO3,PCI52、受力分析法:若已知键角(或空间结构),可进行受力分析,合力为0 者为非极性分子.如:CO2,C2H4,BF33、同种原子组成的双原子分子都是非极性分子。
不是非极性分子的就是极性分子了常见极性分子:HX,CO,NO,H2O,H2S,NO2,SO2,SCI2,NH3,H2O2,CH3CI,CH2CI2,CHCI3,CH3CH2OH非极性键= 由同种元素的原子间形成的共价键,叫做非极性键。
同种原子吸引共用电子对的能力相等,成键电子云对称地分布在两核之间,不偏向任何一个原子,成键的原子都不显电性。
非极性键可存在于单质分子中(如H2中H —H键、O2中O = O键、N2中N^N键),也可以存在于化合物分子中(如C2H2中的C—C键)。
非极性键的键偶极矩为0。
以非极性键结合形成的分子都是非极性分子。
存在于非极性分子中的键并非都是非极性键,如果一个多原子分子在空间结构上的正电荷几何中心和负电荷几何中心重合,那么即使它由极性键组成,那么它也是非极性分子。
由非极性键结合形成的晶体可以是原子晶体,也可以是混合型晶体或分子晶体。
例如,碳单质有三类同素异形体:依靠C—C 非极性键可以形成正四面体骨架型金刚石(原子晶体)、层型石墨(混合型晶体),也可以形成球型碳分子富勒烯C60 (分子晶体)。

有机化学基础知识点化学键的极性和非极性化学键是有机化学中的重要概念,它描述了原子之间的结合方式和性质。
其中,化学键的极性与非极性是化学键性质的重要方面。
本文将从极性和非极性两个方面来介绍有机化学键的基础知识点。
1. 化学键的概念化学键是指原子之间通过电子的共享或转移而形成的相互结合的现象。
化学键的形成和破坏是化学反应发生的依据,决定了物质的性质和反应的进行。
2. 极性化学键的特点极性化学键是指成键原子之间电子密度不均匀分布的化学键。
在极性化学键中,由于原子对电子的亲和力不同,导致电子的共享不平均,形成了正负电荷分布不均的情况。
3. 非极性化学键的特点非极性化学键是指成键原子之间电子密度均匀分布的化学键。
在非极性化学键中,成键原子对电子的亲和力相近,导致电子的共享比较均匀,正负电荷分布相对平衡。
4. 极性分子的特点极性化学键的存在会导致分子整体呈现极性。
极性分子具有以下特点:1) 极性分子在外电场作用下会有朝向电场方向的取向;2) 极性分子在溶解过程中会与溶剂中的分子发生相互作用,溶解度较大;3) 极性分子在物理性质上表现为较低的沸点和较高的溶解度。
5. 非极性分子的特点非极性分子的键中不存在电荷分离,因此整个分子没有正负电荷分布不均的情况。
非极性分子具有以下特点:1) 非极性分子在外电场作用下不会有明显的取向;2) 非极性分子在溶解过程中不与溶剂中的分子发生明显的相互作用,溶解度较小;3) 非极性分子在物理性质上表现为较高的沸点和较低的溶解度。
6. 极性键与非极性键的判断判断化学键的极性与非极性,主要取决于成键原子之间的电负性差异。
电负性差异较大的原子对之间往往形成极性化学键,电负性差异较小的原子对之间往往形成非极性化学键。
7. 极性键与分子的性质关系极性化学键的存在直接影响了分子的性质,例如溶解度、沸点等。
极性分子的极性化学键能够与其他分子形成氢键或静电作用,使得极性分子在物理性质上表现出较高的沸点和溶解度。

极性键与非极性键的判断极性键和非极性键的判断,真是个有趣的话题。
听起来可能有点复杂,但其实只要抓住几个关键点,就能轻松上手。
咱们从基本概念聊起,逐步深入。
一、极性键的特点1.1 极性键是怎样的极性键,顾名思义,就是分子里有一端带正电,另一端带负电。
想象一下,像个拉锯战,两边都在争夺电子。
这样一来,电荷分布不均,导致分子有电偶极子。
很明显,水就是个好例子。
这个小家伙的氧原子吸引电子比氢原子强多了,结果形成了极性。
1.2 如何判断极性判断极性得看元素的电负性。
简单来说,电负性越高,吸引电子的能力越强。
用简单的标准来衡量,电负性差异大于0.4,基本上就可以认为是极性键了。
这就好比一场比赛,实力悬殊的一方总能占上风。
二、非极性键的特点2.1 非极性键是什么非极性键可就简单多了。
它们的电子共享比较均匀,没谁比谁强。
想想氮气(N₂)和氧气(O₂),两个同类元素,电子自然就“平分秋色”。
这让分子内部没有电荷差异,完全平和。
2.2 判断非极性的方法电负性差异小于0.4,恭喜你,这就是非极性键。
像一对好兄弟,大家都公平对待,没谁更占优势。
这种键的特点让它们在生活中常常存在,比如油和油之间的结合。
2.3 非极性分子的特征非极性分子往往溶于非极性溶剂,水却对它们无能为力。
这就好比油和水,谁也不想和谁混在一起。
它们能在生活中形成各种有趣的现象,比如油滴在水面上漂浮。
三、极性与非极性的影响3.1 对溶解性的影响极性和非极性在溶解性上扮演着关键角色。
极性分子通常能与极性溶剂相溶,形成氢键,仿佛在一场舞会上跳起舞来。
而非极性分子则会聚在一起,保持自己的“朋友圈”。
这一点在化学反应中尤其重要。
3.2 生物体系中的角色在生物体系里,极性和非极性分子也扮演着不同的角色。
细胞膜就是个典型例子,外层是非极性,内层是极性,形成了一个屏障。
这样一来,细胞能控制物质进出,维持生存环境的稳定。
四、总结极性键和非极性键的判断其实并不神秘。
只要记住电负性和电荷分布的原则,咱们就能在这个化学世界中游刃有余。

化学键的极性与非极性化学键是化学反应中原子之间的相互作用形成的。
根据键形成时电子的共享或转移程度不同,化学键可以被划分为极性键和非极性键。
一、极性键极性键形成时,原子之间电子的共享不均匀,其中一个原子获得的电子更多,而另一个原子则获得的电子较少。
这种不均匀的电子分配导致原子之间形成带正电荷和带负电荷的极性两极子。
极性键的产生主要有两种情况:1.由于原子电负性不同,电子密度偏向电负性较高的原子,使得该原子成为部分负电荷的极性原子;2.原子中有孤电子对,这些电子对产生的电子云会使附近的化学键极化。
在极性键中,较电负的原子会具有部分负电荷,而较电正的原子会具有部分正电荷。
典型的极性键包括偏氢键、偏共价键和金属键。
1. 偏氢键偏氢键是指与氢原子结合的非金属原子对氢原子的电子云产生极化作用。
由于氢原子电负性较低,其电子密度较小,容易被较电负的原子吸引。
例如,氢氟化合物中的氢和氟之间的键就是偏氢键,氢原子带正电荷,氟原子带负电荷。
2. 偏共价键偏共价键是指在某些分子中,由于电负性差异造成原子成键时电子云分布不均匀。
如一氧化碳(CO)分子中,氧原子由于电负性高于碳原子,两者之间的共价键具有偏共价键特性。
氧原子带负电荷,碳原子带正电荷。
3. 金属键金属键是存在于金属中的一种特殊的电子构型。
金属元素的原子间电子云广泛共享,并形成电子海。
电子海中的自由电子可以在金属中自由流动,导致金属具有良好的导电性和热传导性。
二、非极性键非极性键形成时,原子之间电子的共享均匀,没有明显的电荷偏移。
非极性键通常出现在电负性相近的原子之间,如碳-碳键和氧氧键等。
在非极性键中,原子的电子密度基本相等,没有电荷分离的现象。
这使得非极性键的键能较小,相对较弱。
这也解释了为什么非极性分子间的力通常较弱。
总结:化学键的极性与非极性取决于原子之间电子的共享程度。
极性键由于电子云不均匀分布而形成带正电荷和带负电荷的极性两极子;非极性键由于电子云均匀分布,不存在电荷分离。
极性键在化合物分子中,不同种原子形成的共价键,由于两个原子吸引电子的能力不同,共用电子对必然偏向吸引电子能力较强的原子一方,因而吸引电子能力较弱的原子一方相对的显正电性。
这样的共价键叫做极性共价键,简称极性键。
举例:HCl分子中的H-Cl键属于极性键判别同种原子之间的是非极性键极性键存在于不同种元素间但是存在极性键的物质不一定是极性分子.区分极性分子和非极性分子的方法:非极性分子的判据:中心原子化合价法和受力分析法1、中心原子化合价法:组成为ABn型化合物,若中心原子A的化合价等于族的序数,则该化合物为非极性分子.如:CH4,CCl4,SO3,PCl52、受力分析法:若已知键角(或空间结构),可进行受力分析,合力为0者为非极性分子.如:CO2,C2H4,BF33、同种原子组成的双原子分子都是非极性分子。
不是非极性分子的就是极性分子了常见极性分子:HX,CO,NO,H2O,H2S,NO2,SO2,SCl2,NH3,H2O2,CH3Cl,CH2Cl2,CHCl3,CH3 CH2OH非极性键=由同种元素的原子间形成的共价键,叫做非极性键。
同种原子吸引共用电子对的能力相等,成键电子云对称地分布在两核之间,不偏向任何一个原子,成键的原子都不显电性。
非极性键可存在于单质分子中(如H2中H—H键、O2中O=O键、N2中N≡N键),也可以存在于化合物分子中(如C2H2中的C—C键)。
非极性键的键偶极矩为0。
以非极性键结合形成的分子都是非极性分子。
存在于非极性分子中的键并非都是非极性键,如果一个多原子分子在空间结构上的正电荷几何中心和负电荷几何中心重合,那么即使它由极性键组成,那么它也是非极性分子。
由非极性键结合形成的晶体可以是原子晶体,也可以是混合型晶体或分子晶体。
例如,碳单质有三类同素异形体:依靠C—C非极性键可以形成正四面体骨架型金刚石(原子晶体)、层型石墨(混合型晶体),也可以形成球型碳分子富勒烯C60(分子晶体)。
极性键非极性键
极性键
1、极性键是一种与极性物质反应而形成的特殊化学键,它可以使分子间的相互作用强度增加。
这种相互作用主要来自电子的相互作用,特别是氢原子的共用电子对的作用。
2、极性键构成了分子的结构,它们依靠极性物质之间的吸引和斥力,使对立的极性分子聚集在一起。
这是有机分子结构的基础,因此,能提供结构和功能信息的
原子受到了极性化学键的影响。
3、极性键中的一种最常见的是氢键。
其他一些典型的极性键包括电荷传递和氟键。
4、极性键可以使有机分子更加稳定,它们可以调节生物大分子,使分子保持位置,以增强作用而产生的生物体的相互作用。
非极性键
1、非极性键是由无机物和有机物共同组成的一种特殊的化学键,它们不能由电子的斥力或吸引而形成。
2、原子的非极性键主要是共价键,它们依靠原子的中子来稳定物质,允许非极性分子聚集在一起而不受极性分子的影响。
3、典型的非极性键包括共电 [离子键(双重结合)和金属键(金属离子凝聚)。
4、非极性结合是有机分子构成的结构的基础,它们构成有机大分子的侧链,从而使复杂的大分子获得功能和稳定性。
极性键和非极性键的区别方法极性键和非极性键是指在化学中,氢原子与一个由碳原子构成的有机分子结合所形成的键。
这种键可以分为极性键和非极性键。
极性键是由电荷不均匀分布的分子所形成的,而非极性键是由电荷均匀分布的分子所形成的。
极性键和非极性键之间有很多不同,本文将介绍极性键和非极性键的区别方法。
一、极性键与非极性键的电性差异首先,极性键与非极性键在电性上的差异是最大的。
极性键是由电荷分布不均匀的分子所形成的,这个电荷分布不均匀导致这种键具有很强的电性。
因此,极性键具有较强的吸引力,这使得极性键能够更好地结合在一起,从而产生强有力的结合。
而非极性键则是由电荷均匀分布的分子所形成的,电荷的均匀分布使得这种键具有较弱的电性,因此它们的吸引力要比极性键弱。
因此,非极性键只会形成弱的结合,但是它们的结合仍然非常有用。
二、极性键与非极性键的可调性差异此外,极性键与非极性键在可调性上也存在差异。
极性键具有较强的电性,由于它们的结合是十分牢固的,因此极性键的可调性较弱。
而非极性键具有较弱的电性,这使它们的结合要比极性键的结合来得更加松散,因此非极性键的可调性较强。
三、极性键与非极性键的持久性差异最后,极性键与非极性键在持久性上也存在着明显的差异。
极性键具有较强的结合力,因此它们在热量和其他因素的作用下仍然能够保持处于稳定状态,因此极性键的持久性较强。
而非极性键具有较弱的结合力,因此它们在热量和其他因素的作用下容易分裂,因此非极性键的持久性较弱。
综上所述,极性键和非极性键之间存在着明显的差异,此外,它们在电性、可调性和持久性上也存在着差异。
这些差异决定了极性键和非极性键在有机物中的不同应用。
因此,对极性键和非极性键的区分对理解它们的特性和功能具有重要的意义。
极性键与非极性键极性键和非极性键是生物学中最重要的概念之一,它们在生物体内的作用是不可缺少的。
极性键和非极性键的概念可以追溯到20世纪50年代,当时科学家们发现,生物体中的蛋白质和核酸的结构是由极性键和非极性键组成的。
极性键是一种化学键,它由两个原子之间的共价键组成,共价键是一种由电子共享组成的键。
极性键的特点是,它们之间存在着电荷不对称性,其中一个原子的电荷比另一个原子的电荷要大。
极性键的形成是由于原子之间的电荷不对称性,这种不对称性使得极性键具有强大的结合力,能够将两个原子紧密地结合在一起。
非极性键是一种非共价键,它由两个原子之间的氢键组成。
氢键是一种由氢原子和另一种原子之间的共轭键组成的键。
非极性键的特点是,它们之间没有电荷不对称性,因此它们的结合力较弱。
非极性键的形成是由于原子之间的共轭键,这种共轭键使得两个原子之间形成一种紧密的结合,但是结合力较弱。
极性键和非极性键在生物体内都起着重要的作用。
极性键在生物体内的作用是将蛋白质和核酸结构紧密地结合在一起,从而使蛋白质和核酸能够正确地执行其功能。
非极性键在生物体内的作用是将脂质分子结合在一起,从而形成膜结构,从而使细胞能够正常地运作。
此外,极性键和非极性键还可以用于制备药物。
药物的制备过程中,极性键和非极性键可以用来将药物分子结合在一起,从而使药物分子能够更好地被人体吸收。
总之,极性键和非极性键是生物学中最重要的概念之一,它们在生物体内的作用是不可缺少的。
极性键和非极性键的形成是由于原子之间的电荷不对称性和共轭键,它们的结合力也不同,极性键的结合力更强,而非极性键的结合力较弱。
极性键和非极性键在生物体内的作用是将蛋白质和核酸结构紧密地结合在一起,将脂质分子结合在一起,以及将药物分子结合在一起,从而使药物能够更好地被人体吸收。
极性键
由于两个原子吸引电子的能力不同,共用电子对必然偏向吸引电子能力较强的原子一方,因而吸引电子能力较弱的原子一方相对的显正电性。
这样的共价键叫做极性共价键,简称极性键。
判别
同种原子之间的是非极性键
极性键存在于不同种元素间
但是存在极性键的物质不一定是极性分子.
区分极性分子和非极性分子的方法:
非极性分子的判据:中心原子化合价法和受力分析法
1、中心原子化合价法:
组成为ABn型化合物,若中心原子A的化合价等于族的序数,则该化合物为非极性分子.如:CH4,CCl4,SO3,PCl5
2、受力分析法:
若已知键角(或空间结构),可进行受力分析,合力为0者为非极性分子.
如:CO2,C2H4,BF3
3、同种原子组成的双原子分子都是非极性分子。
不是非极性分子的就是极性分子了
常见极性分子:
HX,CO,NO,H2O,H2S,NO2,SO2,SCl2,NH3,H2O2,CH3Cl,CH2Cl2,CHCl3,CH3 CH2OH
非极性键:由同种元素的原子间形成的共价键,叫做非极性键。
同种原子吸引共用电子对的能力相等,成键电子云对称地分布在两核之间,不偏向任何一个原子,成键的原子都不显电性。
非极性键可存在于单质分子中(如H2中H—H键、O2中O=O键、N2中N≡N键),也可以存在于化合物分子中(如C2H2中的C—C 键)。
非极性键的键偶极矩为0。
以非极性键结合形成的分子都是非极性分子。
存在于非极性分子中的键并非都是非极性键,如果一个多原子分子在空间结构上的正电荷几何中心和负电荷几何中心重合,那么即使它由极性键组成,那么它也是非极性分子。
由非极性键结合形成的晶体可以是原子晶体,也可以是混合型晶体或分子晶体。
例如,碳单质有三类同素异形体:依靠C—C非极性键可以形成正四面体骨架型金刚石(原子晶体)、层型石墨(混合型晶体),也可以形成球型碳分子富勒烯C60(分子晶体)。
同种原子之间的是非极性键
极性键存在于不同种元素间
但是存在极性键的物质不一定是极性分子.
区分极性分子和非极性分子的方法:
非极性分子的判据:中心原子化合价法和受力分析法
1、中心原子化合价法:
组成为ABn型化合物,若中心原子A的化合价等于族的序数,则该化合物为非极性分子.如:CH4,CCl4,SO3,PCl5
2、受力分析法:
若已知键角(或空间结构),可进行受力分析,合力为0者为非极性分子.
如:CO2,C2H4,BF3
3、同种原子组成的双原子分子都是非极性分子。
不是非极性分子的就是极性分子了!
极性分子
HX,CO,NO,H2O,H2S,NO2,SO2,SCl2,NH3,H2O2,CH3Cl,CH2Cl2,CHCl3,CH3CH2O H
非极性分子
Cl2,H2,O2,N2,CO2,CS2,BF3,P4,C2H2,SO3,CH4,CCl4,SiF4,C2H4,C6H6,PCl5,汽油
共价键是化学键中重要的一类,包括:极性键、非极性键、配位键、单键、双键、叁键、σ键、π键等类别。
(1)非极性共价键形成共价键的电子云正好位于键合的两个原子正中间,如金刚石的C—C键。
(2)极性共价键形成共价键的电子云偏于对电子引力较大的一个原子,如Pb—S 键,电子云偏于S一侧,可表示为Pb→S。
(3)配价键共享的电子对只有一个原子单独提供。
如Zn—S键,共享的电子对由锌提供,Z:+ ¨..S:=Z n→S
既有离子键又有非极性键的物质是什么?
过氧化钠、过氧化钙、Br2等,只要在离子化合物中找具有相同的元素及原子个数相同的物质即可,离子化合物有:强碱、大多数盐及活泼金属化合物(氯化铝除外)及铵盐等
有强极性键构成但又不是强电解质的物质
HF 强极性键只受原子的影响,而强电解质还会受溶剂的影响。
如HF在水中受氢键的影响,使电离能力大为降低。
极性键和电解质是的关系
非极性键原子间通过共用电子对而形成的化学键
共用电子对不发生偏移
相同非金属元素原子的电子配对成键
极性键共用电子对偏向一方原子
不同非金属元素原子的电子对配对成键
以极性键结合成的多原子分子可能是极性分子,也可能是非极性分子,这取决于分子中各键的空间排列。
如果分子能造成键的极性互相抵消的就生成非极性分子,如:CO2,如果整个分子的结构不能造成键的极性互相抵消,生成极性分子
1、以非极性键结合的双原子分子必为非极性分子,如Cl
2、H2等;
2、以极性键结合的双原子分子一定是极性分子,如HCl、NO等;
3、以极性键结合的多原子分子,是否是极性分子,由该分子的分子空间结构决定,如H2O为极性分子,如CO2为非极性分子
【同种原子之间的是非极性键
极性键存在于不同种元素间
但是存在极性键的物质不一定是极性分子】
既有极性健又有非极性键的物质是
H2O2。