恩度(重组人血管内皮抑制素注射液)
- 格式:doc
- 大小:17.53 KB
- 文档页数:3

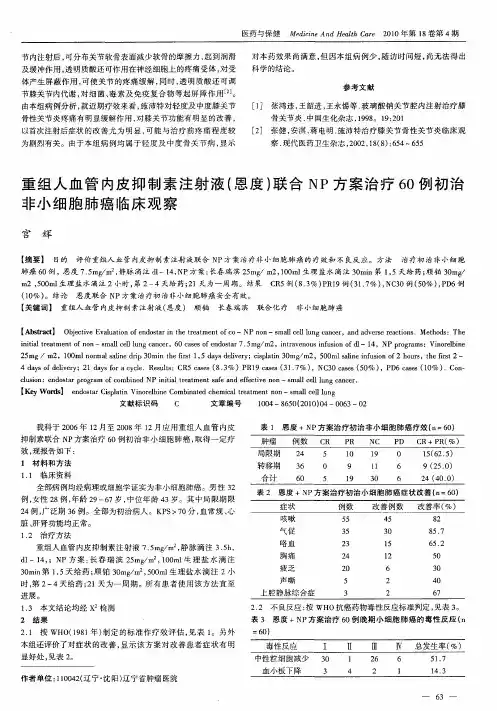
重组人血管内皮抑制素注射液对老年转移性乳腺癌患者疗效及对血清血管内皮细胞生长因子和基质金属蛋白酶-9的影响沈国满(青海大学附属医院药剂科,青海西宁810000)〔关键词〕转移性乳腺癌;重组人血管内皮抑制素注射液(恩度);血管内皮生长因子;基质金属蛋白酶-9〔中图分类号〕R737.9〔文献标识码〕A〔文章编号〕1005-9202(2012)19-4274-02;doi :10.3969/j.issn.1005-9202.2012.19.082第一作者:沈国满(1972-),男,主管药师,主要从事药学管理研究。
转移性乳腺癌患者预后差,病变发展过程中,癌组织和血清中血管内皮生长因子(VEGF )和基质金属蛋白酶(MMP )-9表达明显增加,对病变进展有促进作用。
重组人血管内皮抑制素注射液(恩度)是新型重组人血管内皮抑素,具有多靶点发挥抗肿瘤血管生成作用〔1,2〕。
本实验在常规化疗基础上加用恩度对转移性乳腺癌老年患者进行治疗,关注疗效及对血清VEGF和MMP-9影响。
1资料与方法1.1临床资料我院2007年5月至2009年5月确诊的转移性乳腺癌老年患者58例,均女性,年龄60 79(平均68.4)岁。
转移1个部位38例,一个以上部位20例,其中肝转移21例,肺转移20例,骨转移18例,淋巴结转移20例,其他部位转移9例。
均符合WHO 关于转移性乳腺癌诊断标准。
排除标准:①合并其他恶性肿瘤;②患者及家属不配合。
依入院顺序和随机原则分为观察组39例,年龄60 78(平均68.2)岁,对照组39例,年龄60 79(平均68.6)岁。
两组一般临床资料无明显差别,具有可比性。
1.2治疗方法对照组应用多西他赛联合卡培他滨(多西他赛75mg /m 2静脉滴注,第1天;卡培他滨950mg /m 2,口服,每日2次,第1 14天)。
化疗中预防性应用5-羟色胺受体阻滞剂止吐,同时应用维生素B6100mg 口服,每日3次,对症治疗手足综合征。







【药品名称】产品名:重组人血管内皮抑制素注射液商品名:恩度【适应症】恩度用于治疗初治或复治的Ⅲ/Ⅳ期非小细胞肺癌患者。
通常被联合长春瑞滨和顺铂化疗方案(NP方案)使用。
【性状】恩度为无色澄明液体。
【规格】15mg/3ml/支(2.4×105 U/支)【用法用量】恩度的给药方式为静脉给药,使用前将恩度加入250~500 ml生理盐水中,匀速静脉滴注时间3~4小时。
恩度在与NP化疗方案联合给药时,通常在治疗周期的第1~14日,连续给药14天,每天给药一次,每次7.5 mg/m2(1.2×105 U/m2)。
停药一周后再继续下一周期治疗。
一般治疗期可进行2~4个周期。
如若患者能够耐受的情况下,临床推荐医师可考虑适当延长使用恩度的用药时间。
【不良反应】恩度的副作用发生几率比较低(1%发生率<10%),心脏不良反应是最常见不良反应。
恩度主要症状有窦性心动过速、轻度ST2T改变、房室传导阻滞、房性早搏、偶发室性早搏等。
这类不良反应多发于冠心病、高血压病史患者。
建议使用恩度的患者在临床应用过程中要定期检测心电图,如果患者有心脏不良反应,需用心电监护。
有严重心脏病史,并且病情未得到控制的患者,应在医嘱指导下使用恩度。
消化系统反应如偶见的恶心、呕吐、腹泻、肝功能异常,主要包括无症状性转氨酶升高,黄疸主要为轻2中度,罕见重度;皮肤过敏反应,如表现为全身斑丘疹、伴瘙痒等不良症状均为发生率在0.11%<发生率<1%的少见不良反应。
发热、乏力多为轻中度[3]。
在用恩度初期少数患者可能会出现轻度疲乏、胸闷、心慌等症状,经对症处理后以上绝大多数不良反应可好转,不影响继续用恩度。
因上述症状持续存在而停止用药的患者是极个别的病例。
【注意事项】有严重心脏病或病史者,其中包括临床明确诊断心瓣膜疾病、需药物治疗的心绞痛、有记录的充血性心力衰竭病史、高危性不能控制的心律失常、严重心肌梗死病史以及顽固性高血压患者,在使用恩度时要慎重。


产品名称: 恩度(针剂)基本情况: 通用名:重组人血管内皮抑制素注射液商品名:恩度ENDOSTAR英文名:Recombinant Human Endostatin Injection作用机理: 重组人血管内皮抑制素为血管生成抑制类新生物制品,其作用机理是通过抑制形成血管的内皮细胞迁移来达到抑制肿瘤新生血管的生成,阻断了肿瘤细胞的营养供给,从而达到抑制肿瘤增殖或转移目的。
药动学: 健康志愿者单次30 min内静脉滴注本品30 mg(4.8×105 U)和60 mg(9.6×105 U)/m2,及120 min内静脉滴注120 mg(19.2×105 U)和210 mg(33.6×105 U)/m2(滴注速率分别为1、2及1和1.75 mg/m2/min),其末端消除半衰期(t1/2)为10小时左右,全身清除率(CLs)为2.8 L/h/m2左右。
本品在30~120 mg/m2(4.8×105 ~19.2×105 U/m2)剂量范围于正常人体内呈近似线性药代动力学,可以用线性模型预测不同剂量、滴注速率和时间的血药浓度。
滴注速率、时间和总剂量均可影响AUC 和峰浓度水平。
肿瘤患者每日2小时内静脉滴注本品,连续28天,个体间药时曲线差异性很大。
谷浓度随给药次数增加有持续增高的趋势,总剂量和滴注次数可影响峰浓度和谷浓度水平。
正常小鼠静脉给药后泌尿排泄系统的浓度最高,肾、尿、肺和肝高于血浆,其它组织均低于血浆,肌肉、脂肪、和脑浓度最低。
荷瘤小鼠静脉注射本品后全身分布与正常小鼠相近,肿瘤组织中分布不高,与肌肉和脂肪组织浓度相近。
临床应用: 多中心临床研究由中国医学科学院肿瘤医院、国家新药(抗肿瘤)临床研究中心以孙燕教授为主要研究者的研究小组共同完成。
适应症: 本品联合NP化疗方案用于治疗初治或复治的Ⅲ/Ⅳ期非小细胞肺癌患者。
不良反应: 在Ⅰ~Ⅲ期临床研究中,共有470例晚期非小细胞肺癌(NSCLC)患者使用了本品,常见的药物不良反应(>1/100,<1/10)主要有心脏不良反应,少见的药物不良反应(>1/1000,<1/100)主要有消化系统反应、皮肤及附件的过敏反应。
恩度治疗非小细胞肺癌患者的心脏毒性研究进展曹芳;崔洁【摘要】重组人血管内皮抑素-恩度(Rh-endostatin,Endostar)是世界上首例血管内皮抑制素抗癌药物,国内外的I~Ⅲ期临床试验证实对于中晚期非小细胞肺癌(NSCLC)患者,恩度联合化疗可以改善其近期疗效、生活质量、总生存率以及中位肿瘤进展时间,在2006年的中国版《非小细胞肺癌临床实践指南》中恩度首次被推荐用于中晚期NSCLC患者的联合化疗。
但作为其主要不良反应的心脏毒性已成为临床中限制其运用的重要因素。
因此,有必要对恩度的心脏毒性进行进探讨和评价。
本文就恩度在NSCLC患者联合化疗中的心脏毒性研究近况做一综述。
%Recombinant human endostatin (Endostar) is the world's first endostatin-based anticancer drugs in the world. PhaseⅠtoⅢclinical trials at home and abroad have confirmed that Endostar can improve the short-term efficacy, quality of life, overall survival and median tumor progression time of non-small cell lung cancer (NSCLC) patients. In 2006, Endostar was first recommended in the combined chemotherapy for NSCLC patients by Non-Small Cell Lung Cancer Clinical Practice Guidelines (Chinese Version). But the cardiac toxicity, as one of the main adverse reactions of Endostar, has become an important limitation in clinical use. Therefore, it is necessary to evaluate the car-dio toxicity of Endosta. In order to prevent the cardio toxicity in clinical use of Endostar, the article presents a review on the research progress of Endostar's cardio toxicity in the chemotherapy of NSCLC.【期刊名称】《海南医学》【年(卷),期】2015(000)007【总页数】4页(P1016-1018,1019)【关键词】非小细胞肺癌;恩度;心脏毒性;综述【作者】曹芳;崔洁【作者单位】新疆医科大学第三附属医院体检科,新疆乌鲁木齐 830000;新疆医科大学第三附属医院体检科,新疆乌鲁木齐 830000【正文语种】中文【中图分类】R734.2重组人血管内皮抑素-恩度(Rh-endostatin,Endostar)于1999年问世,是我国自主研发的,使用基因工程的方法通过大肠杆菌表达系统优化生产出的一种经过人工修饰血管内皮抑制剂,较普通内源性血管内皮抑制素稳定性和生物活性更高、半衰期更长[1]。
恩度来源:百济药房药讯作者:百济动态浏览:2105 发布时间:2007-12-23 11:27:00【药品名称】通用名:重组人血管内皮抑制素注射液商品名:恩度 ENDOSTAR英文名:Recombinant Human Endostatin Injection【性状】本品为无色澄明液体,pH 5.5±0.5【作用机理】重组人血管内皮抑制素为血管生成抑制类新生物制品,其作用机理是通过抑制形成血管的内皮细胞迁移来达到抑制肿瘤新生血管的生成,阻断了肿瘤细胞的营养供给,从而达到抑制肿瘤增殖或转移目的。
药动学: 健康志愿者单次30 min内静脉滴注本品30 mg(4.8×105 U)和60 mg(9.6×1 05 U)/m2,及120 min内静脉滴注120 mg(19.2×105 U)和210 mg(33.6×105 U)/m2(滴注速率分别为1、2及1和1.75 mg/m2/min),其末端消除半衰期(t1/2)为10小时左右,全身清除率(CLs)为2.8 L/h/m2左右。
本品在30~120 mg/m2(4.8×105 ~19.2×1 05 U/m2)剂量范围于正常人体内呈近似线性药代动力学,可以用线性模型预测不同剂量、滴注速率和时间的血药浓度。
滴注速率、时间和总剂量均可影响AUC和峰浓度水平。
肿瘤患者每日2小时内静脉滴注本品,连续28天,个体间药时曲线差异性很大。
谷浓度随给药次数增加有持续增高的趋势,总剂量和滴注次数可影响峰浓度和谷浓度水平。
正常小鼠静脉给药后泌尿排泄系统的浓度最高,肾、尿、肺和肝高于血浆,其它组织均低于血浆,肌肉、脂肪、和脑浓度最低。
荷瘤小鼠静脉注射本品后全身分布与正常小鼠相近,肿瘤组织中分布不高,与肌肉和脂肪组织浓度相近。
【临床应用】多中心临床研究由中国医学科学院肿瘤医院、国家新药(抗肿瘤)临床研究中心以孙燕教授为主要研究者的研究小组共同完成。
恩度來源:百济药房药讯作者:百济动态浏览:2105发布时间:2007-12-23 11:27:00【药品名称】通用名:重组人血管内皮抑制素注射液商品劣:恩度END0STAR英文剑:Recombinant Human Endostatin Injection【性状】本品为无色澄明液体,pH 5.5±0.5【作用机理】重组人血管内皮抑制素为血管生成抑制类新生物制品,苴作用机理是通过抑制形成血管的内皮细胞迁移来达到抑制肿瘤新生血管的生成,阻断了肿瘤细胞的营养供给,从而达到抑制肿瘤增殖或转移目的。
药动学:健康志愿者单次30 min内静脉滴注本品30 mg (4.8X105 U)和60 mg (9.6X1 05 U) /m2,及 120 min 内静脉滴注 120 mg (19.2X105 U)和 210 mg (33.6X105 U) /m2(滴注速率分别为1、2及1和1.75 m g/m2/min),其末端消除半衰期(tl/2)为10小时左右,全身淸除率((1^)为2.8 L/h/m2左右。
本品在30〜120 mg/m2 (4.8X105〜19.2X1 05 U/m2)剂量范用于正常人体内呈近似线性药代动力学,可以用线性模型预测不同剂量、滴注速率和时间的血药浓度。
滴注速率、时间和总剂量均可影响AUC和擁浓度水平。
肿瘤患者每日2小时内静脉滴注本品,连续28天,个体间药时曲线差异性很大。
谷浓度随给药次数增加有持续增髙的趋势,总剂量和滴注次数可影响峰浓度和谷浓度水平。
正常小鼠静脉给药后泌尿排泄系统的浓度最高,肾、尿、肺和肝髙于血浆,其它组织均低于血浆,肌肉、脂肪、和脑浓度最低。
荷瘤小鼠静脉注射本品后全身分布与正常小鼠相近,肿瘤组织中分布不髙,与肌肉和脂肪组织浓度相近。
【临床应用】多中心临床研究由中国医学科学院肿瘤医院、国家新药(抗肿瘤)临床研究中心以孙燕教授为主要研究者的研究小组共同完成。
【适应症】本品联合NP化疗方案用于治疗初治或复治的III/IV期非小细胞肺癌想者。
恩度的储运温度
恩度(Endostar),通用名为重组人血管内皮抑制素,是一种广谱抗癌药物。
恩度需要在 2-8°C 避光保存和运输。
需要注意的是,恩度的保存和运输条件非常严格,必须按照规定的温度范围进行保存和运输,以确保药物的质量和疗效。
在使用恩度之前,应该仔细阅读药品说明书,并按照医生的建议使用。
此外,恩度是一种处方药物,必须在医生的指导下使用。
在使用过程中,应该严格遵守医生的建议,按照规定的剂量和使用方法使用,以确保药物的安全和有效。
如果你有关于恩度的保存、运输或使用的其他问题,建议你咨询医生或药师的意见。
他们可以根据你的具体情况,提供更加专业和详细的建议。
恩度作用机理恩度,全称重组人血管内皮抑制素,是血管内皮生长因子(VEGF)的抑制剂。
它是一种有效的肿瘤血管生成抑制剂,可以阻断肿瘤血液供应,从而抑制肿瘤的生长和扩散。
本文将详细介绍恩度的作用机理,主要包括以下几个方面:1. 抑制肿瘤细胞增殖恩度可以抑制肿瘤细胞的增殖。
肿瘤细胞的增殖是肿瘤生长和扩散的基础。
恩度通过抑制血管内皮生长因子的活性,阻止肿瘤细胞与血管内皮细胞的相互作用,从而抑制肿瘤细胞的增殖。
这种抑制作用可以有效地控制肿瘤的生长和扩散。
2. 诱导肿瘤细胞凋亡恩度还可以诱导肿瘤细胞凋亡。
肿瘤细胞凋亡是一种程序性细胞死亡过程,可以通过控制基因的表达来实现。
恩度通过调节肿瘤细胞内的信号转导通路,诱导肿瘤细胞凋亡。
这种诱导作用可以加速肿瘤细胞的死亡,从而控制肿瘤的生长和扩散。
3. 抑制肿瘤血管生成恩度还可以抑制肿瘤血管生成。
肿瘤血管生成是肿瘤生长和扩散的关键过程。
恩度通过抑制血管内皮生长因子的活性,阻止肿瘤血管的生成,从而切断肿瘤的血液供应,使肿瘤无法继续生长和扩散。
这种抑制作用可以有效地控制肿瘤的生长和扩散。
4. 增强免疫系统功能恩度还可以增强免疫系统功能。
免疫系统是人体防御外来入侵者的系统,包括免疫细胞、免疫分子和免疫器官等。
恩度可以刺激免疫细胞的活化,促进免疫分子的分泌,增强免疫器官的功能,从而增强人体的免疫力。
这种增强作用可以帮助人体更好地抵抗肿瘤的生长和扩散。
总之,恩度的作用机理是多方面的,它可以通过抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡、抑制肿瘤血管生成和增强免疫系统功能等方式来控制肿瘤的生长和扩散。
这些作用机理的发挥需要进一步研究和探讨,以便更好地应用于临床治疗中。
恩度(重组人血管内皮抑制素注射液)
【药品名称】
商品名称:恩度
通用名称:重组人血管内皮抑制素注射液
英文名称:Recombinant Human Endostatin Injection
【成份】
主要成分:重组人血管内皮抑制素,来源:大肠杆菌工程菌发酵产品,辅料:醋酸钠,冰醋酸,甘露醇。
【适应症】
本品联合NP化疗方案用于治疗初治或复治的Ⅲ/Ⅳ期非小细胞肺癌患者。
【用法用量】
本品为静脉给药,临用时将本品加入250~500 毫升生理盐水中,匀速静脉点滴,滴注时间3~4小时。
与NP化疗方案联合给药时,本品在治疗周期的第1~14日,每天给药一次,每次7.5 毫克/m2(1.2x105U/m2),连续给药14天,休息一周,再继续下一周期治疗。
通常可进行2~4个周期的治疗。
临床推荐医师在患者能耐受的情况下可适当延长本品的使用时间。
【不良反应】
在Ⅰ~Ⅲ期临床研究中,共有470例晚期非小细胞肺癌(NSCLC)患者使用了本品,常见的药物不良反应(>1/100,<1/10)主要有心脏不良反应,少见的药物不良反应(>1/1000,<1/100)主要有消化系统反应、皮肤及附件的过敏反应。
1.心脏反应:用药初期少数患者可出现轻度疲乏、胸闷、心慌,绝大多数不良反应经对症处理后可以好转,不影响继续用药,极个别病例因上述症状持续存在而停止用药。
发生心脏不良反应的患者共有30例(6.38%),
主要表现为用药后第2~7天内发生心肌缺血,心脏不良反应均为Ⅰ、Ⅱ度或轻
【禁忌】
心、肾功能不全者慎用。
【注意事项】
1.过敏体质或对蛋白类生物制品有过敏史者慎用;
2.有严重心脏病或病史者,包括:有记录的充血性心力衰竭病史、高危性不能控制的心率失常、需药物治疗的心绞痛、临床明确诊断心瓣膜疾病、心电图严重心肌梗塞病史以及顽固性高血压者慎用。
本品临床使用过程中应定期进行心电检测,出现心脏不良反应者应进行心电监护;
3.本品为无色澄明液体,如遇有浑浊、沉淀等异常现象,则不得使用。
包装瓶有损坏、过期失效不能使用。
【孕妇及哺乳期妇女用药】本品尚未在孕妇及哺乳期妇女中使用,也未进行动物生殖毒性研究,需要时应在医师严密观察下使用。
【儿童用药】本品尚无儿童患者用药研究资料,确实需要用药时,应在医生指导下使用。
【老年用药】对有严重心脏病史的老年肿瘤患者,应在医师严密观察下应用。
【特殊人群用药】
儿童注意事项:
本品尚无儿童患者用药研究资料,确实需要用药时,应在医生指导下使用。
妊娠与哺乳期注意事项:
本品尚未在孕妇及哺乳期妇女中使用,也未进行动物生殖毒性研究,需要时应在医师严密观察下应用。
老人注意事项:
对有严重心脏病史的老年肿瘤患者,应在医师严密观察下应用。
【药物相互作用】
未系统研究过本品与其它药物的相互作用。
在临床使用时,应注意勿与可能影响本品酸碱度的其它药物或溶液混合使用。
【药理作用】
重组人血管内皮抑制素为血管生成抑制类新生物制品,其作用机理是通过抑制形成血管的内皮细胞迁移来达到抑制肿瘤新生血管的生成,阻断了肿瘤细胞的营养供给,从而达到抑制肿瘤增殖或转移目的。
【贮藏】
2~8℃避光保存。
【有效期】
暂定18个月
【批准文号】
国药准字S2*******
【说明书修订日期】
核准日期:2006年08月18日修改日期:2011年3月4日
【生产企业】
企业名称:山东先声麦得津生物制药有限公司
生产地址:山东省烟台经济技术开发区黑龙江路1号。