2021年青年缺血性卒中的病因和发病机(全文)
- 格式:doc
- 大小:55.50 KB
- 文档页数:14


脑卒中的病理生理机制解析脑卒中(Cerebrovascular Accident,简称CVA)是指由于脑血管病变引起的脑功能障碍。
常见的脑卒中类型包括缺血性脑卒中(Ischemic Stroke)和出血性脑卒中(Hemorrhagic Stroke)。
脑卒中是一种严重的疾病,对患者的脑功能和生活质量造成了严重影响。
了解脑卒中的病理生理机制对于预防和治疗脑卒中具有重要意义。
一、缺血性脑卒中的病理生理机制缺血性脑卒中是由于脑血流供应不足导致脑部组织缺氧而引起的。
最常见的原因是脑动脉阻塞,主要包括动脉粥样硬化和栓子形成。
下面简要介绍缺血性脑卒中的主要病理生理机制:1. 动脉粥样硬化:动脉粥样硬化是导致脑卒中最常见的病因之一。
它是由于血管壁发生结构性变化,形成斑块(atheroma),导致血管狭窄和阻塞。
斑块中的胆固醇、钙质和纤维蛋白堆积会引起血管内皮损伤并激活凝血系统。
最终,血小板聚集和血栓形成引起血流堵塞,导致脑组织缺血。
2. 栓子形成:栓子是脑卒中的另一个常见病因。
栓子的形成通常是由于原发病灶(如心房颤动、动脉瘤、动脉炎等)中血栓的脱落或形成,从而堵塞脑部动脉供血。
栓塞是缺血性脑卒中的主要机制之一。
3. 脑缺氧和能量代谢紊乱:脑缺血会导致脑部组织缺氧,因为脑组织对氧气的需求量非常高。
缺氧会导致细胞内能量代谢紊乱,细胞无法正常进行氧化磷酸化反应从而产生ATP,这将导致ATP供应不足,影响细胞功能。
二、出血性脑卒中的病理生理机制出血性脑卒中是由于脑血管破裂造成的脑出血,是脑卒中的另一种常见类型。
出血性脑卒中可以分为蛛网膜下腔出血、脑实质内出血和脑室内出血。
下面介绍出血性脑卒中的主要病理生理机制:1. 高血压:高血压是出血性脑卒中最主要的危险因素之一。
长期高血压会导致脑部血管壁变薄和弹性降低,易于破裂。
此外,高血压还会增加血管通透性和破坏血液-脑屏障,从而促进出血的形成。
2. 血管畸形:血管畸形是出血性脑卒中的另一个重要原因。


青年卒中的病因和危险因素的研究进展曾昊;宋宏杰【摘要】近年来青年卒中发病率呈逐年升高趋势,可能与工作紧张、生活节奏加快、饮酒量大及摄入脂肪量增加等有关.相对于中老年卒中而言,其病因复杂,危险因素多,非动脉硬化所占比例大,部分临床表现与病变部位早期缺乏特征性改变,早期就诊少.虽然有些病因及危险因素是先天且不可预防和控制的,但多数危险因素,如高血压、糖尿病、吸烟、饮酒等是可干预的,甚至有些病因,如卵圆孔未闭、夹层动脉瘤等是可治疗的.因此,研究青年卒中的病因和危险因素对其早预防有重要意义.【期刊名称】《医学综述》【年(卷),期】2014(020)004【总页数】3页(P688-690)【关键词】青年卒中;病因;危险因素【作者】曾昊;宋宏杰【作者单位】北京丰台医院神经内科,北京,100070;北京丰台医院神经内科,北京,100070【正文语种】中文【中图分类】R743.3脑卒中是一种发病率、病死率、致残率都很高的疾病,严重威胁着人类的生命与健康。
越来越多的研究发现,脑卒中已逐步开始年轻化。
青年卒中目前还没有一个标准的定义,一般指脑卒中发病年龄≤45岁。
国内流行病学调查显示,我国因脑卒中住院的患者中,18~45岁青年卒中约占9.77%[1],略高于印度的5%[2]和中国台湾的6.8%[3]。
本文就青年卒中的病因及危险因素综述如下。
1 早发性动脉粥样硬化在青年卒中患者中,动脉粥样硬化仍是其主要原因,占15%~25%[4]。
Putaala 等[5]对1008例青年卒中的病因进行了分析,15~35岁青年人群的病因多为夹层动脉瘤、心源性栓塞、非动脉粥样硬化性血管病和高凝状态;但在35岁以上的成人,传统的动脉粥样硬化仍是其主要原因。
Lee等[3]也认为,早发性动脉粥样硬化是青年缺血性卒中的重要病因。
引起早发性动脉粥样硬化的常见危险因素包括高血压、高血脂、糖尿病、卒中家族史等,也可能与肥胖、吸烟、工作紧张,生活节奏加快,高热量饮食有关。

脑卒中的病理生理学
脑卒中是指大脑血管破裂或者阻塞导致的脑功能丧失的一种疾病。
它既能影响身体功能,也会影响到患者的社交和生活质量。
具体病理生理学机制如下:
1. 缺血性卒中
缺血性卒中通常是由于血流量减少或者血流中断导致的。
主要原因是脑血管因动脉粥样硬化引起血管狭窄或血栓形成,或者是因为严重的动脉痉挛直接引起脑动脉血栓形成。
缺血性卒中的最常见类型是大脑半球。
严重的中枢神经功能受损是由于缺血引起了氧气供应不足。
2. 出血性卒中
出血性卒中指血管破裂导致脑出血。
这种类型的卒中发生率比缺血性卒中要低,但是死亡率较高。
出血性卒中的机制比较复杂,但是主要由于血管破裂导致脑外伤、动脉瘤破裂或者高血压等因素导致。
尽管出血性卒中的发生率较缺血性卒中要低,但是患者复苏的时间会更长,治疗的难度也会更大。
3. 继发性卒中
继发性卒中是由于基础疾病所引起的脑功能损伤,这些基础疾病包括心脏病、糖尿病、甲状腺疾病和高血压等。
无论是缺血性卒中还是出血性卒中,都会直接或间接导致神经损伤和炎症。
脑卒中损伤的主要机制是神经元和神经胶质细胞的死亡,神经胶质细胞的变性、出血和水肿。
脑卒中的机制涉及血管、血栓、炎症和神经元死亡等多个方面。
因此,有相当的治疗方法可以减轻症状并帮助患者恢复。
早期治疗包括通过药物治疗、物理治疗、心理治疗等措施来缓解症状。
在未来,科学家们可以通过更好的认识脑卒中病理生理学机制,我们可以开发出更有效的治疗方案和更有针对性的药物。

《中国脑卒中护理专业指南(2021年版)》中国脑卒中护理专业指南(2021年版)前言脑卒中,又称中风,是我国乃至全球范围内严重的公共卫生问题之一。
作为一种具有高发病率、高致残率、高死亡率和高复发率的疾病,脑卒中对个体健康和社会医疗资源造成了巨大的负担。
为了提高脑卒中护理质量,规范护理实践,降低致残率和死亡率,本指南应运而生。
本指南在总结我国多年来脑卒中护理实践经验的基础上,结合国际最新研究进展,为脑卒中护理人员提供了一套科学、规范、实用的护理指南。
指南概览适用对象- 脑卒中患者- 脑卒中潜在风险人群- 脑卒中护理人员- 医疗保健工作者主要内容- 脑卒中的定义、分类、病因及临床表现- 脑卒中的诊断与评估- 脑卒中急性期、恢复期和慢性期的护理- 脑卒中并发症的识别与处理- 脑卒中康复护理与心理护理- 脑卒中护理质量管理与持续改进指导原则- 循证护理:本指南以大量科学研究为依据,确保推荐措施的科学性和实用性。
- 个体化护理:根据患者的病情、需求和资源状况,为患者提供个性化的护理方案。
- 人本护理:关注患者生命尊严和心理健康,提高患者的生活质量。
脑卒中的定义、分类、病因及临床表现定义脑卒中是指由于脑部血液循环障碍导致的脑组织损伤。
分类1. 缺血性脑卒中:由于脑血管阻塞导致脑组织缺血缺氧。
2. 出血性脑卒中:由于脑血管破裂导致脑组织出血。
病因1. 动脉粥样硬化2. 高血压3. 糖尿病4. 心源性栓塞5. 血管畸形等临床表现1. 突发性头痛2. 恶心、呕吐3. 意识障碍4. 肢体瘫痪5. 言语障碍6. 视野缺损等脑卒中的诊断与评估诊断1. 病史询问:了解患者发病情况、既往病史、家族史等。
2. 体格检查:评估患者生命体征、神经系统体征等。
3. 辅助检查:CT、MRI、DSA等。
评估1. 神经功能缺损程度评估:使用NIHSS、mRS等量表。
2. 日常生活能力评估:使用Barthel指数等量表。
3. 并发症风险评估:评估患者是否存在出血、感染等风险。

2021缺血性卒中基层诊疗指南要点(全文)一、概述(一)定义与分类1. 定义:(1)脑血管病:是由各种脑血循环障碍病因引起的脑部疾病的总称。
(2)卒中:为脑血循环障碍病因导致的突发局限性或弥散性神经功能缺损的脑部疾病的总称,24h之后往往留有后遗症(包括症状、体征及新的脑梗死病灶),又称脑血管意外、中风。
根据病理分为缺血性卒中及出血性卒中,后者包括脑出血及蛛网膜下腔出血。
(3)缺血性卒中:指脑血循环障碍病因导致脑血管堵塞或严重狭窄,使脑血流灌注下降,进而缺血、缺氧导致脑血管供血区脑组织死亡。
(4)短暂性脑缺血发作(TIA)为脑血循环障碍病因导致的突发、短暂(数分钟至数十分钟多见)的脑、脊髓或视网膜神经功能缺损,影像学无新的局灶性脑梗死病灶。
2. 分类:结合临床实践的实用性,国内学者在TOAST及CISS病因分型的基础上进一步完善了缺血性卒中的新的分类,最后将缺血性卒中分为大动脉粥样硬化性脑梗死、脑栓塞、小动脉闭塞性脑梗死、脑分水岭梗死、出血性脑梗死、其他原因脑梗死、原因不明脑梗死。
(二)流行病学缺血性卒中具有高发病率、高患病率、高复发率、高致残率及高死亡率的特点,且近几年在我国有年轻化并愈演愈烈的趋势。
二、病因学分析(一)缺血性卒中的危险因素1. 不可干预的危险因素:年龄、性别、种族、遗传及低出生体重等。
具有这些不可干预的危险因素者更需要重视其他可干预危险因素的筛查与干预。
2. 可干预的危险因素:包括干预后可以明确获益的危险因素如高血压、心脏病、血脂异常、糖尿病、无症状颈动脉狭窄、超重与肥胖、缺乏身体活动、饮食和营养、吸烟、饮酒等,以及一些干预后可能潜在获益的危险因素如高同型半胱氨酸血症、代谢综合征、高凝状态、口服避孕药、偏头痛、炎症与感染、阻塞性睡眠呼吸暂停、绝经后激素治疗、药物滥用等。
(二)缺血性卒中的病因1. 大动脉粥样硬化:2. 心源性栓塞:3. 小血管闭塞:4. 其他可确定的病因:5. 病因不能确定:(三)缺血性卒中的发病机制1. 栓塞机制:(1)动脉源性栓子:(2)心源性栓子:(3)反常栓子:2. 血流动力学机制:3.其他发病机制:三、识别、诊断与转诊(一)缺血性卒中的识别1. 简易识别法:(1)BEFAST试验:(2)FAST试验(面-臂-语言试验):(3)“中风1-2-0”:2. 专科识别法:(1)神经功能缺损,包括:高级皮层功能受损,可出现昏迷、言语不流利和认知功能障碍(糊涂)等症状;运动功能受损,可出现视物成双、口角歪斜、饮水呛咳、肢体无力、行走不稳等症状;感觉功能受损,可出现视物模糊、面部和/或肢体麻木等症状。

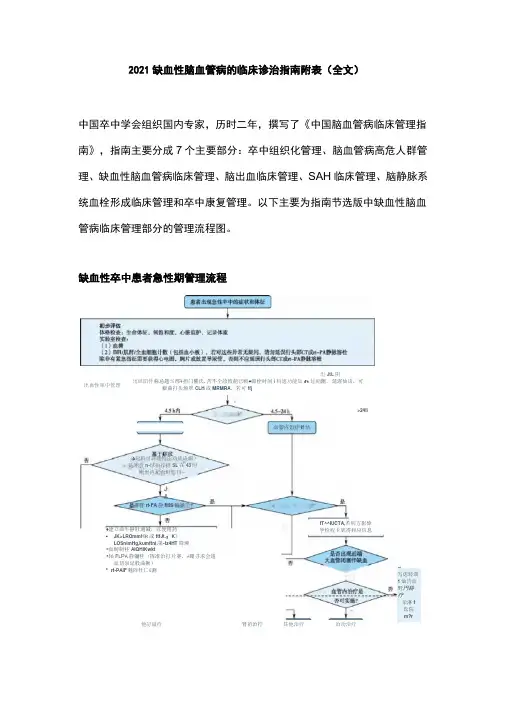
2021缺血性脑血管病的临床诊治指南附表(全文)中国卒中学会组织国内专家,历时二年,撰写了《中国脑血管病临床管理指南》,指南主要分成7个主要部分:卒中组织化管理、脑血管病高危人群管理、缺血性脑血管病临床管理、脑出血临床管理、SAH临床管理、脑静脉系统血栓形成临床管理和卒中康复管理。
以下主要为指南节选版中缺血性脑血管病临床管理部分的管理流程图。
缺血性卒中患者急性期管理流程 出JtL 阴性 出血性率中管理出皿阳件称忌題%邢¥担门權氏.苦不仝診致葩已斬#滞栓时间i 料通功能知ft 址餡刼、延渥仙话,可癖曲打头烦翠CLH 或MRMRA 、若可ffj(&起料可評理特缶劝能诀蝎) 是翎盘n-球抬拧捋SL 在43时剛世内圮否町暗刊—J &書打rt-FA 静flliS 瞬嶽>24li♦建立曲牛静肚通减,以便箱药 • JK>LROmm H R 或ftfJt.:K 》LOSnimHg,kumftni.第-tz4HT 降溯 *血畴制柱AIQHlKwkt•轴F L P A 静彌桂(挥准治打片赛,«硼寻求会逡血切泉延般曲揪) * rt-PAlF 魅阵牡匸£测血管内诒疗if 怙fT^^IUCTA,若钊方影偉学检程卡犹得和应信息写虑转湖1灿吿血野円耕疗亲淋f 氐院m?r他訂谥疔 肾苗治拧 其他治疗 冶功治疔规范内科治疗启动血管评价芨挤接血管内治疗完善溶栓前影像检查(推荐普通CT )溶栓前临床、化验及影像评估 符合溶栓标准it-PA 静脉溶栓怀疑急性大血管闭塞者溶栓标准不符合溶栓标准完善溶栓前抽血化验(若无特殊病史,仅有血糖为溶栓前必须获得结果)溶栓后24h,复査头颅影像,lil 调罄后续治疗方案确认初步诊断及发病时间(Vh,3^4.5h )可疑急性缺血性卒中患者并发症溶栓过程监测]图1缺血性卒中患者急性期管理流程缺血性卒中患者静脉溶栓部分管理流程图2发病4.5h 内缺血性卒中患者静脉溶栓部分管理流程急性缺血性卒中(AIS )血管内救治流程图3AIS 血管内治疗救治流程否是否是否是神甕觸味魏学檢査骨选呵创收止衆虑淫,也诩愼用抽啞取栓或超合球饗歸引护北中何导管黑装骨首冰T 揶劇血无创齡像檜査有无廩内大Mm.结合时间慚选择卷燦评佶方案是杏齢静關擀性忖间宙*是否TI 静脉帮栓怏忌J酬要点」并翌症处理AEh 内皿警内治疔标准: •卒中前mRSiiBbl 井•莎見由颈内动脱近罐大脑中动脉帕段闭塞引起*年齡歹1E 岁• MHSS 评分刮汾• ASPECTS 评分窘分•計冉廿始洽芬(股劭脉穿剧)>6-16h ;DAWN/DEFUSE 3标准 >16*24htDAWN 掠准推荐餅机精取栓治疗坡病24h 内符合指南标椎的急性前舖环尢(1曾闭罪性耶中机械取拎的麻醉方第我个怵化.尽就戦取栓延迟*术中柚据情况便用押救摘施.如球囊观宜禎曲解•根娜闪、病变、术中撫惟制订抗橙泊疗策略ff 养血甘内洽疗患者术后置干禅缠症监护病臥24h 内困台头朋CT 和訓库博像检査朮全面歸檢査大血管闭发匍h 内叫HS3评分A 呀壶发病点b 内WHSS 评分*4比丁分时”斷存在知1普闭隹:血管内泊疗后頃内出H 可参考AIS 瞄出血曲化赴顾则。

青年卒中的常见病因及危险因素青年卒中是指年龄在35岁以下的青年人发生的脑卒中。
国一项流行病学调查结果显示”1,青年卒中占全脑卒中的9.77%,以缺血性卒中为主,其中男性居多。
近来青年缺血性卒中的发病率有明显的上升趋势,尽早发现青年卒中的病因,对预防和治疗有非常重要的意义。
本文就青年卒中发生的常见病因及危险因素综述如下。
1 动脉粥样硬化多数学者认为 ],青年脑卒中的主要原因是动脉粥样硬化。
文献报道 ],青年卒中患者,如果临床上找不到明显病因,但脑动脉造影示动脉近端有不同类型和程度的斑块,可以认为是由动脉粥样硬化所致。
这与越来越多的青年人血脂代异常、高血压、糖尿病、肥胖、吸烟,从事紧的工作以及进食高热量饮食有关。
Kitter SJ等 1对428例首发青年卒中患者病因研究发现大动脉粥样硬化占3.8%,常为颈动脉或基底动脉狭窄,因而指出动脉粥样硬化是造成颅动脉狭窄的最主要原因。
2 非动脉硬化性血管病变2.1 夹层动脉瘤为头颈部血管血液穿透至血管膜下继发血肿并沿血管长轴在血管壁间纵向扩展一段距离而形成。
常伴有血管壁问纵向扩展一段距离而形成的,常伴有血管膜的撕裂。
文献报道,本病在35岁以下卒中患者中占26%,引起颈部血管夹层动脉瘤最常见的原因是外伤。
此外结缔组织疾病Elhers—danlons病Ⅳ型也易患夹层动脉瘤 1。
2.2 Moyamoya病又称烟雾病、脑底异常血管网症。
本病病因不清,先天性和获得性证据都有发现,本病多发于亚洲,以日本多见,常累及儿童,青壮年,以女性多见。
本病临床表现变异较大,20岁以下患者多为缺血表现,以发作性肢体无力或偏瘫症状多见,可左右交替,反复发作,也可由一侧发展为双侧瘫痪。
20 岁以上患者以蛛网膜下腔出血多见,这是因为血管闭塞后,近端压力增高,易使脆弱而壁薄的侧支循环血管网或穿通小血管破裂所致。
脑动脉造影是最可靠的诊断方法,MRI和MRA的联合应用可以更好地确定伴随的血管网以及深穿支供血围的小梗塞灶。

缺血性脑卒中的主要原因发表时间:2019-06-27T15:31:38.263Z 来源:《中国保健营养》2019年第2期作者:杨升[导读] 人的脑部是维系我们正常生活的首要保障因素,而缺血性脑卒中是较为普遍的脑部疾病,导致此类疾病的发生原因较为复杂,如粥动脉样硬化,即患者脑部血管组织硬化而导致脑动脉缺血。
(阆中市人民医院四川阆中 637400)【中图分类号】R473.26 【文献标识码】A 【文章编号】1004-7484(2019)02-0075-01人的脑部是维系我们正常生活的首要保障因素,而缺血性脑卒中是较为普遍的脑部疾病,导致此类疾病的发生原因较为复杂,如粥动脉样硬化,即患者脑部血管组织硬化而导致脑动脉缺血。
此类疾病对人体的危害性极大,据相关调查,由于缺血性脑卒中而致死的病患占据神经内科患者总例数的82%。
所以,我们务必充分认知缺血性脑卒的发生原因,结合此类疾病的临床症状,降低此类疾病对我们生活的影响。
1 什么是缺血性脑卒中?脑部疾病均会直接影响患者的正常生活,而缺血性脑卒中的发生原因主要是因为患者脑部供血不充分,进而导致患者颈、椎动脉组织发生闭塞情况,会直接引发患者颅内组织供血不充分的问题。
导致患者出现缺血性脑卒中的情况也较为复杂,且此类病症并不会直接导致其他脏器病变,但会仍会出现一定头晕、偏瘫现象;病情发作后,此类疾病会导致患者出现重度昏迷的症状,且不排除有直接致死现象。
同时,此类疾病会导致大脑血管、皮质发生癫痫,为患者正常生活带来了诸多不便。
总之,患有缺血性脑卒中的患者都会有不同程度的脑梗死情况,且脑梗死的严重程度也决定了此类疾病的严重度。
2 缺血性脑卒中的主要发生原因有哪些?缺血性脑卒中的主要发生原因是由于脑血栓或脑梗死更引发的脑部血管组织动脉硬化。
此类疾病多发于中老年人,主要是因为中老年人会患有不同程度的“三高”(血压、血脂、血糖偏高)的情况,且诸多患者血管还伴随一定血管狭窄或堵塞。
脑卒中的病因与发病机制研究脑卒中是指由于脑血管突发性破裂或者阻塞,导致大脑部分区域缺血缺氧而造成的功能障碍。
它是世界上造成残障和死亡的主要原因之一,严重影响患者和其家庭的生活质量。
脑卒中的病因及发病机制一直是医学界关注的焦点,并且对于预防和治疗脑卒中具有重要意义。
本文将探讨脑卒中的常见病因以及发病机制。
一、脑卒中的常见病因1.动脉粥样硬化动脉粥样硬化是最常见的引起脑卒中的病因之一。
该条件使得动脉内壁变得粘稠,斑块聚集并逐渐形成,最终导致血管堵塞。
这种情况称为动力闭塞性缺血性斑块。
当斑块崩溃时,血栓会堵塞动脉并引起急性缺血性卒中。
2.高血压高血压是另一个导致脑卒中的重要因素。
持续的高血压会损伤脑部小动脉,增加血管破裂和出血的风险。
此外,高血压还会引起动脉粥样硬化和心脏病,进一步增加了患者发生卒中的风险。
3.心脏病心脏病也是引起脑卒中的常见原因之一。
心房颤动是最常见的与卒中相关的心脏问题。
在心房颤动时,心房无法有效地收缩,从而导致血液淤积并形成血栓。
这些血栓可以随着血液流向大脑,并堵塞供氧的动脉。
4.糖尿病糖尿病患者发展为并发症导致大量有关微循环灾害、代谢紊乱及免役内皮细胞功能调节混乱等结构变化及功能异常等并发症。
而这些都是造成神经系统多种底物代谢或体质性功能障碍等,脑卒中是其中一种最重的病状。
5.吸烟和酗酒吸烟和酗酒是造成很多重大健康问题的主要原因。
它们不仅可以增加心脏疾病的风险,而且与脑卒中有密切关联。
吸烟会导致血管收缩、血栓形成以及动脉硬化。
酗酒则会引起高血压、心律失常等问题,并增加脑出血和梗塞发生的风险。
二、脑卒中发病机制1. 突发性缺血性卒中突发性缺血性卒中(即大多数情况下所说的“脑梗塞”)通常是由于一条关键动脉被闭塞,使得供应其特定区域的脑部反复出现缺血。
这可能是由于动脉粥样硬化斑块,或者由于由心房颤动而形成栓子等原因引起。
当这种情况发生时,脑细胞开始迅速死亡,导致神经功能障碍。
2. 蛛网膜下腔出血蛛网膜下腔出血是另一种常见的脑卒中类型。
2021年青年缺血性卒中的病因和发病机(全文)青年卒中的年龄尚无统一标准,目前比较公认的为18~50岁,但也有部分研究的年龄下限在15~18岁之间,上限在45~65岁之间[1]。
据统计,全世界每年有近200万青年人新发卒中事件,青年卒中的发病率上升显著,尤其是缺血性卒中,给家庭和社会造成巨大负担[1,2]。
相较于老年人群,青年缺血性卒中的病因更加复杂多样,诊断更为困难。
本文按照TOAST(Trial of Org 10172 in Acute Stroke Treatment)[3]病因学分型标准,对近年来青年缺血性卒中常见病因和发病机制的进展情况做一综述,以期为临床防治工作提供参考。
1 大动脉粥样硬化(large artery atherosclerosis, LAA)LAA是青年缺血性卒中的主要原因,近期中国一项15~49岁缺血性卒中人群的大样本研究显示LAA占总体缺血性卒中的43.7%[4]。
一项大型流行病学调查显示,传统LAA危险因素在年轻人中很普遍,在过去10年里,高血压(4%~11%)、高胆固醇血症(12%~21%)、糖尿病(4%~7%)、吸烟(5%~16%)和肥胖(4%~9%)的青年人群患病率明显增高,这也大大增高了LAA的早期发生率[1,5]。
此外,有关青年LAA 的新型危险因素也在不断被发现,为其发病机制研究及疾病防控提供了新方向。
例如,重度抑郁症和双相障碍容易导致青年人罹患动脉粥样硬化和早期心血管病[6];睡眠时间不足6 h与达到7~8 h相比,40~54岁人群的LAA形成风险增高27%[7]。
除相关危险因素外,早发性LAA也存在遗传特征。
30%~80%的家族性高胆固醇血症(familial hypercholesterolemia, FH)患者存在致病性基因突变,约20%的FH患者被认为存在多基因突变。
研究显示,单基因突变的FH会显著增高早发性小血管病风险,而多基因突变的FH则不然;而且,低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-C)多基因风险评分升高会进一步增高单基因突变FH患者的心血管病风险[8]。
因此,FH基因检测可提供独立于LDL-C 水平的重要预后信息。
纯合子型FH患者LAA发病年龄更早且预后极差,其LDL-C水平较正常人高6~8倍,他汀类药物疗效较差,一般只能依靠血液透析。
Yu等[9]的研究显示,抑制G蛋白偶联受体146(G protein-coupled receptor 146, GPR146)活性可降低LDL-C水平从而降低LAA风险,且对纯合子型FH患者有效,有望作为LAA的新型治疗靶点。
此外,前蛋白转化酶枯草溶菌素9(proprotein convertase subtilisin kexin type 9, PCSK9)抑制药可通过抑制PCSK9介导的LDL受体降解,大幅提高肝细胞对LDL-C颗粒的清除能力,显著降低LDL-C水平,从而达到抗LAA的目的[10]。
在已接受高强度他汀类药物治疗的LAA患者中,加入PCSK9抑制药能显著改善临床转归[11]。
遗传学及分子生物学的研究进展,不仅为早发性LAA的发病机制提供了更多设想,也提供了更多的治疗靶点。
传统影像学研究多关注病变血管的狭窄程度,对血管壁研究甚少。
近年来,血管壁磁共振成像(vessel wall magnetic resonance imaging, VW-MRI)被逐渐推广,让我们对LAA尤其是颅内LAA及其导致缺血性卒中的机制有了更深入的了解。
典型的LAA斑块在VW-MRI上表现为动脉管壁偏心性不均匀增厚,斑块呈T2高信号,增强后强化,而邻近组织常呈T2低信号,增强后无强化。
斑块强化与斑块内新生血管生成、炎症及内皮细胞通透性增加有关,斑块强化往往预示斑块不稳定以及卒中风险增高[12]。
VW-MRI可显示动脉管壁的重构类型以及LAA斑块的强化程度和分布,而且能清晰显示斑块内出血、薄纤维帽、大脂质核心、钙化等斑块易损性特征,有利于传统影像学检查无明显血管狭窄而又存在早发性LAA高危因素的青年缺血性卒中患者中筛查出高危LAA斑块[13]。
Schaafsma等[14]对205例缺血性卒中患者在VW-MRI检查前后分别使用改良TOAST方法进行病因学分型,发现有55%的患者在VW-MRI检查后改变了原来的分型,因为VW-MRI发现了隐匿的LAA病变,颅内LAA比例从原来的23%升至57%。
部分病变血管仅为轻度狭窄甚至无狭窄或为正性重构,但却仍有粥样硬化斑块甚至易损斑块而导致缺血性卒中,部分穿支动脉开口附近恰好有粥样硬化斑块直接堵塞穿支开口导致缺血性卒中。
这提示,对于青年缺血性卒中患者,其颅内动脉斑块往往处于进展阶段,斑块较小或表现为正性重构,血管狭窄往往不明显。
以CT血管造影/磁共振血管造影为代表的管腔成像方式可能会误导卒中病因筛查和TOAST分型,而VW-MRI恰恰可以弥补这一缺陷,为研究青年卒中的发病机制提供了新的影像学检查方法。
2 小血管闭塞(small vessel occlusion, SVO)SVO所致缺血性卒中约占青年缺血性卒中的39%[4]。
穿支动脉硬化性疾病及脑小血管病(cerebral small vessel disease, CSVD)都会导致SVO。
既往认为CSVD与高龄密切相关,但最近的研究显示,所有年龄段所有卒中亚型患者的腔隙和脑白质高信号负担都显著高于健康对照组,提示CSVD在青年缺血性卒中患者中也较为普遍[15]。
CSVD 病因不明,发病机制复杂,对青年卒中影响深远。
本文主要讨论几种与青年卒中密切相关的遗传型CSVD。
2.1 法布里病(Fabry disease, FD)FD的发病机制为X染色体长臂α-半乳糖苷酶A基因突变造成其代谢底物三己糖酰基鞘脂醇在体内广泛蓄积而导致多器官损害,其中枢神经系统损害表现为早发缺血性卒中或短暂性脑缺血发作(transient ischemic attack, TIA)[16]。
一项对721例年龄18~55岁的隐源性缺血性卒中患者进行的调查研究显示,分别有 4.9%(21/432)的男性和2.4%的女性(7/289)患者被诊断为FD,平均发病年龄分别为38.4岁和40.3岁,所致缺血性卒中多累及后循环,其中以椎基底动脉延长、扩张、迂曲等形态异常最为常见[16,17]。
酶替代疗法应用于临床已十余年,Migalastat作为治疗FD的首个口服药物于2018年在美国获得批准上市。
与酶替代疗法不同,它是α-半乳糖苷酶A的"分子伴侣",通过增加体内酶活性而发挥作用[18]。
2.2伴皮质下梗死和白质脑病的常染色体显性遗传脑动脉病(cerebral autosomal-dominant arteriopathy with subcortical infarcts and leukoencephalopathy, CADASIL)CADASIL与19号染色体上的Notch3基因突变有关,呈显性遗传,临床表现为TIA或卒中、偏头痛、认知损害等,基底膜嗜锇颗粒沉积是其造成缺血性脑损伤的潜在病理标志,MRI对其100%敏感[19]。
Puy等[20]对369例CADASIL患者进行的分析显示,其中227例既往有缺血性卒中或TIA病史,初次发病年龄为(46±9.7)岁;中位随访39个月显示,MRI显示存在脑微出血的患者发生缺血性卒中的风险显著高于无脑微出血者。
这提示,CADASIL患者多在中青年时期出现缺血性卒中或TIA,脑微出血是其发生缺血性卒中的独立危险因素。
2.3伴皮质下梗死和白质脑病的常染色体隐性遗传脑动脉病(cerebral autosomal recessive arteriopathy with subcortical infarcts and leukoencephalopathy, CARASIL)CARASIL与CADASIL类似,但其发病时间更早(20~30岁),除反复发生卒中外,还可出现脱发、腰痛、椎弓根病变等系统性疾病表现。
CARASIL与10号染色体HTRA1基因突变有关,呈隐性遗传,MRI上表现为基底节和丘脑白质高信号病灶和多发性腔隙性梗死。
与CADASIL不同,其基底膜无嗜锇颗粒沉积[19,21]。
2.4 伴卒中和白质脑病的组织蛋白酶A相关性动脉病(cathepsin A-related arteriopathy with strokes and leukoencephalopathy, CARASAL)2016年,来自荷兰的Bugiani等[22]在2个家系中总结了一类成年起病的新型显性遗传CSVD——CARASAL,并指出其与20号染色体CTSA基因突变有关,主要表现为顽固性高血压、卒中以及晚期认知功能减退,MRI表现为脑白质、基底节、丘脑以及脑干为主的弥漫性进行性白质脑病,在卒中发病前与临床严重程度不成比例。
近年来,越来越多有关CSVD的基因位点被发现,遗传因素在揭示缺血性卒中发病机制方面起着关键作用,基因筛查也为青年缺血性卒中的病因鉴别提供了更好的途径。
3 心源性栓塞(cardioembolism, CE)大样本研究显示,CE约占全部青年缺血性卒中的5.1%~18.2%,病因主要包括心律失常、心脏瓣膜病、心脏肿瘤、心肌病、感染性心内膜炎、心脏手术后、卵圆孔未闭(patent foramen ovale, PFO)/房间隔缺损等[4,23]。
虽然大部分CE具有起病突然、神经功能缺损严重、存在心脏基础病史等特点,但临床上往往仍难以迅速诊断,尤其对于"既往体健"的青年人群。
Zhou等[24]报道了一种利用CT灌注成像计算动脉内血栓延迟对比充盈(delayed-contrast filling sign, DCFS)长度来预测CE 的方法,DCFS定义为动脉高峰期后对比剂通过血栓扩散。
结果显示,CE组DCFS长度显著长于非CE组(2.3 mm对0.5 mm;P<0.001)。
DCFS长度预测CE的最佳截断值为1.5 mm,DCFS>1.5 mm预测CE的敏感性、特异性、阳性预测值和阴性预测值分别为83.2%、70.8%、75.5%和79.6%。
虽然这项研究仅纳入前循环缺血性卒中患者,存在一定的局限性,但提示通过计算DCFS长度能提供一种迅速鉴定CE的新方法。
3.1 PFOPFO可通过反常栓塞、PFO处原位血栓以及相关心律失常等机制引起卒中。
Huber等[25]对3 497例年龄18~55岁的TIA和缺血性卒中患者进行的分析显示,25%的患者存在PFO。