微粒的模型与符号
- 格式:docx
- 大小:39.33 KB
- 文档页数:1

第1节模型、符号的建立与作用A.模型1.模型:帮助人们认识和理解一些不能直接观察到的或复杂的事物。
一个模型可以是一幅图、一张表或计算机图像,也可以是一个复杂的对象或过程的示意2.模型方法:通过一定的科学方法,建立一个适当的模型来代替和反映客观对象,并通过研究这个模型来揭示客观对象的形态、特征和本质的方法3.作用:帮助人们认识和理解一些不能直接观察到的或复杂的事物4.水的状态模型:由右侧模型可直接地得出水在状态变化中,没有变成其他物质,构成水的水分子也没有变成其他分子。
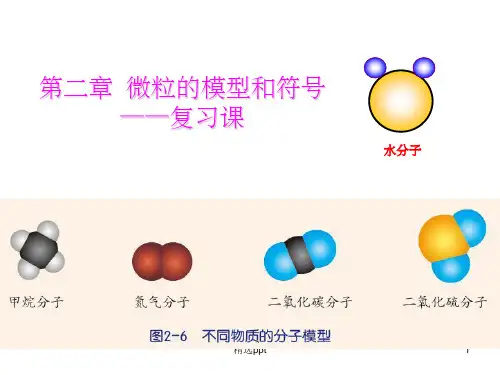
在液态水变成气态水的变化中,水分子之间的距离发生了变化B.符号1.定义:代表事物的标记2.意义:简单明了地表示事物,可避免由于事物外形不同和表达的文字语言不同而引起的混乱第2节物质的微观粒子模型A.构成物质的粒子模型1.分子的构成1)一般常用模型来表示分子由原子构成篮球表示氧原子,白球表示氢原子,黑球表示碳原子,棕球表示氮原子,黄球表示硫原子2)构成分子的原子可以是同种原子,也可以是不同种原子2.分子构成物质:在由分子构成的物质中,分子是保持物质化学性质的最小粒子。
例如:水的性质是由水分子保持的。
电解水时,水分子变成了氢分子和氧分子,它们不再保持水的化学性质3.有些物质是直接由原子构成的。
例如:金属铝由铝原子构成、铅笔芯内的石墨由碳原子构成等B.粒子的大小与质量1.分子和原子都有一定的质量和体积1)原子的体积很小,原子半径一般在10—10m数量级2)分子和原子的质量也非常小。
氢分子是最轻的分子,其分子质量的数量级是—27图示2.不同种类的分子和原子质量不同,体积也不同组成某个分子的原子,肯定比分子更小,如氢分子由2个氢原子构成,氢原子比氢分子小。
但并不能说原子一定比分子小,某些原子比某些分子大,如铁原子比氢分子大第3节原子结构的模型A.原子结构模型的建立2.原子的构成原子核(带正电荷)原子核外电子(带负电荷)1)原子呈电中性,原因是原子核与核外电子所带的电量——大小相等,电性相反2)原子核在原子中所占的体积极小,其半径大约是原子半径的十万分之一,但它几乎集中了原子全部的质量3)核外电子在核外空间做高速运动B.揭开原子核的秘密1.原子核的构成1)核电荷数:原子核所带的电荷数2)原子中:核电荷数= 质子数= 核外电子数2.夸克1)质子和中子都是由更微小的基本粒子——夸克构成的2)夸克还可以再分C.带电的原子——离子1.离子1)离子:带电的原子或原子团。





(完整版)浙江科学⼋年级下册第⼆章知识点第⼆章微粒的模型与符号⼀、模型、符号的建⽴与作⽤1、模型(1)定义:通过⼀定的科学⽅法,建⽴⼀个适当的模型来反映和代替客观对象,并通过研究这个模型来解释客观对象的形态、特征和本质,这就是模型⽅法。
(2)作⽤:可以帮助⼈们认识和理解⼀些不能直接观察到的或复杂的事物。
模型可以是⼀幅图、⼀张表或计算机图象,也可以是⼀个复杂的对象或过程的⽰意。
2、符号:(1)代表事物的标记(2)符号的作⽤:(1)简单明了地表⽰事物(2)可避免由于事物形态不同引起的混乱(3)可避免由于表达的⽂字语⾔不同引起的混乱注:模型与符号的区分:模型可以反映或代替客观对象;符号只能简单明了的表⽰事物。
⼆、物质与微观粒⼦模型1、分⼦与原⼦的区别和联系1、卢瑟福的α粒⼦轰击⾦箔实验:1、⼤多数α粒⼦穿透⾦箔,且不改变前进⽅向,说明原⼦核很⼩,原⼦中有很⼤的空间2、有⼀⼩部分α粒⼦改变了原来的运动路径,说明原⼦核带正电3、有极少数的α粒⼦好像碰到了坚硬不可穿透的质点⽽被弹了回来,说明原⼦的质量集中在原⼦核上2、第⼀个提出原⼦概念的⼈是道尔顿;第⼀个发现电⼦的⼈是汤姆⽣。
3、原⼦的结构核外电⼦:带负电荷原⼦质⼦:带正电荷原⼦核质⼦数+中⼦数=相对原⼦质量中⼦:不带电荷注:(1)核电荷数=质⼦数=核外电⼦数(2)根据核电荷数(即质⼦数)区分原⼦和元素;(3)在⼀个原⼦核中⼀定含有质⼦不⼀定含有中⼦(如氢元素)(4)同位素:原⼦中核内质⼦数相同,中⼦数不相等的同类原⼦的总称。
四、组成物质的元素1、元素:具有相同核电荷数(即质⼦数)的⼀类原⼦的总称。
注:元素和原⼦的区别2、元素的分类1、⾦属元素2、⾮⾦属元素(包括稀有元素)注:稀有元素:性质⾮常稳定,在通常情况下很难与其他元素或物质发⽣化学反应,在⾃然界的含量稀少的元素3、混合物、纯净物(单质、化合物)混合物:由两种或两种以上物质组成的物质。
(空⽓、海⽔、盐酸)物质单质:由⼀种元素组成的纯净物。


粒子的模型与符号模型(1)模型的概念:模型是依照实物的形状和结构按比例制成的物品,是用来显示复杂事物或过程的表现手段,如图画、图表、计算机图像等。
(2)模型的分类:物体的复制品、事物变化的过程、图片、数学公式、表达式或特定的词(3)模型的作用:建立模型能帮助人们理解他们无法直接观察到的事物,如科学家们经常用模型来代表非常庞大或极其微小的事物(太阳系中的行星、细胞的细微结构等)。
符号(1)符号的概念:符号是代表事物的标记。
(2)符号的作用:能简单明了地表示事物、可以避免由于事物外形不同而引起的混乱、可以避免由于表达事物的文字语言不同而引起的混乱。
化学模型的建立模型可以是实物的模型,也可以是事件的模型,模型能表达出研究对象的基本的特征。
(1)人们用水分子结构模型来了解水分子的构成:两个氢原子成104.5°角附在氧原子上。
(2)分子聚集成物质 分子的构成(1)分子是由原子构成的。
(2)分子构成的描述:以分子A m B n 为例,1个A m B n 分子由 个A 原子和 个B 原子构成。
如1个H 2分子由 构成;1个O 2分子由 构成; 1个H 2O 分子由 和 构成。
物质的构成⎪⎪⎪⎪⎩⎪⎪⎪⎪⎨⎧⎩⎨⎧⎩⎨⎧离子构成分子的粒子化学变化中的最小粒子原子粒子化学变化中可以再分的小粒子保持物质化学性质的最分子构成物质的粒子(1)分子是构成物质的一种基本粒子,有的物质是由 直接构成的,如金属、金刚石、石墨等。
由分子构成的 物质在发生物理变化时,物质的分子本身 ;由分子构成的物质在发生化学变化时,它的分子起了变化, 变成了 。
所以,分子是保持物质 的 粒子。
同种物质的分子, 性质相同;不同种物质 的分子, 性质不同,分子不能保持物质的 性质。
(2)同种原子构成的物质,由于 不同,可以构成不同的物质。
如金刚石、石墨是由碳原子构成的,足球烯 (C 60)是由C 60分子构成的。
粒子的大小与质量分子和原子都有一定的质量和体积。

2.1 模型、符号的建立与应用1.下列表达方式中属于符号的是()2.用分子观点解释“干冰升华”,下列说法错误的是()A. 分子不停地运动B. 分子间间隔变大C. 分子体积急剧增大D. 分子本身不发生变化3.如下图:(1)水在三态变化中,有没有变成其他物质?;构成水这种物质的水分子有没有变成其他的分子??故水的三态变化属于(物理或化学)变化。
(2)在液态水变成气态水的变化中,发生了改变。
2.2 物质的微观粒子模型1.小柯在学习物质构成时,对水的构成用下图表示,据图说明构成水的微观是()A.氧原子B.氢原子C.水分子D.氧原子和氢原子第3题图2.下列物质由原子直接构成的是( )A.氧气 B.金刚石 C.氯酸钾 D.碘3.读图可知,1个一氧化碳分子和1个二氧化碳分子含有相同的()A.氧原子个数B.碳原子个数C.原子总数D.以上都不对4.读图可知,水和过氧化氢不属于同一种物质是因为()A.水分子和过氧化氢分子中所含氧原子个数不同B.水分子和过氧化氢构成时原子种类不同C.水分子和过氧化氢分子所含氢原子个数不同D.以上都不对5.下图是电解水中水分子分解的过程示意图,你能从中得出什么样的规律或结论。
①__________________________;②_________________________;2.3 原子的结构模型(1)1.科学家提出了许多原子结构的模型,在20世纪上半叶,由卢瑟福提出的、最为大家接受的原子结构模型与下图最相似的是( )2.原子结构中,下列等式成立的是( )①中子数=质子数②核电荷数=电子数③质子数=电子数④核电荷数=中子数A.①②④ B.①③ C.②③ D.①②③3.2004年诺贝尔物理学奖颁给了美国三位科学家格罗斯、波利茨、威尔茨克,他们对有关原子核内夸克之间存在的强作用力的研究方面作出了重要的理论发现。
有关夸克的说法,不正确的是( )A.夸克是目前原子核中发现的最小粒子B.质子和中子都由夸克构成C.不是所有分子中都存在夸克粒子D.夸克研究是一个科学研究的热点4.在分子、原子、质子、中子、电子、原子核这些微粒中:(1) 能直接构成物质的微粒有; (2) 能保持物质化学性质的微粒有;(3) 显示电中性的微粒; (4) 带正电的微粒有;(5) 带负电的微粒有; (6) 质量最小的微粒有;(7) 参加化学反应时,一定发生变化的微粒有;(8) 在同一原子里数目相等的是。

八年级下第二章《微粒的模型与符号》知识点第1节模型、符号的建立与作用1、模型(1)常见的模型:实物模型(地球仪)图像模型(细胞结构图)数学模型(公式)黑箱模型(地球的结构)理想化模型(磁感线)(2)建立模型的意义:可以帮助人们认识和理解一些不能直接观察到的事物。
2、符号(1)常见的符号:科学量及单位符号(电流I,电流单位安培A)交通标志符号公共标志符号符号的作用: 用符号能简单明了地表示事物,可避免由于事物外形不同和表达地文字语言不同而引起地混乱。
3、水在三态变化中,分子没有发生变化;分子间的距离发生了变化。
第2节物质与微观粒子模型1、分子和原子的区别:在化学变化中,分子可分,原子不可再分。
(原子是化学反应中的最小微粒)2、化学变化的实质:分子分成原子,原子重新组合成新的分子。
3、化学变化和物理变化的本质区别:在变化中,物质的分子变成了其它物质的分子,就是化学变化。
在变化中,物质的分子还是原来的分子,只是分子间的距离发生了变化,就是物理变化。
4、分子是由原子构成的,不同种类和数目的原子能构成不同的分子。
一些气体、液体主要由分子构成由分子构成的物质,分子是保持物质化学性质的最小微粒5、由原子直接构成的物质:金属(铜、汞等)和固体非金属(碳、硅、磷、硫)及稀有气体(氦、氖、氩)6、金刚石和石墨物理性质不同是由于原子排列不同(同素异形体)。
7、粒子的大小与质量(1)分子和原子都有一定的质量和体积。
原子的体积很小,半径的数量级在10-10米。
原子的质量也非常小,数量级在10-26千克。
(2)不同质量的原子质量不同,体积也不同。
第3节原子结构的模型一、原子结构模型的建立与修正1、道尔顿--实心球原子结构--发现原子2、汤姆森--“面包模型”:原子是一个平均分布着正电荷的球体,带负电荷的电子嵌在中间。
--发现电子3、卢瑟福--“核式模型”:电子绕原子核运行(重点)4、波尔--“分层模型”:电子在固定的轨道上运动 5、“电子云模型质子(带正电) 夸克二、原子的结构:1、原子:原子核: (带正电) 中子(不带电) 夸克(不显电性)核外电子:(带负电)(1)原子中,原子序数=核电荷数=质子数=核外电子数。
第二章微粒的模型与符号知识点归纳第1节模型、符号的建立与作用1、符号: 用符号能简单明了地表示事物,可避免由于事物外形不同和表达地文字语言不同而引起地混乱;常见的符号有电路元件符号,交通符号,物理量符号,天气现象符号等2、水在三态变化中,分子没有发生变化;分子间的距离发生了变化;3、建立模型的意义:可以帮助人们认识和理解一些不能直接观察到的事物;模型可以是一幅图、一张表格、一个公式、一个复杂对象或过程的示意;第2节物质的微观粒子模型1、分子和原子的区别:在化学变化中,分子可分,原子不可再分;由分子构成的物质中,保持物质化学性质的最小微粒是分子,由原子构成的物质中,保持物质化学性质的最小微粒则是原子;原子是化学变化中最小微粒;2、化学变化的实质:化学变化中,分子分成原子,原子重新组合成新的分子;化学反应中,一定发生改变的是分子种类物质种类,一定不发生改变的是原子的种类和数目,可能发生改变的是分子的数目;3、化学变化和物理变化的本质区别:化学变化:物质的分子变成了其它物质的分子;物理变化:只改变分子间的距离发生了变化;4、分子是由原子构成的;一些气体、液体主要由分子构成;5、原子直接构成的物质:金属和固态非金属硫、碳、磷、硅及稀有气体6、金刚石和石墨物理性质不同是由于原子排列不同;7、粒子的大小与质量 1分子和原子都有一定的质量和体积;原子的体积很小,半径的数量级在10-10米;原子的质量也非常小,数量级在10-26千克;2不同质量的原子质量不同,体积也不同;第3节原子结构的模型一、原子结构模型的建立与修正1、道尔顿--实心球原子结构--发现原子2、汤姆森--“西瓜葡萄干面包模型”:原子是一个平均分布着正电荷的球体,带负电荷的电子嵌在中间;--发现电子3、卢瑟福--“核式行星绕太阳模型”:电子绕原子核运行——发现原子核4、波尔--“分层模型”:电子在固定的轨道上运动5、“电子云模型质子带正电夸克二、原子的结构:1、原子:原子核:带正电中子不带电夸克不显电性核外电子:带负电1原子中,核电荷数=质子数=核外电子数; 2中子数不一定等于质子数; 3原子内可以没有中子; 4质子不同,原子种类一定不同;5电子质量很小,在整个原子的质量中所占的比例极小,可忽略不计;原子的质量主要集中在原子核上; 6原子不显电性:原子核所带的正电荷总数=核外电子所带的负电荷总数;三、1、具有相同的核电荷数即质子数的同一类原子的总称为元素;2、原子中原子核内质子数相同、中子数不相同的同类原子统称为同位素原子;3、元素是同位素原子的总称,同位素原子是一种元素中的不同种原子;4、元素表示物质的宏观组成,只讲种类,不讲个数四、带电的原子或原子团--离子实验钠在氯气中燃烧的实验实验现象:剧烈燃烧,产生黄色火焰,生成大量白烟;钠原子失去电子--形成正电荷的钠离子阳离子;氯原子得到电子--形成负电荷的氯离子阴离子所以,离子就是带电的原子或原子团离子的组成元素不止一种;离子和分子、原子一样也是构成物质的基本粒子;第4节组成物质的元素2、由多种物质组成叫混合物;由一种物质组成叫纯净物;纯净物分为单质和化合物单质:由同种元素组成的纯净物;举例:氧气、金属铁等;化合物:由不同种元素组成的纯净物;举例:二氧化碳、水等;3、元素在地壳的分布是不均匀的,其中含量最高的是氧O,其次是硅Si,然后是铝Al;金属元素中含量最高的是铝Al,其次是铁Fe;4、①在人体中含量最高的是氧元素,其次是碳C、氢H;②海水中含量多到少:氧O、氢H、氯Cl、钠Na;③有机物葡萄糖、蛋白质、脂肪等主要由碳C、氢H、氧O组成第5节表示元素的符号1、元素符号的书写:①通常用该元素的拉丁文第一个字母的大写来表示②当两种元素的第一个字母相同时,写上该元素名称的第二个字母要用小写以示区别;2、元素符号一般表示:⑴一种元素⑵这种元素的1个原子3表物质由原子直接构成的3、元素符号周围数字的意义:①元素符号前面的数字:表示单独的微粒的个数②元素符号右下角的数字:表示每个分子原子团中某原子的个数③元素符号右上角的数字:表示离子所带的电荷数④元素符号上方的数字:表示元素的化合价;4、元素周期表:横称为周期原子序数也是质子数自左向右增加;纵换为族具有相似的化学性质5、1-18号元素:第6节表示物质的符号1、用元素符号来表示物质分子组成的式子称化学式2、化学式的确定依据:由实验测定组成,如水的电解实验测定水的组成;不能凭空想象,一种物质只有一种化学式;3、化学式的书写原则⑴单质化学式的写法:元素符号右下角加数字双原子分子、多原子分子;习惯上用元素符号表示:稀有气体氦气、氖气、氩气、固态非金属除碘外、金属⑵化合物化学式的写法:按一定顺序写出组成化合物的所有元素符号,然后在每种元素符号的右下角用数字写出化合物分子中该元素的原子个数;一定顺序:氧元素与另一种元素组成的化合物,一般要把氧元素符号写在左边;氢元素与另一元素组成的化合物,一般要把氢元素写在左边;金属元素、氢元素与非金属元素组成的化合物,一般要把非金属元素写在右边;4、化学式的读法:一般从右向左读做“某化某”;或者要指出一个分子里的个数;5、化学式的含义:1表示该种物质二氧化碳气体例:CO2表示这种物质的组成二氧化碳由碳元素和氧元素组成23表示该物质的一个分子一个二氧化碳分子分子由碳原子和氧原子构成4表示该物质的一个分子的构成CO25表示该物质的相对分子质量12×1+16×2=446、离子符号是在形成该离子的原子的元素符号右上角标出该离子所带的电荷数;海水中所含的部分离子:Cl-、Na+、Ca2+、Mg2+7、Cl-表示带1个单位负电荷的氯离子; Na+表示带1个单位正电荷的钠离子;Ca2+表示带2个单位正电荷的钙离子; 2Na+表示二个钠离子:8、常见的原子团9、原子之间相互化合的数目,用化合价来表示;化合价书写在元素符号的正上方,先写正负,再写数字;10、常见化合价:背诵钾钠银氢+1价,钙镁钡锌为+2价,氟氯溴碘负一价,通常氧是—2价,三铝四硅五价磷,一二铜二三铁,单质元素为零价;常见原子团根的化合价和原子团离子所带的电荷数相等;11、根据元素化合价写出化合物的化学式,原则:在化合物中所有元素化合价的代数和为零;化合物书写口诀:正前负后、上方标价、交叉填数、约简检验12、单质元素的化合价为零;第7节元素符号表示的量1、以C-12质量的1/12作为标准,其它原子的质量跟它相比所得的比值,叫做这种原子的相对原子质量; 相对原子质量=质子数+中子数如2311Na:钠原子有11个质子;相对原子质量为23;中子数为122、相对分子质量:一个分子中各原子的相对原子质量总和;3、根据化学式求相对分子质量:已知,H—1 O—16 S—32求:H2SO4硫酸分子的相对分子质量:1×2+32×1+16×4==984、根据化学式计算组成物质的各元素的质量比例:水的化学式为H2O,求水中氢元素和氧元素的质量比解:H∶O==1×2∶16×1==1∶85、根据化学式,计算物质中某一元素的质量分数;一个分子中某元素的原子个数×该元素的相对原子质量物质中某元素质量分数== ×100%相对分子质量。
第二章微粒的模型与符号一、模型、符号的建立与作用1、模型的作用:模型可以帮助人们认识和理解一些不能直接观察到的或复杂的事物。
模型可以是一幅图、一张表或计算机图象,也可以是一个复杂的对象或过程的示意。
2、符号的作用:(1)简单明了地表示事物;(2)可避免由于事物形态不同引起的混乱;(3)可避免由于表达的文字语言不同引起的混乱。
注:公式是模型,如:RUI;而单独的字母I 是符号。
各种标志是符号,如。
电路图是模型;而电路图中各种单一的电路元件是符号,如。
二、物质的微观粒子模型1、分子是由原子构成的。
不同种类和不同数量的原子就能构成各种不同的分子。
2、构成分子的原子可以是同种原子,也可以是不同种原子。
3、分子是保持物质化学性质的最小粒子,因此,化学性质不同是因为分子不同造成的。
4、有些物质直接由原子构成的,如:金属单质(如:铁Fe、钠Na)、稀有气体单质(:如氦气He、氖气Ne、氩气Ar 等),部分固态非金属单质(如:碳C、磷P、硫S、硅Si 等)5、分子和原子的体积都很小,不同种类的分子和原子质量也不同。
体积一般是10-10米数量级,质量是10-27千克的数量级。
三、原子结构的模型1、原子结构模型的建立:道尔顿(认为原子不可再分,实心球模型)——汤姆生(发现电子带负电,原子不带电,提出枣糕模型)——卢瑟福(α粒子轰击金属箔实验,提出核式结构模型)——波尔(改进原子核式模型,认为电子有稳定轨道)——现代电子云模型。
2、注:(1)核电荷数:原子核所带的电荷数(带正电),等于质子数。
(2)原子核和核外的电子所带的电荷总数相等,电性相反,整个原子不显电性。
(3)质子和中子又是由更小的微粒夸克构成。
(4)对于原子而言:核电荷数=质子数=核外电子数=原子序数(元素周期表中的第几号元素)相对原子质量≈质量数=质子数+中子数。
(5)原子的质量主要集中在原子核上。
(6)不是每个原子核中都有中子(如氕原子没有种子),质子和中子相近但不一定相等。
微粒的模型与符号教案第一章:引言教学目标:1. 让学生了解微粒模型与符号的概念及其重要性。
2. 培养学生对微粒模型与符号的学习兴趣。
教学内容:1. 介绍微粒模型与符号的定义。
2. 讲解微粒模型与符号在化学研究中的应用。
教学方法:1. 采用讲授法,讲解微粒模型与符号的定义及应用。
2. 利用图片、动画等多媒体资源,帮助学生形象地理解微粒模型与符号。
教学评估:1. 课堂问答,检查学生对微粒模型与符号的理解。
2. 布置课后作业,巩固学生对微粒模型与符号的掌握。
第二章:原子结构模型教学目标:1. 让学生了解原子结构模型的演变过程。
2. 使学生掌握常见原子的结构特点。
教学内容:1. 讲解原子结构模型的演变过程。
2. 介绍常见原子的结构特点。
教学方法:1. 采用讲授法,讲解原子结构模型的演变过程。
2. 利用模型、图片等直观教具,展示常见原子的结构特点。
教学评估:1. 课堂问答,检查学生对原子结构模型的理解。
2. 布置课后作业,巩固学生对常见原子结构特点的掌握。
第三章:离子模型教学目标:1. 让学生了解离子模型的概念及其形成原因。
2. 使学生掌握离子的表示方法。
教学内容:1. 讲解离子模型的概念及其形成原因。
2. 介绍离子的表示方法。
教学方法:1. 采用讲授法,讲解离子模型的概念及其形成原因。
2. 利用示例,讲解离子的表示方法。
教学评估:1. 课堂问答,检查学生对离子模型的理解。
2. 布置课后作业,巩固学生对离子表示方法的掌握。
第四章:分子模型教学目标:1. 让学生了解分子模型的概念及其表示方法。
2. 培养学生掌握分子间作用力及其类型。
教学内容:1. 讲解分子模型的概念及其表示方法。
2. 介绍分子间作用力及其类型。
教学方法:1. 采用讲授法,讲解分子模型的概念及其表示方法。
2. 利用示例,讲解分子间作用力及其类型。
教学评估:1. 课堂问答,检查学生对分子模型的理解。
2. 布置课后作业,巩固学生对分子间作用力的掌握。
微粒的模型与符号
1. 原子模型:原子是构成物质的基本单位,其模型通常包括一个带有放射性核和电子的球体。
原子的符号通常表示为 ans(希腊字母安斯),其中 a 表示原子核,n 表示电子层数,s 表示外层电子,p 表示内层电子。
2. 分子模型:分子是化合物的基本单元,其模型通常包括两个带有不同原子的球体。
分子的符号通常表示为 fa(希腊字母费),其中 f 表示分子中的原子,a 表示原子核,c 表示碳原子,h 表示氢原子。
3. 颗粒模型:颗粒是流体或固体物质在空间中的离散点,其模型通常包括一个带有不同数量的粒子的圆形或椭圆形。
颗粒的符号通常表示为 p(希腊字母普),其中 x 和 y 表示颗粒的坐标,r 表示颗粒的大小。
4. 细胞模型:细胞是生物体的基本单元,其模型通常包括一个圆形或椭圆形,其中包含不同数量的细胞器和分子。
细胞器的符号通常表示为 fa(希腊字母费),其中 f 表示细胞器,a 表示细胞膜,c 表示细胞质,h 表示细胞核。