胚胎及卵母细胞的冷冻保存技术
- 格式:ppt
- 大小:554.00 KB
- 文档页数:26

冷冻卵子技术戴致远12307130175简介冷冻卵子,又称雪藏卵子,即取母体健康时的卵子冷冻,阻止卵子随人体衰老,待想生育时取出冷冻的卵子使用即可。
冷冻卵子的技术本身并不成熟,即使可以冷冻、复苏、形成受精卵,胚胎。
主要方式保存卵子有两种方式。
慢速冷冻法,即把卵子储存在脱水的溶液中,然后用电脑系统让它慢慢冷冻起来,最后封存在超冷的液化氮中。
[3]另一种是玻璃化冷冻法,即把卵子放进高浓度渗透液中,然后立即储存到液氮中。
冷冻卵子保存后,待想生育时取出冷冻的卵子,解冻后即可进行体外受精最终获得胚胎。
流程(原理)01试管婴儿登记、体检:我们国家的生殖中心只允许为做试管婴儿的妇女冷冻卵子,如果有多余的卵子,且夫妻双方都同意,也可以进行捐赠。
冷冻卵子之前需要进行相关的身体检查。
02打排卵针、取卵:如果要想取卵,首先要在促性腺激素促卵发育后,给女性打促卵泡成熟的针。
大约36小时后,医生会在B超引导下,经过阴道穿到卵巢内,把卵泡的卵泡液吸出来。
通过B超可以看到,一团透明的像水晶球一样的物质就是卵泡,卵泡中孕育着成熟的卵子。
取卵手术通常不超过10分钟。
03卵泡液送至实验室:医生把卵泡液吸出来至试管中,迅速通过窗口传递到实验室中的显微镜下。
冻卵的过程全部在实验室里进行操作。
卵子很娇气,怕光、怕冷、怕热,所以整个取卵过程,必须在暗环境下迅速完成。
04提取出卵母细胞:卵子细胞悬浮在卵泡液中,实验室的技术人员首先会在显微镜下,把卵泡液中的卵子细胞分离出来。
05卵子脱水:实验室的工作人员把卵子放进高度浓缩的脱水冷冻保护溶液中进行脱水。
06迅速放入有液氮的专用容器中:脱水后的卵子立即投入液氮中,此种方式称之为玻璃化冷冻。
07转移:此时的液氮容器无法永久保存,还需转移至液氮罐中。
08放入液氮罐中:卵子被转移至零下198℃的液氮罐中长期保存,每一份卵子都有相应的编号,便于日后使用。
09使用时进行复温:若干时间后,当妇女需要使用卵子时,专业技术人员从液化氮中取出卵子,复温,用溶液清除掉卵子所用的化学物质。



试管婴儿人类配子胚胎与性腺常见的冷冻方法在辅助生育技术中,最常见的是程序化慢速冷冻法,其次是玻璃化冷冻,较少用的是超快速冷冻,后两者都属于快速冷冻的范畴。
冷冻技术在不同的IVF中心有或多或少的变化,但不同的方法都可获得较好的结局。
这表明冷冻标本可以耐受一定的外界变化,只要这种变化是在细胞可以承受的范围,则细胞可以存活,发育潜能可以维持。
(一)程序化慢速冷冻法通常在程序化慢冷的液体中,各含有一种细胞渗透性冷冻保护剂和一种非细胞渗透性保护剂,于室温下,在低浓度的冷冻保护剂溶液中预平衡,然后放置在终浓度的冷冻液中。
在冷冻仪(图13–2)内于预设的程序下降温标本,经过冷冻保护剂的处理后,胞内渗透压增高,意味着细胞内液冰点下降。
由于细胞自身的特性,它在细胞内外电解质平衡时,胞内液冰点比胞外低。
程序冷冻仪图13–1程序冷冻仪图13–2在室温到植冰点之间降温,往往冰晶还未来得及形成,但此期可以发生温度休克。
温度休克al shock)是指某些细胞在降温过快时受到损伤,甚至在冷冻过程中被破坏的一种表现。
其特点是与温度变化速率有关,常发生在15℃一一5℃降温过程之间。
这可能是由于细胞膜脂类的相变,膜受损后渗透率改变;或在不同的热收缩应激反应时,细胞膜结构的断裂引起的。
卵磷脂被认为有保护作用。
冷冻液通常在达到诸如一15℃的温度而冰晶尚未形成,即处于超冷状态。
为了避免过冷状态的发展,使每一个溶液在一个特定的温度时开始冻结,使细胞脱水逐步顺利地进行,及为了控制过冷生物样品中过度大冰晶的形成作用,可通过两种方法来诱发结晶:一是向液体中加入微量冰晶,较少采。
二是较常用的植冰(seeding):用预冷至一70℃,或更低温度的金属棒在标本溶液冰点以下2–3℃时,瞬间地接触样品容器,可以带走大量水在液相转化为固相的潜伏热,这样可以激发和协助溶液中许多小冰晶的形成。
辅助生殖中常采用的植冰温度是一6℃一– 8℃。
目前,人工植冰比冷冻仪自动植冰可靠,用冷冻过的金属镊接触的部位应避免标本刚好所在位置,以免将样品迅速降温至细胞内冰晶形成而致死,一旦看到细胞外溶液中有一个白点样的小冰晶出现,提示溶液中已有大量冰核形成,即应立刻移开金属镊,将冷冻管放回冷冻仪,数秒钟后如再次拿出冷冻管观察,则标本溶液呈白色云雾状,提示溶液中已有大量小冰品形成,提示植冰成功。
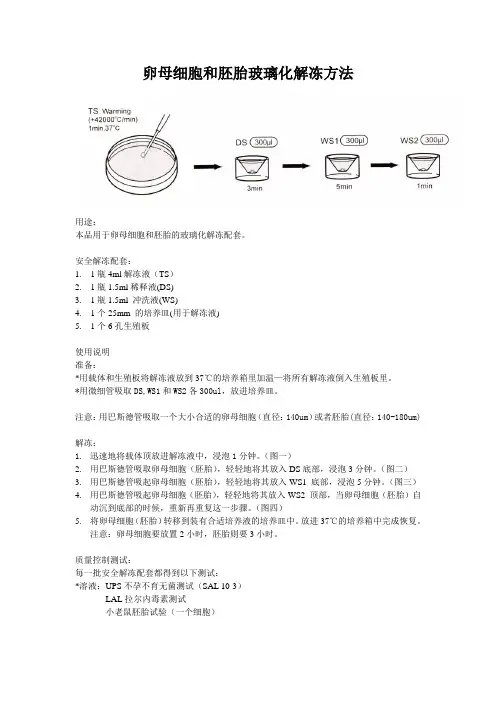
卵母细胞和胚胎玻璃化解冻方法用途:本品用于卵母细胞和胚胎的玻璃化解冻配套。
安全解冻配套:1.1瓶4ml解冻液(TS)2.1瓶1.5ml稀释液(DS)3.1瓶1.5ml 冲洗液(WS)4.1个25mm 的培养皿(用于解冻液)5.1个6孔生殖板使用说明准备:*用载体和生殖板将解冻液放到37℃的培养箱里加温—将所有解冻液倒入生殖板里。
*用微细管吸取DS,WS1和WS2各300ul,放进培养皿。
注意:用巴斯德管吸取一个大小合适的卵母细胞(直径:140um)或者胚胎(直径:140-180um)解冻:1.迅速地将载体顶放进解冻液中,浸泡1分钟。
(图一)2.用巴斯德管吸取卵母细胞(胚胎),轻轻地将其放入DS底部,浸泡3分钟。
(图二)3.用巴斯德管吸起卵母细胞(胚胎),轻轻地将其放入WS1 底部,浸泡5分钟。
(图三)4.用巴斯德管吸起卵母细胞(胚胎),轻轻地将其放入WS2 顶部,当卵母细胞(胚胎)自动沉到底部的时候,重新再重复这一步骤。
(图四)5.将卵母细胞(胚胎)转移到装有合适培养液的培养皿中。
放进37℃的培养箱中完成恢复。
注意:卵母细胞要放置2小时,胚胎则要3小时。
质量控制测试:每一批安全解冻配套都得到以下测试:*溶液:UPS不孕不育无菌测试(SAL 10-3)LAL拉尔内毒素测试小老鼠胚胎试验(一个细胞)保存方法:*保存于4-8℃*在标签所示有效日期前,本品性质稳定。
成分:*血清替代补充*基本培养基M-199 内含的HEPES*蔗糖参考文件(此部分请看原件).玻璃化第一部分:所需材料*玻璃化配套No.0 基础液(BS):1.5ml x1 (只用于卵母细胞玻璃化冷冻)No.1 稀释液(ES): 1.5ml x1No.2 玻璃化溶液(VS): 1.5ml x2*冷冻管x4, 建议每个冷冻管最多储存3个卵母细胞或者3个胚胎*复制板x2: 6孔*冷却架(蓝盒液氮,型号:VT-CLB)*巴斯德管(型号:MT-150)*显微镜(关掉加热板)*秒表或计算器(带计算功能)*液氮(消毒过滤功能,聚四氟乙烯滤膜过滤)*镊子*显微针x2: 2-20ul, 100-1000 ul*罐子*储存罐注意:使用的巴斯德管大小要与卵母细胞或胚胎大小合适。

人类胚胎冷冻保存技术的研究进展与应用前景延安大学生命科学学院(延安716000) 孙志宏 马 莉 周茂林 综述 李延清 审校 1983年Tr ounso n等首先将胚胎的冷冻-解冻技术用于人胚,并成功妊娠[1]。
目前,世界上已普遍开展了胚胎的冷冻和复融技术。
本文就胚胎冷冻技术基本原理、研究进展与应用前景做一综述。
1 胚胎冷冻保存原理及其损伤机制1.1 胚胎冷冻保存原理 冷冻保存(cr yo peserv ation),是将体外培养物悬浮在加有或不加冷冻保护剂的溶液中,以一定的冷冻速度降至零下某一温度,对其长期保存的过程[2]。
此时细胞的代谢活动被完全抑制,使细胞的生命在静止状态下保存下来,从而达到长期保存的目的。
胚胎冷冻技术是在精子冷冻保存的基础上发展起来的。
冷冻胚胎存活率是渗透压和低温损害积累结果的反映。
冷冻保护液的浓度和植冰温度之间确定最适宜的关系是保证冷冻胚胎存活的关键因素[1]。
1.2 胚胎冻存的损伤机制 胚胎的冷冻实际上是一个脱水过程,冷冻保存的关键是设法减少细胞内冰晶对胚胎造成的损伤。
正常胚胎细胞内水分含量达80%以上,在冷冻过程中,胚胎细胞中的水分将从细胞中游离出来冷冻成冰晶,一方面对胚胎细胞造成机械性损伤即冰晶损伤(ice damag e),另一方面导致未结冰的细胞内溶液渗透压急剧增高,造成蛋白质变性即溶液损伤(solutio n damag e),二者最后都导致胚胎不可逆性变化而死亡。
但是,如果在胚胎冷冻保存液中加入一定浓度的冷冻保护剂如甘油、DM SO、乙二醇等,则可大幅度减小冷冻对胚胎的损伤[3-4]。
冷冻保护剂的成分通过细胞膜进入细胞内,细胞内外冷冻保护剂和其它溶质达到平衡,同时细胞脱水形成玻璃化的凝固状态,该过程是胚胎冷冻最重要的保护机制。
解冻时,冷冻保护剂渗出细胞外,同时细胞膜必须防止水过多过快渗人细胞内,以免发生渗透性膨胀。
2 冷冻保护剂的种类极其作用机制 在胚胎冷冻和解冻过程中的适当阶段添加适当浓度的冷冻保护剂能有效地降低对细胞的损伤,科学选用冷冻保护剂在胚胎冷冻保存过程中非常重要[5]。

2022女性生育力保存技术(全文)随着全球生育力呈现出明显下降的趋势,中国的生育力下降也已经成为比较严重的社会问题。
女性肿瘤患者的一些相关治疗,例如化疗、盆腔放疗、造血干细胞移植、涉及卵巢的手术治疗都可能对生育力造成显著的损伤。
而非肿瘤疾病,主要涉及顽性免疫性疾病、需造血干细胞移植的良性血液性疾病、早发性卵巢功能不全(prematureovarian insufficiency , POI)相关疾病,虽然只占女性生育力保存需求的8%~19% ,但仍然值得我们关注。
目前女性生育力保存相关技术主要涉及胚胎冷冻、卵子冷冻、卵巢组织冷冻及相关衍生技术如卵母细胞体外成熟、卵泡培养等。
1胚胎冷冻及卵子冷冻冻融胚胎移植技术已存在30余年,目前冻融胚胎移植与新鲜胚胎移植妊娠率无明显差别,是已婚育龄女性进行生育力保存的有效方法。
根据国内外生育力保存指南建议,卵母细胞冷冻保存和胚胎冷冻保存一样,都是生育力保存的一线治疗方案,主要针对无配偶的未婚女性。
在我国,胚胎冷冻和卵子冷冻均是以玻璃化为主流的冷冻方法,已经基本代替了程序冷冻法。
对于安全性,从目前的研究随访结果来看,冻融胚胎移植周期除文献报道可能出现新生儿体重高于新鲜胚胎移植外,围产期母儿并发症及新生儿出生缺陷并没有明显的增加。
根据《冷冻胚胎保存时限的中国专家共识》,胚胎冷冻6年内不影响妊娠结局,但尚无足够证据证实胚胎冷冻保存时间超过6年对冻融胚胎移植安全性有影响。
目前也无证据表明长期保存玻璃化冷冻卵子存在安全性问题。
女性卵子冷冻时的年龄与活产率密切相关,35岁以下女性冷冻卵子的活产率随着冷冻卵子数的增多而持续增高,大于35岁女性冷冻卵子累计到20枚其活产率将不再增加。
2卵巢组织冷冻卵巢组织冷冻适用于青春期前的儿童或需紧急生育力保存的患者。
对于已接受化疗的患者,相较于胚胎冷冻与卵子冷冻而言,更推荐选择卵巢组织冷冻,其原因是化疗对于分裂活跃的细胞具有更加明显的毒性作用,而对始基卵泡相对不敏感。


畜禽细胞与胚胎冷冻保种技术规范 NY T 1900-2010ICS 65.020.30B 43 NY中华人民共和国农业行业标准NY/ T 1900-2010畜禽细胞与胚胎冷冻保种技术规范Procedures for cell and embryo cryopreservation of domestic animals 2010-07-08 发布 2010-09-01 实施中华人民共和国农业部发布NY/T 1900-2010前古目本标准遵照 GB/T 1. 1-2009 给出的规则起草。
本标准由中华人民共和国农业部畜牧业司提出。
本标准由全国畜牧业标准化技术委员会(SAC/TC 274)归口。
本标准起草单位:全国畜牧总站。
本标准主要起草人:xiJ丑生、王志刚、赵俊金、史建民、孟飞、于福清、孙飞舟、邱小田。
INY/T 1900-2010畜禽细胞与胚胎冷冻保种技术规范1 范围本标准规定了用于保种的家畜精液、家畜卵母细胞、家畜胚胎和畜禽成纤维细胞冷冻保存技术要求。
本标准适用于家畜精液、家畜卵母细胞、家畜胚胎和畜禽成纤维细胞等遗传物质冷冻保存和检验人库。
2 规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件,仅注目期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB 4143 .牛冷冻精液GB 20557 山羊冷冻精液NY/T 1234 牛冷冻精液生产技术规程NY/T 1674 牛羊胚胎质量检测技术规程3 术语及定义下列术语和定义适用于本文件。
3. 1超低温保存 cryopreservation在液氮中冷冻保存遗传物质的技术。
3. 2卵母细胞 oocyte来源于有腔卵泡具有繁殖能力的细胞。
3. 3成纤维细胞 fibroblast以畜禽组织或胎儿为材料,体外培养、分离出的梭形或不规则形细胞。
胞质近中央处有椭圆形胞核,胞体→般铺展很开,细胞之间排列疏松,有较大细胞间隙。


卵母细胞冷冻保存的方法(一)卵母细胞的获取随着哺乳动物胚胎操作技术的成熟和胚胎移植技术商业化的迅猛发展,各领域对卵母细胞的需求量与日俱增。
单纯依赖超数排卵获取卵母细胞的方法费用高、对动物生理功能影响大且获得的数量有限,因此不能满足科学研究和生产的需求。
现在主要有两种获取卵母细胞的途径:一是从活体卵巢采集,二是从屠宰厂废弃卵巢中获取卵母细胞。
1.活体卵巢上采集(1)腹腔镜法:此法在手术部先行局部麻醉,以消毒导管针刺入腹腔并向腹腔内轻轻打气、压迫胃肠前移,从导管内插入内镜进行搜索观察。
另用套有聚四氟乙烯套管的吸卵针在内镜引导下刺入卵泡内吸取卵母细胞。
该法在牛上采集排卵前卵母细胞可达80%~90%回收率。
(2)B型超声波法:此法将带有超声波探头和采卵针的采卵器插入到保定和麻醉母畜阴道子宫颈的一侧弯隆处缓慢移动卵巢,用吸卵针刺入直径大于2mm的卵泡,真空吸入卵母细胞和卵泡液。
现在,此法已成为牛活体采卵的主要方法。
(3)活体输卵管采卵法:通过手术方法采集排入输卵管内的卵母细胞。
打开腹部后,找到子宫角和输卵管并牵出腹腔外,自宫管接合部插入注射针、逆向从伞部输卵管腹腔孔冲洗,或者在宫管接合部子宫角尖下1cm处插入接卵管接于平皿中,自伞部输卵管腹腔口顺向注入冲卵液。
该方法目前是猪、绵羊、山羊、兔等动物常用的活体采卵方法。
2.屠宰后卵巢上采集动物屠宰后立即无菌采集卵巢,放入30~39℃灭菌生理盐水或灭菌PBS中,6小时内带回实验室。
尽管有人认为在18~21℃收集和操作牛卵母细胞能提高卵母细胞成熟率,Yang等(1990)的研究结果表明,牛卵巢在24℃保存24小时后收集的卵母细胞体外受精后仍有71.2%的卵裂率,而Solano等1994年的研究更显示将牛卵巢在4℃放置12~24小时后其卵裂率不受任何影响。
卵巢表面卵泡卵母细胞的获得是目前体外成熟培养中卵母细胞的主要来源,其采集方法有如下3种。
(1)抽吸法:用配以16号或18号针头的5ml或10ml注射器从直径2~6mm的卵泡中抽吸卵泡液。