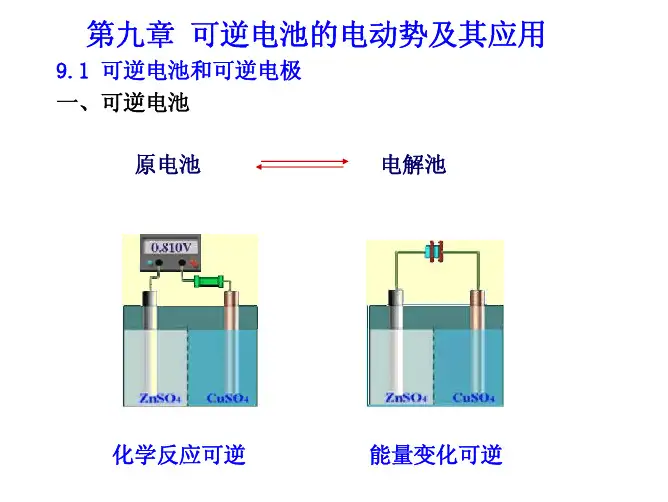
当电池放电时:
负极
Cd(Cd-Hg齐)→Cd2++2e
正极
Hg2SO4+2e→2Hg(1)+SO2-4
电池反应 Cd(Cd-Hg齐)+Hg2SO4(s)=CdSO4(s)+2Hg(1)
韦斯顿电池的电动势随温度的变化关系式可用下式表示: ET=1.01845-4.05×10-5(T-293.15)-9.5×10-7 (T-293. 15)2+1×10-8(T-293.15)3/V
如果该可逆电池按电池反应式进行,当反应进度ξ=1mol 时,其吉布斯自由能变化值应为:
△rGT,P=-nEF/ξ=-zEF z表示电极的氧化或还原反应式中电子的计量系数。
热力学量与电化学量联系起来的重要公式
如已知某反应的△G,并将其设计成可逆原电池,即可求此 可逆原电池的电动势;相反地,如能测出可逆原电池的电动 势,便可算出该电池反应的吉布斯自由能变化值。
△G值与z有关,即与反应式量有关
1/2Cu+Ag+=1/2Cu2++Ag z=1 △rGm,1=-1×EF=-EF
Cu+2Ag+=Cu2++2Ag
z=2
△rGm,2=-2×EF=-2EF
若此二反应式中各种离子浓度均未变化,只是反 应式量变化,则△rGm,2=2△rGm,1
2.2 原电池的电动势与浓度的关系
1.3.4 电动势的产生
原电池的电动势等于构成原电池各相间界面上所形成电势 差的代数和。或者说,它就是原电池的开路电压。“开路” 条件的实质就是没有电流通过电池。
为了表示出接触电势差,原电池表示符号的两边应表示为相
同的金属,这样图2.2