第6讲 配合物的化学键理论-分子轨道理论
- 格式:ppt
- 大小:619.00 KB
- 文档页数:31

第六章配位化合物的结构和性质教学目的:通过学习,使学生对配位化合物的三大化学键理论(价键理论、晶体场理论、分子轨道理论)有所了解,并能够运用合适的理论对常见配合物的结构和性质进行理论分析和解释。
教学重点:1.晶体场理论;2.姜-泰勒效应;3.分子轨道理论。
引言:配位化合物简称配合物,又叫络合物,是一类含有中心金属原子(离子)(M)和若干配体(L) 的化合物(MLn)。
中心原子通常是过渡金属元素的原子或离子,具有空的价轨道;而配体则有一对或多对孤对电子。
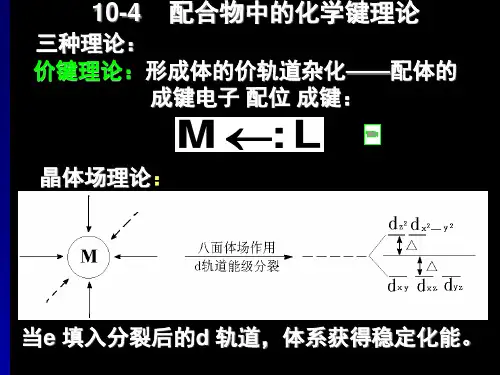
在广泛的化学实践和量子化学巨大发展的基础上,提出了各种解释中心原子和配体之间化学键本质的理论,主要有价键理论、晶体场理论和分子轨道理论第一节价键理论1928年Pauling把杂化轨道理论应用到配合物中,提出了配合物的价键理论。
一、理论要点:配体的配位原子提供孤对电子进入中心原子(或离子)的空的杂化轨道形成配位键;配位键可分为电价配键和共价配键两种,相应的配合物叫做电价配合物和共价配合物。
二、杂化轨道与空间构型三、电价配键和共价配键1、电价配合物中心离子的电子层结构和自由离子的一样,它与配体是以静电作用力结合在一起,常采用spd外轨道杂化,形成高自旋配合物。
电价配合物特点:配体往往电负性大,不易给出孤电子对,中心离子的结构不发生变化。
配合物中配位键共价性较弱,离子性较强;键能小,不稳定,在水中易分解简单粒子;2、共价配合物中心离子腾出内层能量较低的空d轨道,进行dsp内轨道杂化,接受配体的孤对电子,形成低自旋共价配合物。
共价配合物特点:配体往往电负性较小,较易给出孤电子对,对中心离子的影响较大,使其结构发生变化。
配合物中配位键共价性较强,离子性较弱;由于(n-1)d轨道比nd轨道能量低,所以一般共价配合物比电价配合物稳定,在水溶液中不易解离为简单离子。
3.实验测定:通过测定络合物的磁化率,可判断中央离子与配体间化学键性质kTN x A 32μμ=, )()(反顺O M x x x +=μ磁矩cn ehn n e B B πμμμ4,)2(=+=(玻尔磁子) n 未成对电子数有摩尔磁化率X m 可计算络合物的磁矩μ,由μ可估算出n(未成对电子数),从而可判断此络合物是电价配键,或共价配键。


分子结构和化学键的电子分子轨道理论化学是研究物质变化和性质的科学,而分子结构和化学键的电子分子轨道理论是解释和预测分子性质的重要工具。
本文将探讨分子结构的形成以及化学键的形成机制,并介绍电子分子轨道理论在解释分子性质方面的应用。
一、分子结构的形成分子结构的形成是由原子之间的相互作用而产生的。
原子通过共用、转移或共享电子来形成分子。
其中最常见的是共价键和离子键。
共价键是由两个非金属原子共享电子而形成的。
在共价键中,原子通过共享电子对来达到稳定的电子构型。
例如,氢气分子(H2)中的两个氢原子通过共享一个电子对形成共价键。
共价键的强度取决于原子核吸引电子的能力和电子云的形状。
离子键是由金属和非金属原子之间的电荷吸引力而形成的。
在离子键中,金属原子失去电子,形成正离子,而非金属原子获得电子,形成负离子。
正负离子之间的电荷吸引力形成了离子键。
例如,氯化钠(NaCl)中的钠离子和氯离子通过离子键结合在一起。
二、化学键的形成机制化学键的形成机制可以通过量子力学的电子分子轨道理论来解释。
电子分子轨道理论认为,分子中的电子存在于分子轨道中,这些分子轨道是由原子轨道线性组合而成的。
共价键的形成可以通过氢原子的轨道重叠来解释。
当两个氢原子靠近时,它们的1s轨道发生重叠,形成一个σ(sigma)键。
σ键是最强的共价键,因为它是通过头对头重叠形成的。
离子键的形成可以通过金属和非金属原子之间的电子转移来解释。
金属原子失去一个或多个电子,形成正离子,而非金属原子接受这些电子,形成负离子。
正负离子之间的电荷吸引力形成了离子键。
三、电子分子轨道理论的应用电子分子轨道理论在解释分子性质方面有广泛的应用。
通过计算分子轨道的能量和形状,可以预测分子的稳定性和反应性。
例如,通过电子分子轨道理论可以解释分子的颜色。
分子吸收光的能力取决于分子轨道的能量差异。
当分子吸收特定波长的光子时,能量差异与光子能量相匹配,分子吸收光的颜色就会发生变化。






有机化学中的分子轨道理论在有机化学中,分子轨道理论是一种重要的理论工具,用于解释有机分子的化学性质和反应机理。
分子轨道理论基于量子力学的原理,通过计算和描述分子中电子的运动状态,从而揭示了分子中化学键的形成和断裂、化学反应的进行等重要现象。
本文将介绍有机化学中的分子轨道理论的基本概念、应用以及研究进展。
一、分子轨道理论的基本概念分子轨道理论是基于原子轨道的概念,原子轨道是描述单个原子中电子运动状态的函数。
在一个分子中,原子之间通过共价键形成连接。
根据量子力学的原理,分子中的电子不再局限于单个原子,而是在整个分子中运动。
因此,分子的电子状态需要用一组轨道来描述,这组轨道被称为分子轨道。
分子轨道可以通过线性组合原子轨道(Linear Combination ofAtomic Orbitals,简称LCAO)的方法得到。
LCAO方法假设分子中的分子轨道是由原子轨道线性组合而成的,即每个原子轨道会形成分子轨道的一部分。
通过线性组合的过程,得到的分子轨道既保留了原子轨道的主要特征,又反映了分子中电子的运动状态。
分子轨道可以分为成键轨道和反键轨道。
成键轨道是由原子轨道线性组合形成的,对分子中的共价键的形成起着积极的作用;而反键轨道则是在原子轨道的基础上得到的,它们对共价键的形成没有帮助,反而会削弱共价键。
在分子中,成键轨道和反键轨道总是呈成对存在,它们之间通过分子中的原子核进行相互作用,形成了稳定的分子。
二、分子轨道理论的应用分子轨道理论在有机化学中有着广泛的应用。
它可以通过分析分子轨道的能级和电子分布,预测有机分子的性质和反应行为。
1. 能级结构分子轨道理论可以帮助确定分子中的能级结构。
不同的分子轨道具有不同的能级,电子会填充在低能级的轨道中。
通过计算和实验,可以确定分子中各个分子轨道的能级顺序,从而预测有机分子的稳定性、光谱性质等重要特性。
2. 共价键的形成和断裂分子轨道理论解释了共价键的形成和断裂过程。
键合理论与分子轨道理论键合理论和分子轨道理论是描述化学键形成和分子结构的理论模型。
它们在解释化学反应、分子和材料性质方面起着重要作用。
本文将介绍这两个理论的基本概念、原理以及在化学领域的应用。
一、键合理论键合理论是描述分子中化学键形成和键的特性的理论模型。
它最早由保罗·迪里克(Paul Dirac)和罗伯特·桑德斯·穆兹利(Robert Sanderson Mulliken)等人在20世纪初提出,并得到了后来物理学家林纳斯·鲍林和化学家福克特等人的进一步发展。
键合理论的基本概念是通过原子间的电子转移和共享来解释化学键的形成。
它假设原子之间的化学键是通过Valence Bond(价键)形成的,即原子轨道(Atomic Orbital)中的电子在键形成过程中重叠和共享。
键合理论通过描述原子轨道的叠加和电子的共享来解释化学键的强度和性质。
键合理论主要包括以下几个核心概念:1. 来自原子的轨道(Atomic Orbitals):键合理论中,原子间的键通过来自原子的轨道上的电子形成。
原子轨道可以分为s、p、d、f等不同类型,它们具有不同的形状和能量。
2. 电子的自旋(Spin):键合理论中的电子带有自旋,自旋可以是向上或向下的。
电子自旋的方向影响了键的稳定性,特别是对于键的强度和反应性有着显著的影响。
3. 原子轨道叠加和电子共享:键的形成是通过原子轨道之间的叠加和电子的共享。
当两个原子间的原子轨道叠加时,会形成键和反键轨道。
键轨道中的电子寿命相对较长,而反键轨道中的电子寿命较短。
4. 化学键类型:键合理论可以解释不同类型的化学键,包括共价键、离子键和金属键。
通过电子的共享、转移和交换,原子之间形成不同强度和性质的化学键。
二、分子轨道理论分子轨道理论是描述分子中电子结构和分子性质的理论模型。
它是对键合理论的一个扩展和发展,最早由罗伯特·穆兹利等人在20世纪30年代提出。
分子轨道理分子轨道理论是化学中的一个重要概念,用于描述分子中原子之间的电子运动。
它在有机化学、无机化学和物理化学等领域中广泛应用。
分子轨道理论指出,原子在分子中的电子不再是属于单个原子的轨道,而是分布在整个分子中的一组分子轨道中。
分子轨道理论主要包括以下几个方面:1. 原子轨道的组合:分子中各个原子的原子轨道将组合成一个新的轨道,用于描述整个分子中的电子运动。
原子轨道的组合方式可以是线性组合,也可以是简单的加法和减法。
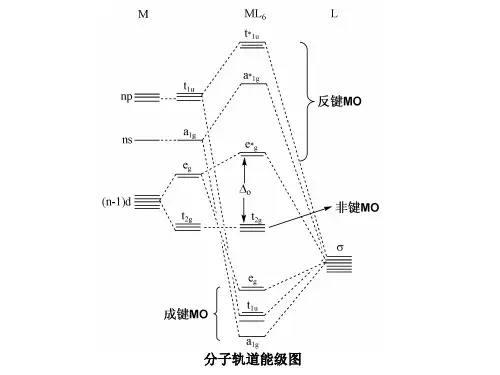
2. 分子轨道的分类:分子轨道可分为成键轨道、反键轨道和非成键轨道。
成键轨道是分子中电子密度最高的轨道,由原子轨道的积极相互作用形成。
反键轨道是分子中电子密度最低的轨道,由原子轨道的消极相互作用形成。
非成键轨道则是分子中既不属于成键轨道也不与反键轨道有关联的轨道。
3. 轨道能级:分子中的分子轨道能级与原子轨道能级不同,原子轨道能级具有离散性,而分子轨道能级连续分布。
能级的顺序分别是成键轨道最低、反键轨道最高、非成键轨道在中间。
4. 轨道重叠:分子中的原子轨道之间会发生重叠,这会影响分子中的电子结构。
重叠程度越高,分子的稳定性就越高。
例如化学键就是由两个原子轨道之间的较强重叠形成的。
5. 分子轨道的描述:分子轨道可以用波函数来描述。
波函数可以用于计算分子中的能量、电子密度、电荷分布等物理性质。
在实际应用中,通常使用量子化学计算方法来获得分子轨道的波函数和参数。
总的来说,分子轨道理论为我们了解分子中的电子结构和化学反应提供了基础和框架。
在有机合成和物质设计中,分子轨道理论被广泛应用于分子的构建、反应性和化学性质的预测等方面。