配位化合物的化学键理论及应用
- 格式:ppt
- 大小:2.99 MB
- 文档页数:91

无机化学中的配位化合物无机配位化合物是指由中心金属离子或原子与周围配体形成的稳定化合物,其中配体可以是有机分子、无机物以及某些复杂的大分子。
这些化合物在化学、材料和生物领域具有广泛的应用。
本文将对无机化学中的配位化合物进行详细介绍。
一、配位键的形成在配位化合物中,中心金属离子通过与配体的配位键结合在一起。
配位键可以是共价键,也可以是离子键。
在共价配位键中,金属离子与配体共享电子对,形成共有的化学键。
而离子配位键中,金属离子通过吸引配体上的电子形成离子键。
二、常见的配体在配位化合物中,各种不同的配体可以与中心金属离子形成配位键。
常见的配体包括一价的阴离子(如Cl-、Br-、I-)、二价的阴离子(如O2-、OH-)以及有机分子(如NH3、CO、CN-等)。
这些配体的不同基团和电性决定了它们与金属离子之间的相互作用方式和配位键的强度。
三、配位化合物的结构配位化合物的结构可以是简单的一对一结构,也可以是复杂的多中心配位结构。
在一对一结构中,一个中心金属离子配位于一个配体上。
而在多中心配位结构中,一个或多个中心金属离子与多个配体形成配合物。
四、配位化合物的性质配位化合物的性质受到配体和中心金属离子的影响。
配合物的颜色、溶解度、稳定性以及一些化学反应都与配体和金属离子的性质密切相关。
例如,某些过渡金属离子与氮、氧等电负性较高的配体形成的配合物具有较强的酸性;而某些具有大的络合度的配合物则具有较好的溶解性和稳定性。
五、应用无机配位化合物在化学、材料和生物领域具有广泛的应用。
在催化剂中,配合物的金属离子可以提供活性位点,从而促进化学反应的进行。
在生物医学中,金属配合物可以用作药物,通过与特定的生物分子相互作用来治疗疾病。
此外,配位化合物也广泛应用于材料科学领域,用于制备光电材料、磁性材料、液晶材料等。
六、进展与展望近年来,随着科学技术的不断发展,无机化学中的配位化合物在结构设计、属性调控以及应用领域方面取得了许多重要的进展。



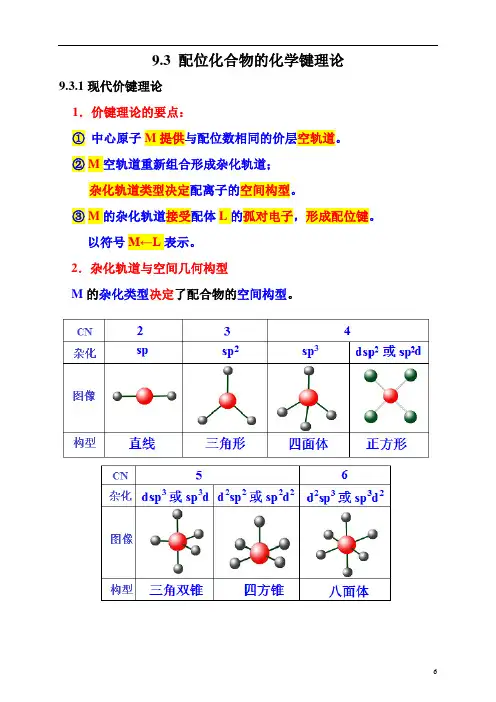



无机化学:第八章配位化合物第八章配位化合物一、配合物的基本概念1、配位化合物的定义及其组成定义:把由一定数目的阴离子或中性分子与阳离子或原子以配位键形成的复杂分子或离子称配合单元。
含有配合单元(配位键)的化合物即配合物。
配合物可看成是一类由简单化合物反应生成的复杂化合物。
配合单元相对稳定,存在于晶体及溶液中,在溶液中不能完全离解为简单组成的部分。
配位键——由配体单方面提供电子对给中心原子(离子)而形成的共价键。
中心离子(或中心原子)——又称“配合物形成体”。
特征:带有空轨道。
组成中心离子的元素种类:◆能充当中心离子的元素几乎遍及元素周期表的各个区域,但常见的是金属离子,尤其是一些过渡金属离子,如[Co(NH3)6]3+、[Fe(CN)6]4—、[HgI4]2—。
◆高氧化态非金属元素原子:如B、Si、P等形成[ BF4]—、[SiF6]2—、PF6—。
◆金属元素电中性原子:如[ Ni(CO)4]、[ Fe(CO)5]、[Cr(CO)6]配合物的组成:配合物由内界和外界组成。
内界为配合物的特征部分(即配位个体),是一个在溶液中相当稳定的整体,在配合物的化学式中以方括号表明。
方括号以外的离子构成配合物的外界。
内外界之间以离子键结合,故在水溶液中易解离出外界离子,而内界即配合单元很难发生离解。
如[Cu (NH3)4] SO4↓↓↓中心原子,配位体,外界在配合物中同中心原子/离子配位的分子如NH3、H2O或阴离子如Cl—、CN—、SCN—称为配位体,简称配体。
配体属于Lewis碱,都含有孤对电子,是电子对的给予体。
中配体无机化学配位化学CO 一氧化碳羰基OH—氢氧根离子羟基NO2—亚硝酸根硝基ONO—亚硝酸根亚硝酸根SCN—硫氰酸根硫氰酸根NCS—硫氰酸根异硫氰酸根Cl—氯离子氯配位体中与中心离子(或原子)直接成键的离子称为配位原子。
配位体所提供的孤对电子即是配位原子所具有的孤对电子。
常见的配位原子有:F、Cl、Br、配位体分类——单齿配体和多齿配体单齿配体:一个配位体只提供1个孤对电子与1个中心离子结合形成1个配位键。


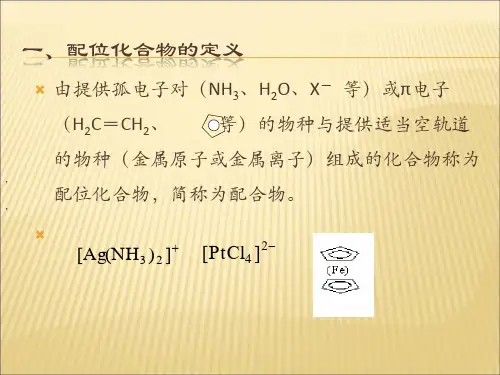
化学反应中的配位化合物和配位键配位化合物是指由一个或多个配体与中心金属离子或原子形成的化合物。
配体通常是具有可供给电子对的原子团或分子,它们通过与中心金属离子或原子形成配位键来稳定化合物的结构。
在化学反应中,配位化合物起着重要的作用,既可以作为反应物参与反应,也可以作为产物生成。
一、配位键的形成配位键是配体与中心金属离子或原子之间的化学键。
配位键的形成是通过配体中的孤对电子与中心金属离子或原子的空轨道相互重叠形成。
配体中的孤对电子通常来自于氧、氮、硫等具有较高电负性的原子,而中心金属离子或原子的空轨道则来自于其d轨道或f轨道。
例如,以氯离子(Cl-)和水分子(H2O)为配体,中心金属离子为氧化铜(Cu2+),它们共同形成了CuCl2(H2O)4配位化合物。
在该化合物中,氯离子(Cl-)和水分子(H2O)通过配位键与Cu2+离子形成稳定的化合物结构。
二、配位化合物在反应中的作用1. 催化剂:配位化合物常常被用作反应的催化剂。
催化剂能够提供活化能,降低反应的能垒,加速反应速率。
例如,钌催化剂常用于不对称氢化反应,通过与底物形成稳定的配位化合物,提高反应的效率和选择性。
2. 反应物:配位化合物可以作为反应物参与化学反应。
例如,亚铁离子(Fe2+)在催化剂的作用下与过氧化氢反应生成亚铁配合物,并参与了脱氧过程。
这种反应对于氧气的吸收和转化具有重要意义。
3. 产物:化学反应中的配位化合物也可以作为产物生成。
例如,金属络合物的形成通常与配体的选择性配位及金属的氧化还原状态变化有关。
配位化合物的生成对于理解金属离子在溶液中的行为和催化机制具有重要意义。
总结:配位化合物和配位键在化学反应中起着重要作用。
配位键的形成是通过配体中的孤对电子与中心金属离子或原子的空轨道的相互重叠实现的。
配位化合物可以作为反应物参与反应,也可以作为产物生成。
在催化剂的作用下,配位化合物还能提高反应的速率和选择性。
通过研究配位化合物和配位键,可以深化对化学反应的理解,并为实现高效催化和有机合成提供理论基础。
化学反应中的配位化合物与配位键的化学原理在化学反应中,配位化合物和配位键都扮演着重要的角色。
配位化合物是指由一个中心金属离子和周围配体离子或分子组成的化合物。
而配位键则是指连接中心金属离子和配体之间的化学键。
对于理解化学反应过程和性质,了解配位化合物和配位键的化学原理至关重要。
一、配位化合物的构成配位化合物由中心金属离子和配体组成。
中心金属离子通常是过渡金属或稀土金属离子,具有较高的化学活性。
配体可以是阳离子、阴离子或中性分子,它们通过配位键与中心金属离子结合。
配位化合物的构成可以通过配位理论来解释。
常见的配位理论有离子配位理论、共价配位理论和价键配位理论。
离子配位理论认为中心金属离子和配体之间是通过离子键结合的。
共价配位理论则认为中心金属离子和配体之间是通过共价键结合的。
而价键配位理论则融合了离子配位理论和共价配位理论,认为配位键是由离子键和共价键组成的。
二、配位键的形成配位键是中心金属离子和配体之间的化学键。
它的形成涉及到配体分子的给电子性和中心金属离子的接受电子性。
常见的配位键有配位离子键、配位共价键和配位金属键。
配位离子键是指配位体通过成为离子形式与中心金属离子结合。
配位共价键是指配体通过与中心金属离子共用一对电子形成化学键。
配位金属键则是指配体中的一个或多个配体原子与中心金属离子的键相比其他配体原子和中心金属离子的键更强。
三、配位化合物的性质与应用配位化合物具有丰富的性质和广泛的应用。
其中一些性质和应用与配位键的特性密切相关。
1. 形成的稳定性:配位键的强弱决定了配位化合物的稳定性。
一些稳定的配位化合物具有良好的溶解性和可控制的性质,因此广泛应用于化学合成和材料科学中。
2. 配位化合物的颜色:一些配位化合物具有鲜艳的颜色。
这是由于配位键的形成导致中心金属离子的电子跃迁,吸收并反射特定波长的光。
这些配位化合物在染料、颜料和染料敏化太阳能电池等领域具有广泛的应用。
3. 配位化合物的磁性:一些配位化合物具有磁性。