关于遗传性痉挛性截瘫新发基因突变1例患者病例报告及临床特点回顾
- 格式:pdf
- 大小:286.09 KB
- 文档页数:1

遗传性痉挛性截瘫家系致病基因定位和基因突变的临床特点及遗传方式分析发表时间:2014-07-23T17:53:43.750Z 来源:《中外健康文摘》2014年第20期供稿作者:柯新1 梁永玲1 刘奇迹[导读] 根据GeneBank数据库中提供的候选基因SPAST的基因组序列,利用Primer Premier 5.0软件设计。
柯新1 梁永玲1 刘奇迹2(1山东省威海市经济技术开发区医院骨科 264205;2山东大学医学院遗传研究所 250012)【摘要】目的通过对山东省威海地区一个遗传性截瘫家系进行了定位和基因突变的临床特点及遗传方式分析,确定该病的遗传类型及其发生机制。
方法经家系调查及临床检查确定疾病类型;通过致病基因微卫星多态位点进行连锁分析。
结果该家系的遗传性痉挛性截瘫常染色体显性遗传发现该家系中患者在SPAST基因第15外显子存在一个14bp的缺失突变。
结论遗传性痉挛性截瘫家系致病的突变为位于SPG4基因第15外显子的一个14bp的缺失突变所致。
【关键词】SPG4基因连锁分析突变分析临床特点遗传方式【中图分类号】R74 【文献标识码】A 【文章编号】1672-5085(2014)20-0141-02家族遗传性截瘫是一种神经系统退行性变性疾病,是遗传性共济失调中较多见的类型。
我们在山东省威海市发现了一个大家系,所有患者呈典型的单纯性遗传性痉挛性截瘫症状。
我们采用候选基因分析方法对该家系进行了基因定位和基因突变分析。
一、研究对象山东省威海地区发现了一个遗传性截瘫大家系,健在的家系成员现有四代,核心成员23人,其中患者4人。
二、研究方法1.家系的临床调查:(1) 家系调查:我们对家系中所有能追溯到的成员进行直接的临床检查,并绘制家系的系谱图。
(2) 临床及体格检查:由当地医院相关科室临床医生对家系中的成员进行病史采集和体格检查,并记录检查结果。
(3) 辅助检查。
2.家系成员的标本采集。
根据知情同意原则,抽取家系中各成员的外周静脉血3~5ml,加入0.2mlACD抗凝,充分混匀;提取各成员的基因组DNA。

遗传性痉挛性截瘫与相关基因研究进展摘要】近几年遗传性痉挛性截瘫在分子遗传学方面取得了很大的进展,已定位了16个基因相关位点,其中10个疾病基因已被克隆。
新基因位点的发现及疾病基因的克隆,进一步完善了基因诊断并为揭示其分子发病机制提供了线索。
【关键词】遗传性痉挛性截瘫基因研究进展【中图分类号】R394 【文献标识码】A 【文章编号】2095-1752(2013)36-0106-02遗传性痉挛性截瘫(HSP或SPG),又称Strtimpell-Lorrain病,是一组具有明显临床和遗传异质性的神经系统变性疾病,按SPG临床表现不同分为两型,即单纯型和复杂型。
按遗传方式不同,SPG可分为常染色体显性遗传(AD)、常染色体隐性遗传(AR)和x-连锁隐性遗传(XR),其中以AD遗传最为常见。
近几年AD—SPG在分子遗传学方面取得了很大的进展,到目前为止,已定位了16个AD-SPG疾病基因相关位点,其中10个疾病基因已被克隆。
新基因位点的发现及疾病基因的克隆,进一步完善了基因诊断并为揭示SPG的分子发病机制提供了线索。
atlastin 基因与SPG3A:SPG3A在AD?SPG中发病率仅次于SPG4,约占AD-SPG的10%,而在青少年起病的AD.SPG中SPG3A是最常见的。
SPG3A定位于14号染色体,含14个外显子,全长69 kb,编码的atlastin蛋白主要在中枢神经系统表达,与鸟苷酸连接蛋白1(GBPl)有很高的同源性。
atlastin蛋白含558个氨基酸,作为GTP酶家族的成员,在囊泡转运中对神经递质和神经营养因子的转运至关重要。
目前已发现SPG3A的14个外显子上超过20种不同的突变,包括大多数的错义突变、单核苷酸插入突变以及缺失突变[1],而这些突变导致SPG3A的机制尚未明确部分研究显示SPG3A患者的atlastin蛋白改变破坏了其GTP酶的活性或者改变aflastin蛋白与其他蛋白的相互作用,使其不能行使囊泡转运功能而导致SPG3A。




遗传性痉挛性截瘫1例师和娣1 张克军2 (1山西省乡宁县人民医院儿科 乡宁 042100 山西医科大学第一临床医学院儿科)关键词 截瘫 痉挛性截瘫 遗传性疾病 儿童中图号 R596.1 R745.49 遗传性痉挛性截瘫即家族性痉挛性截瘫,又称Strumpell-Lorrain病[1],是一种少见的神经系统变性疾病,现将我院收治1例报道如下。
1 病例患儿,男,5岁,主因双下肢运动障碍伴语言障碍3+年入院。
自1.5岁起半年内逐渐走路不稳,不能独立行走,以至不能独立站,出现语言障碍。
系第一胎,足月顺产,7月会坐,1岁会走,1.5岁会说简单话语,病后智力无倒退。
父母非近亲婚配,家族中无类似病例。
体检:体重18 kg,身长96cm,头围46cm,皮肤色素无异常,脊柱无畸形。
心肺腹未查见异常。
扶走时双足尖着地,下肢僵直。
颅神经无异常。
双上肢肌力,肌张力正常。
双下肢肌力Ⅱ级,肌张力增高,肌萎缩不明显。
无共济失调,痛触觉,温度觉存在,位置觉存在。
腹壁反射对称引出,双膝腱反射亢进,踝阵挛(+),双巴氏征(+),双霍夫曼氏征(+)。
血、尿、便常规,肝功、头颅CT、颈腰段MRI,肌电图检查均正常。
双手纹atd角55°,双眼检查:K-F环(-),视神经轻度萎缩。
诊断:遗传性痉挛性截瘫,头小畸型。
2 讨论此病系我院第一次诊断。
北京儿童医院仅报道收治过11例[2]。
多见于儿童期,5岁前起病占40%[3]。
2.1 分型 据发病分为早发型(3~5岁起病),晚发型(30岁以后起病)。
据病理检查及临床表现又分为单纯型(只限于双下肢痉挛性瘫痪)、复杂型(表现双下肢痉挛性瘫痪、视力损害及共济失调)可有小脑症状[2]。
本例符合早发、单纯型,无感觉障碍及小脑症状,尚伴有视神经萎缩,但无明显视力损害。
2.2 遗传方式 此病主要是常染色体显性遗传,有时是常染色体隐性遗传,极少数是性染色体隐性遗传[1]。
国内刘伯荣曾报告过X染色体伴性隐性遗传的家族性发病[4]。

案例分享基因检测辅助诊断罕见病——遗传性痉挛性截瘫临床信息:患者,男性,67岁;身腓骨肌萎缩症?患者母亲两个弟弟都有走路不稳、剪刀脚病史。
检测内容:医学外显子测序。
采用高通量测序技术对4503个常见遗传疾病相关基因进行全外显子区域测序,检测范围包括基因编码区单核苷酸位点变异(SNV)、小片段插入/缺失(INDEL)。
检出1个匹配受检者临床表型的疑似致病的基因变异:SPAST基因c.A1216G:p.I406V杂合变异。
变异基因解读:注:“.”:无注释;蛋白预测:Revel评分>0.5提示可能有害;人群频率:gnomAD_exome_EAS。
OMIM表型简介:主要临床表现:眼球震颤(罕见);尿急,尿失禁,括约肌障碍;下背痛;下肢痉挛,下肢无力,痉挛性步态,反射亢进,锥体征,外侧皮质脊髓束退化,认知减退,记忆障碍,语言表达缺陷,精神发育迟滞(罕见),痴呆(罕见),桥小脑角蛛网膜囊肿(1例报道);下肢振动感减少;激动,攻击,冷漠,抑郁;其他:发病年龄可变(婴儿期至63岁),发病隐匿,进展性疾病,表型高度可变,遗传早现,遗传异质性。
GeneReviews: /books/NBK1160/。
变异位点一代验证先证者:结果显示该位点为杂合变异(SPAST:NM_014946:exon9:c.A1216G:p.I406V)遗传咨询建议1. 疾病外显率与年龄、性别有关,建议结合实际情况随诊受检者及母亲、两个舅舅的临床表型,以进一步明确检出变异临床意义。
2. 受检者检出变异有50%概率遗传给子代,结合随诊行遗传咨询。
3. 建议结合实际情况,考虑对受检者相关亲属进行该变异位点一代验证,以评估患病风险■■■■■■■一、遗传性痉挛性截瘫遗传性痉挛性截瘫(hereditary spastic paraplegia,HSP)是一组以渐进性双下肢痉挛性截瘫、步态异常为主要表现的神经系统遗传变性病。
本组疾病具有明显的临床和遗传异质性。

·562·· 短篇论著 ·遗传性痉挛性截瘫IBA57基因新发突变1例A novel mutation of the ROR2 IBA57 gene in a family with hereditary spastic paraplegia孙艳美,张宁,罗艳,李亚丽 (河北省人民医院生殖遗传科,石家庄 050051) 摘要 采用全外显子测序对1例疑似遗传性痉挛性截瘫病例进行相关基因检测,同时行羊膜腔穿刺术提取胎儿DNA,对可疑致病性变异位点进行Sanger测序验证。
结果提示,患儿存在IBA57基因c.22C﹥T (p.R8X) (父源) 和c.341G﹥C (p.G114A) (母源) 复合性杂合突变,该突变尚未见文献报道,结合临床表型、遗传方式及基因测序结果,先证者所患疾病为痉挛性截瘫74型。
关键词 遗传性痉挛性截瘫; 二代测序; 基因突变中图分类号 R394 文献标志码 A 文章编号 0258-4646 (2021) 06-0562-05网络出版地址 https:///kcms/detail/21.1227.R.20210525.1121.038.htmlDOI:10.12007/j.issn.0258‐4646.2021.06.019遗传性痉挛性截瘫 (hereditary spastic paraplegia,HSP) 是一种罕见的、具有高度临床和遗传异质性的遗传性神经系统退行性病变。
HSP遗传基础复杂,涉及孟德尔遗传模式 (包括常染色体显性遗传、常染色体隐性遗传和X连锁隐性遗传) 和线粒体母系遗传,其中以常染色体显性遗传最为常见。
最常见的病理特征是皮质脊髓束和后柱长下行运动神经纤维远端轴索病变。
HSP发病机制迄今尚不清楚,目前多认为与膜囊泡运输、轴突运输、脂质代谢、细胞器形态发生和分布、线粒体功能和髓鞘化过程等受到影响有关[1-2]。
HSP常合并多系统病变,临床表型也多种多样,误诊和漏诊率高。


遗传性痉挛性截瘫的临床特征和管理文章题目:Clinical features and management of hereditary spastic paraplegia发表杂志:Arq Neuropsiquiatr发表时间:2014年3月关键词:hereditary spastic paraplegia文章简介:遗传性痉挛性截瘫,一种单基因遗传病,三种遗传方式包括常染色体显性(70-80%)、常染色体隐性和X连锁隐性遗传。
典型病症是缓慢渐进性痉挛和下肢无力。
临床病症和发病年龄的变化范围很广。
文章链接:/pubmed/246764401. 该罕见病特征. 中文名:遗传性痉挛性截瘫. 英文名: hereditary spastic paraplegia,缩写HSP. 典型病症:缓慢渐进性痉挛和下肢无力等. 遗传学特征:常染色体显性(70-80%)、常染色体隐性、X连锁隐性遗传。
. 致病基因:几十个. 发病率:1.3-9.6/1000002. 遗传病因除了明显的家系病例,相当比例的散发病例也是有其遗传上的病因。
近年来发现了不少HSP相关基因,有助于医生进行更准确和早期的诊断。
导致神经退行病变的分子通路还未被揭示。
遗传方面可分为常染色体显性(AD),常染色体隐性(AR),X 连锁隐性遗传(XR)。
. 常染色体显性(AD)AD型HSP占了所有病例的70-80%。
发病年龄和疾病严重程度在家系内和家系间的变异很大。
SPG4基因突变导致约一半的AD型HSP病例和10%的散发型病例。
SPG3a基因突变是AD型HSP的第二常见病因,和早发型HSP 的最常见病因。
SPG31基因突变占了5%的AD型HSP。
典型病症为早发型痉挛性截瘫和下位运动神经元病(也叫Silver综合征)SPG6和SPG8基因突变会造成单纯型HSP。
SPG6病例的进行性较慢,大多数在成人早期发病。
AD型HSP的遗传分类如下表。
. 常染色体隐性(AR)AR型HSP主要病症是神经和临床方面的多形性异常。
遗传性痉挛性截瘫1例报道--疑似1例新型基因位点杂合突
变
姚献花;冯刚
【期刊名称】《光明中医》
【年(卷),期】2014(000)010
【摘要】以期通过1例家族成员的临床症状考虑与遗传有关,进行基因检测,先症者与其母亲基因位点杂合突变相同,考虑是否存在尚未被发现的新的基因位点突变存在,为该病的诊断提供依据,发现探讨遗传性痉挛性截瘫临床及遗传特点以及基因突变有关。
【总页数】2页(P2165-2166)
【作者】姚献花;冯刚
【作者单位】河南中医学院第一附属医院儿科郑州450000;河南中医学院第一附属医院儿科郑州450000
【正文语种】中文
【相关文献】
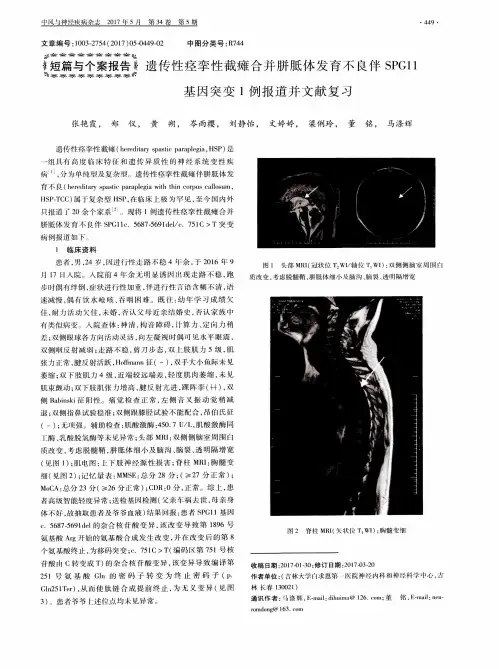
1.遗传性痉挛性截瘫合并胼胝体发育不良伴SPG11基因突变1例报道并文献复习[J], 张艳霞;郑仪;黄朔;岑雨樱;刘静怡;文婷婷;梁俐玲;董铭;马涤辉
2.伴有TTN基因复合杂合突变BMD 1例报道并文献复习 [J], 虞雄鹰;查剑;易招师;钟建民;杨文萍
3.国内第二例WDR62基因复合杂合突变导致的小头畸形病例报道 [J], 曾玉坤;刘玲;尹爱华
4.伴胼胝体发育不良和癫痫的遗传性痉挛性截瘫的一个新基因位点 [J], Al-Yahyaee; S.; Al-Gazali; L.; I.; De; Jonghe; P.; 蔡同建(译)
5.TH杂合突变致多巴胺反应性肌张力障碍一例报道并文献复习 [J], 苗雪萍;孙权;王共强;杨任民
因版权原因,仅展示原文概要,查看原文内容请购买。
遗传性痉孪性截瘫1例分析遗传性痉孪性截瘫(hereditary spasticparaplegia)是一种比较少见的家族遗传性变性病,以慢性进行性无力与慢性痉挛性下肢瘫痪为特征。
病理特点为皮质脊髓束变性,该病有遗传家族史,发病机制至今仍不清楚。
有人认为是基因遗传与酶系统缺陷有关。
下面就一例患者的病情加以分析。
患者,女,27岁。
2006年7月无明显诱因开始出现步态异常,走路时双下肢发僵,以右下肢为著,右脚用足尖走路,脚后跟不能着地,且经常在走路时出现摔倒现象,以身体向后倾倒次数为多,摔倒前后都意识清楚,双上肢活动正常。
于2006年11月去北京地区301解放军总医院就诊,给予口服美多巴从小剂量开始治疗,开始服用一个月患者自觉症状有所缓解,即觉得双下肢发僵有所减轻,而且摔倒现象也减少了,但是一个月后继续服用时患者自觉不再有明显的改善,且症状呈进行性加重,并同时伴有小便失禁,饮食水呛咳,且上述症状呈晨轻暮重的特点,为进一步诊治来我院就诊。
家族史:患者母亲大约30岁左右发病,双下肢发僵,双足尖走路,后渐渐不能自行走路。
其三个舅舅均因同样症状不能走路而瘫痪在床,且均有小便失禁及饮食水呛咳,均在大约30岁左右发病,而且患者及其家人智力及记忆力反应力都正常。
入院后体格检查:BP110/70mmHg,神志清楚,语言流利,颅神经检查正常,四肢肌张力高,尤以双下肢为著,腱反射活跃,以下肢明显,肌力尚正常,可引出病理征,感觉共济正常。
辅助检查:头颅MRI未见明显异常。
四肢肌电图尚正常,血肝肾功能正常,血钾化验正常,血钙略低,胸片心电图正常。
请北京专家会诊,考虑定位于锥体束,临床表现以双下肢肌张力增高明显,结合其家族史,考虑定性诊断为遗传性痉挛性截瘫,为常染色体显性遗传,该病人为单纯型,治疗给予巴氯酚口服对症治疗减轻症状。
治疗效果:用药治疗五日后患者自觉症状有所减轻,肢体发僵有改善,身体不自主倾倒现象亦有所减少,查体肌张力有所降低。
遗传性痉挛性截瘫是一种遗传病,遗传的病因现在通过基因可以诊断出来,具有遗传性。
比如上一代的家长如果有遗传性痉挛截瘫,会通过基因将其遗传给下一代,下一代如果发生遗传性痉挛性截瘫,年龄大约在5岁左右,也是表现为下肢的瘫痪。
所谓的痉挛性瘫痪是下肢的伸肌、屈肌均发生痉挛,走路不稳或者根本不能走路,这就是遗传性痉挛性截瘫。
一、单纯型痉挛性截瘫较为常见。
(1)型:型患者于35岁前发病,单纯型HSP型患者大多数为男性,痉挛性截瘫发病年龄常在3~6岁或10岁以内。
(2)型:单纯型HSP型患者于35岁以后发病。
痉挛性截瘫发病年龄较晚,平均年龄18岁,锥体束征明显,常有感觉障碍和括约肌障碍。
多见于儿童期或青春期,但也可见于其他年龄段。
男性略多于女性。
常有阳性遗传家族史。
临床表现为缓慢进展的双下肢痉挛性肌无力,肌张力增高,腱反射活跃亢进,膝、踝阵挛,病理征阳性,呈剪刀样步态等。
可伴有视神经萎缩、视网膜色素变性、锥体外系症状、小脑性共济失调、感觉障碍、痴呆、精神发育迟滞、耳聋、肌萎缩、自主神经功能障碍等。
还可有弓形足畸形。
部分痉挛性截瘫家族有遗传早现现象。
二、复杂型痉挛性截瘫发病年龄一般为3~5岁,均为男性。
除痉挛性截瘫外,并有脊髓外受损表现。
根据合并症状的不同,构成几种类型(综合征或亚型)。
诊断的依据如下:发病年龄多在10~35岁。
可有家族史。
缓慢进行的双下肢痉挛性瘫痪及无力。
可伴有视神经萎缩、视网膜色素变性、小脑性共济失调、智力低下、肌萎缩等。
脑CT和(或)MRI多属正常。
剪刀步是痉挛性截瘫比较常见的一种疾病症状。
步剪刀步态是指主要步幅小而慢,双腿僵直,两脚向内交叉,两膝靠近,呈剪刀状,常见于脑性瘫痪、痉挛性截瘫等双侧脑和脊髓病变,其中最常见于痉挛性截瘫,那么这种情况一般都是大腿内收肌比较紧。
如果剪刀步不能及时治疗的话,那他的双腿打不开,肯定造成的结果就走不了路,走不了路的结果必然会造成肌肉萎缩。
肌肉萎缩之后,就失去了走路,行走的能力,对患者将来的生活就有很重要的影响了,可以说他不可能生活自理。
家族性遗传性痉挛性截瘫一例报告
刘成铮;王会云
【期刊名称】《天津医药》
【年(卷),期】1993(021)005
【摘要】患者男,42岁。
双腿行路不便2年于1992年4月27日入院。
4年来发现行路蹒跚,但无明显不适。
近2年感觉双腿不灵便,尤其是夜间行路时步态不稳,上楼梯或登高时有时双足发颤。
夜间静息时双下肢有不自主抽动,无麻木或疼痛感,骑自行车10~15公里尚不觉困难,双上肢无异常,二便正常。
吸烟20年,每日一盒,每日饮酒约100ml。
【总页数】2页(P313-314)
【作者】刘成铮;王会云
【作者单位】不详;不详
【正文语种】中文
【中图分类】R682.22
【相关文献】
1.遗传性痉挛性截瘫一家系报告 [J], 刘文波;刘洪举
2.遗传性痉挛性截瘫一家系报告 [J], 胡爱祥;张国荣
3.迟发型遗传性痉挛性截瘫(附一家系报告) [J], 李天德;戴兰香;白桦;孙桂秋;齐颖;张忠义;冀小平;刘振范
4.遗传性痉挛性截瘫——附1家系4例报告 [J], 吴绍长
5.遗传性痉挛性截瘫1家系6例报告 [J], 初成豪
因版权原因,仅展示原文概要,查看原文内容请购买。
遗传性痉挛性截瘫atlastin基因突变分析陈昕;唐北沙;赵国华;李凤有;沈璐;严新翔;刘小民【期刊名称】《临床神经病学杂志》【年(卷),期】2005(18)5【摘要】目的探讨中国人遗传性痉挛性截瘫(HSP)atlastin基因的突变特点,为HSP的基因诊断奠定基础.方法应用聚合酶链反应-单链构象多态性(PCR-SSCP)结合DNA序列分析方法,对来自全国20例常染色体显性遗传HSP家系的先证者和10例散发性HSP患者进行了atlastin基因突变分析.结果在20例常染色体显性遗传HSP家系的先证者和10例散发性HSP患者中均未发现异常SSCP条带,第7号外显子直接DNA序列分析亦无异常.结论atlastin基因突变可能在中国人HSP患者中少见.【总页数】2页(P330-331)【作者】陈昕;唐北沙;赵国华;李凤有;沈璐;严新翔;刘小民【作者单位】广东医学院附属医院神经内科;410008,长沙,中南大学湘雅医院神经内科;410008,长沙,中南大学湘雅医院神经内科;内蒙古医学院附属第三医院神经内科;410008,长沙,中南大学湘雅医院神经内科;410008,长沙,中南大学湘雅医院神经内科;410008,长沙,中南大学湘雅医院神经内科【正文语种】中文【中图分类】R744.7【相关文献】1.遗传性痉挛性截瘫伴胼胝体发育不良maspardin基因突变分析 [J], 沈璐;赵国华;唐北沙;刘小民;严新翔;胡正茂;陈昕;张付峰;夏昆2.遗传性痉挛性截瘫2型一家系PLP1基因突变分析 [J], 李东晓;王静敏;李礼;吴晔;姜玉武;吴希如3.中西医结合疗法对遗传性痉挛性截瘫的预后 [J], 杨宇琦;刘丽旭;胡雪艳;山磊;杨凌宇;吴晓莉;高飞;厉含之4.遗传性痉挛性截瘫IBA57基因新发突变1例 [J], 孙艳美;张宁;罗艳;李亚丽5.全外显子测序技术鉴定一个常染色体显性遗传性痉挛性截瘫3A型家系ATL1基因突变 [J], 郑备红;孙艳;邱淑敏;陈晓菁;杜生荣;杨春梅因版权原因,仅展示原文概要,查看原文内容请购买。
关于遗传性痉挛性截瘫新发基因突变1例患者病例报告及临床特点回顾
发表时间:2016-08-28T16:15:40.517Z 来源:《航空军医》2016年第13期作者:耿娜仲伟斌王晶[导读] 探讨1例遗传性痉挛性截瘫(HSP)患者的临床及基因突变的特点。
山东省威海市立医院神经内科 264200 【摘要】目的探讨1例遗传性痉挛性截瘫(HSP)患者的临床及基因突变的特点。
方法回顾性分析1例SPG患者的临床资料。
结果该患者为家族首发病例,父母均体健,有一女2岁,尚未出现临床症状,可能为基因突变个体,此患者临床表现为缓慢进展的双下肢无力,下肢肌张力明显增高,血液检查可见高同型半胱氨酸血症。
基因检测显示这1例患者spstin基因c.1173+1G>T /p.杂合,家族中其他成员无临床表现。
结论该例患者的遗传方式为常染色体显性遗传,临床表现为单纯性HSP,为spstin基因c.1173+1G>T /p.杂合,为致病点突变所致,既往未见文献报道。
【关键词】遗传性痉挛性截瘫;临床特点;基因突变遗传性痉挛性截瘫(HSP)是以双下肢进行性肌张力增高和无力为特征的神经系统遗传病,病理主要表现为脊髓双侧皮质脊髓束变性和脱髓鞘,患病率为2~9.6/10万[1]。
根据临床表现分为单纯型和复杂型,遗传方式有常染色体显性(AD)遗传、常染色体隐性(AR)遗传和X-连锁隐性(XR)遗传等多种方式;以AD遗传及SPG4基因型最常见,致病基因为spstin基因[2]。
我们对2015年3月入院1例青年男性患者进行基因突变分析发现为新发基因突变,进行临床资料分析。
1 临床资料
1.1 一般资料该患者来自山东省,汉族,家族首发病例。
1.2 临床表现该患者为青年男性,年龄为31岁,发病年龄为15岁,病程16年,以双下肢无力起病,最初为体育课长跑耐力差,病情进展缓慢。
发病16年仍独立行走,但跑步能力下降,逐渐出现痉挛步态。
查体示双下肢肌张力增高,腱反射亢进,双侧病理反射阳性,踝阵挛(++++),剪刀步态,弓形足。
双上肢均正常,无深浅感觉障碍、共济失调、肌肉萎缩及高级智能下降,符合单纯型SPG诊断标准。
血液检查可见高同型半胱氨酸血症,血常规、生化等未见明显异常。
1.3 spstin基因检测结果此例患者基因检测发现spstin基因c.1173+1G>T /p.杂合,该突变为点突变,可影响mRNA转录和翻译,既往未见文献报道。
2.讨论
HSP具有明显的临床和遗传异质性,目前已发现超过44个致病基因位点,其中21个致病基因位点已被克隆。
spstin基因含17个外显子,跨越约110kb。
spstin蛋白由616个氨基酸组成,是AAA蛋白家族成员之一,有3个结构域。
目前超过300种spstin基因突变已被发现,包括错义、无义、剪切位点、插入、缺失突变。
spstin基因突变主要引起单纯型。
该报道患者表现为缓慢进展的双下肢痉挛性截瘫,无脊髓外受损表现,符合单纯型HSP诊断标准。
spstin基因突变引起AD遗传性HSP中,剪接位点突变占所有spstin基因突变的17.4%[3]。
此外,有研究对中国22个AD遗传HSP家系和9例散发HSP患者进行spstin基因突变分析,发现了2个错义突变和1个缺失突变,未发现剪接位点突变[4]。
目前发现的大多数spstin蛋白突变均位于AAA区,事实上所有的病理性突变均最终影响到AAA区,引起spstin蛋白功能丧失。
本例患者存在2号染色体spstin基因c.1173+1G>T 杂合,为点突变,在与HGMD、ESP6500、千人基因组和dbSNP数据库等比较中,未见该突变的报道,此为新发现的突变。
生理状态下,spstin蛋白的N末端与微管结合,通过AAA区ATP酶活性调控ATP分解,从而使微管分解。
spstin蛋白突变后不能激活ATP酶,引起微管聚集,使长轴微管细胞骨架受损,产生轴突转运障碍而导致HSP。
2009年相关人士通过对spstin基因突变小鼠模拟人类spstin基因突变的致病机制发现,spstin蛋白突变后可特异性的破坏轴突内线粒体和膜性细胞器的顺向轴桨运输,引起线粒体、微管、神经丝等在轴突内聚集,轴突肿胀而发生转运障碍。
这样的改变也发生在人类spstin基因突变患者中,为spstin基因突变导致轴突转运障碍提供直接证据。
HSP还需与Arnold-Chiari畸形、颈椎病、多发性硬化、脑性瘫痪和遗传性运动神经元病等鉴别。
目前这例患者住院期间通过临床症状体征结合影像查体均可排除上述鉴别诊断。
从实验室检测方面,并非所有能检测到的基因突变都是致病性的,一个突变如确认为新发突变,是致病性的极强证据,此患者支持诊断。
基因诊断有助于患者确诊,但目前发病机制尚不清楚,临床表现复杂,目前尚无有效治疗方法,国内于炎冰等[5]对21例HSP患者采用改良选择性腰骶段脊神经后根部分切断术,术后随访26.3个月,术后即刻痉挛状态缓解率为100%,随访期间痉挛状态缓解率为91%,步态功能改善率为71%,可以看出短期疗效甚优,长期趋势有待进一步临床观察。
另外,建议积极开展遗传咨询。
参考文献:
[1] 庄俊鸿,徐坚,李小丽. 贵州部分少数民族遗传性痉挛性截瘫Spastin基因突变研究[J]. 中风与神经疾病杂志,2015,05:434-437.
[2] 李东晓,王静敏,李礼,吴晔,姜玉武,吴希如. 遗传性痉挛性截瘫2型一家系PLP1基因突变分析[J]. 山西医科大学学报,2014,05:353-356.
[3] 张文颖,欧阳志远,卢兴娇,岑志栋,罗巍. 遗传性痉挛性截瘫2家系的临床特点与spastin基因突变分析[J]. 中国临床神经科学,2012,05:521-526.
[4] 李小丽,楚兰,徐坚. 贵州少数民族遗传性痉挛性截瘫患者spastin基因突变的研究[J]. 临床神经病学杂志,2013,02:87-89.
[5]于炎冰,张黎,徐晓利,等.改良选择性腰骶段脊神经后根部分切断术治疗痉挛性截瘫的初步疗效报告[J]. 中华神经外科杂志,2009,7,25:601-603.。