第八单元_第二节_海水“晒盐”(1)海水晒盐的过程_粗盐的提纯.
- 格式:ppt
- 大小:1.46 MB
- 文档页数:4



§ 8—2 海水晒盐(1)【学习目标】1、通过海水晒盐的原理掌握物质结晶的方法。
2、掌握溶解度的概念,了解影响溶解度的因素。
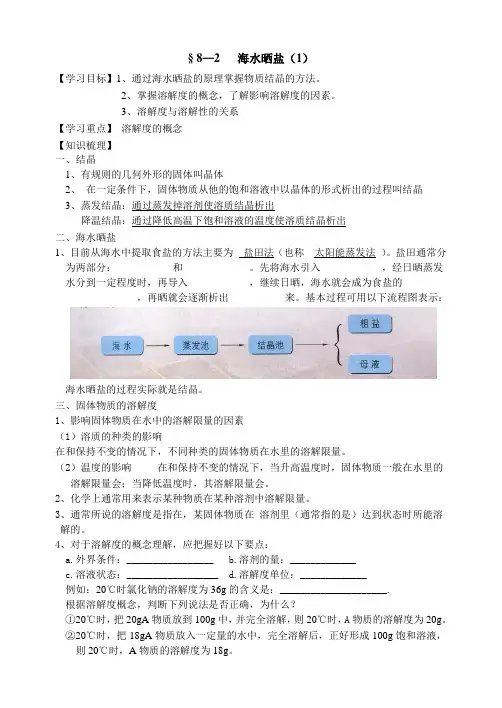
3、溶解度与溶解性的关系【学习重点】溶解度的概念【知识梳理】一、结晶1、有规则的几何外形的固体叫晶体2、在一定条件下,固体物质从他的饱和溶液中以晶体的形式析出的过程叫结晶3、蒸发结晶:通过蒸发掉溶剂使溶质结晶析出降温结晶:通过降低高温下饱和溶液的温度使溶质结晶析出二、海水晒盐1、目前从海水中提取食盐的方法主要为__盐田法(也称__太阳能蒸发法_)。
盐田通常分为两部分:___________和_____________。
先将海水引入____________,经日晒蒸发水分到一定程度时,再导入____________,继续日晒,海水就会成为食盐的______________,再晒就会逐渐析出___________来。
基本过程可用以下流程图表示:海水晒盐的过程实际就是结晶。
三、固体物质的溶解度1、影响固体物质在水中的溶解限量的因素(1)溶质的种类的影响在和保持不变的情况下,不同种类的固体物质在水里的溶解限量。
(2)温度的影响在和保持不变的情况下,当升高温度时,固体物质一般在水里的溶解限量会;当降低温度时,其溶解限量会。
2、化学上通常用来表示某种物质在某种溶剂中溶解限量。
3、通常所说的溶解度是指在,某固体物质在溶剂里(通常指的是)达到状态时所能溶解的。
4、对于溶解度的概念理解,应把握好以下要点:a.外界条件:_________________b.溶剂的量:_____________c.溶液状态:__________________d.溶解度单位:_____________例如:20℃时氯化钠的溶解度为36g的含义是:_____________________.根据溶解度概念,判断下列说法是否正确,为什么?①20℃时,把20gA物质放到100g中,并完全溶解,则20℃时,A物质的溶解度为20g。

第八章其次节海水晒盐—粗盐的提纯一、教学目标1.学问与技能:〔1〕.了解粗盐提纯的过程和操作步骤及试验要点;〔 2〕.理解粗盐提纯的原理,初步了解混合物分别的有关学问。
2.过程与方法〔1〕.学生通过亲自试验,初步学会溶解、过滤和蒸发等根本操作技能。
〔2〕.在完成试验的过程中,培育学生自主学习、动手操作、沟通合作等实践力量。
〔3〕.初步了解依据混合物的性质选择不同的方法。
3.情感、态度与价值观〔1〕初步学习用试验设计在化学学习和科学争论中的应用。
〔2 加深对科学本质的生疏,提高创精神实践力量。
二、教学重点难点重点:粗盐提纯的步骤,溶解、过滤、蒸发等操作中玻璃棒的作用,过滤的操作方法和蒸发操作难点:用沉淀法除去可溶性物质〔或离子〕。
三、教具预备:试验用品:蒸馏水、粗盐;托盘天平、烧杯、玻璃棒、蒸发皿、坩埚钳、酒精灯、漏斗、药匙、量筒、两个铁架台〔带铁圈〕、滤纸、。
多媒体用品:教学课件、实物投影四、教学过程设计第一板块:课引入【导语】大家见过这些工具吗?在我们生活中常用这些进展物质的分别,例如,可以用它筛选沙子,把粗沙放进筛子里,颗粒较小的沙子会透过这些小孔掉下来,颗粒较大的留在筛子里。
这种利用颗粒大小不同进展物质分别的思想在化学学习上也有应用。
海水晒得的“粗盐”中含有一些不溶性杂质,如泥沙;也含有一些可溶性杂质——Na2SO4、MgCl2、CaCl2等。
怎样除去粗盐中杂质,得到纯洁的食盐呢?今日我们学习粗盐的提纯。
其次板块:预习检查,探究知一.除去粗盐中的不溶性杂质〔一〕沟通争论1. 使用什么方法可将粗盐中的泥沙除去?生:粗盐中含有的泥沙等不溶于水,而氯化钠可溶于水,我们可以先把粗盐溶解,然后再过滤不就可以除去杂质了吗?【反思】为什么除去粗盐中不溶性杂质可以用过滤的方法?【讲解】食盐溶于水,氯离子和钠离子均匀的分散到水分子中间,它们的颗粒都很小,能透过滤纸上的小孔,而泥沙等难溶物颗粒较大,不能透过滤纸上的小孔,所以过滤就像用“筛子”筛东西一样,只不过这里的“筛子”是一张滤纸。



第八单元海水中的化学第一节海洋化学资源一、海水中的物质1.海水中的元素由多到少的顺序:O、H、Cl、Na、Mg2.海水中的物质由多到少的顺序:H2O、NaCl、MgCl23.从海水中提炼金属镁:发生的化学反应:①MgCl2 + Ca(OH)2 = Mg(OH)2↓ + CaCl2(从海水中分离出镁元素)②Mg(OH)2 + 2HCl = MgCl2 + 2H2O(转化成可电解的氯化镁)③MgCl2 通电Mg + Cl2↑二、海底矿物1.常规化石燃料:煤、石油、天然气2.新型矿产资源:天然气水合物——可燃冰(主要成分为甲烷):产生的能量多,污染少。
3.金属矿物:多金属结核——锰结核三、海水淡化1.常用方法:蒸馏是通过加热蒸发而将液体从溶液中提取出来的一种方法。
2.其他海水淡化的方法:“多级闪急蒸馏法”“结晶法”“膜法”第二节海水“晒盐”一、海水晒盐的过程盐田法(也称“太阳能蒸发法”):二、饱和溶液1.定义:在一定温度下,不能再继续溶解某种溶质的溶液,就是该溶质的饱和溶液。
注意:⑴饱和溶液只是针对某一种溶质来说的,对于其他溶质可能是不饱和溶液。
如饱和食盐水,对食盐来说是饱和溶液,而该溶液还可以继续溶解蔗糖。
(2)描述饱和溶液时,必须指明温度。
如“100g,20℃时氯化钠饱和溶液”,而不能说“100g氯化钠饱和溶液”。
2.判断:①根据食盐溶液中是否有未溶解固体来判断,如果有未溶解的食盐固体存在,则溶液达到饱和状态;②向溶液中加入少量溶质,如果溶液不能继续溶解溶质,则溶液达到饱和状态。
3.饱和溶液与不饱和溶液的转化三、固体物质溶解度的定义、影响因素以及相关的计算1.溶解度:在一定温度下,某固体物质在100g溶剂(通常为水)里达到饱和状态时所能溶解的质量。
注意:1)概念中的四要素:①一定温度;②100克溶剂;③饱和状态;④质量;⑤单位:克2)溶解度的含义。
20℃时,氯化铵的溶解度为37.2克,表示在20℃时,100g水中溶解37.2g 氯化铵达到饱和。

第3课时粗盐的提纯本节课主要介绍氧气的性质和一类重要的化学反应——化合反应,使学生初步了解物质间的转变,从而为学生学习化合反应、氧化反应等知识打下基础,也激发了学生对学习氧气的制法的迫切愿望,因此本节课起到承前启后的作用。
【教学目标】1.知识与技能(1)知道用什么试剂可以分别除去溶液中的Ca2+、Mg2+、SO2-4,并进一步知道如何选择试剂。
(2)知道除去可溶性杂质时,所加试剂一般要过量,过量的试剂也要在后续实验中除去。
(3)在加入两种或两种以上的试剂除杂时,知道如何考虑试剂加入的先后顺序。
2.过程与方法通过讨论、交流、评价等方式,在学习知识的过程中不断地发现问题、分析问题、解决问题。
3.情感、态度与价值观体会自主学习、探究学习、合作学习的乐趣。
【教学重点】用重结晶法提纯粗盐。
【教学难点】实验中杂质离子的检验及除杂质方法。
【教学准备】多媒体、PPT课件。
一、导入新课海水晒盐得到的是粗盐,往往含有可溶性杂质(如氯化镁、氯化钙等)和不溶性杂质(如泥沙),如何将粗盐进行分离和提纯,用于生产和生活中呢?这是本节课探究的主要内容。
二、推进新课活动1 复习巩固【投影】1.甲、乙两种晶体(不含结晶水)的溶解度曲线如图所示。
(1)t2℃时将20g甲加入100g水中,充分搅拌后的溶液是不饱和溶液(填“饱和”或“不饱和”)。
(2)将t2℃时乙的某不饱和溶液降温到t1℃时恰好达到饱状态,该过程中溶质的质量不变(填“减小”、“不变”或“增大”)。
(3)将t2℃时甲、乙晶体的饱和溶液分别蒸发等量水后,恢复至t1℃,甲溶液析出晶体的质量>(填“>”、“=”或“<”)乙溶液析出晶体的质量。
2.通过氯化钠的溶解度曲线,判断氯化钠的溶解度受温度变化的影响是大还是小?为什么要用蒸发结晶的方法从海水中得到食盐,而不用降温结晶的方法?(氯化钠的溶解度受温度变化的影响小。
从氯化钠溶解度曲线图中可知,氯化钠溶解度受温度影响变化不大,其高温饱和溶液降温后,析出氯化钠晶体的量少,大部分还溶解在水中。


第八单元第二节海水“晒盐”第四课时粗盐的提纯知识点:粗盐的提纯海水“晒盐”得到的粗盐中往往含有杂质(如氯化镁,氯化钙等)和杂质(如泥沙等),必须对其进行分离和提纯。
1、除去不溶性杂质——重结晶法步骤:、、①溶解:仪器:、。
玻璃棒的作用是。
②过滤:仪器:、、、、。
玻璃棒的作用是。
操作要点:、、。
一贴:滤纸要紧贴在漏斗内壁上,中间不要留有气泡;二低:液面要低于滤纸边缘,滤纸边缘低于漏斗边缘;三靠:玻璃棒要紧靠过滤器中三层滤纸处,盛混合液的烧杯口要紧靠在玻璃棒上,漏斗的末端要紧靠在承接滤液的烧杯内壁上。
③蒸发:仪器:、、、。
玻璃棒的作用是;操作要点:当出现大量固体时,停止加热,利用余热把食盐烘干(不能完全蒸干)2、除去可溶性杂质重结晶后的食盐中仍含有较多的可溶性杂质(如Na2SO4、CaCl2、MgCl2等),利用化学方法将它们除去而得到精盐。
通过反应,使离子形成沉淀。
(形成沉淀后再和)实验操作相关反应的化学方程式作用1 向食盐溶液中依次加入过量的BaCl2、NaOH、Na2CO3①②③④将杂质转化为沉淀2 过滤无除去沉淀进行综合利用的示意图:(1)在苦卤制镁的过程中加入了石灰乳(主要成分是氢氧化钙),石灰乳是用生石灰制得的,请写出制取石灰乳的化学方程式________________________。
(2)在制备精盐的过程中,氯化钡和碳酸钠溶液的添加顺序是否可以颠倒,理由是__________________;(3)在利用粗盐制备精盐过程的第⑥步操作中,加入适量盐酸的目的是_______________________________。
9.在“重结晶法提纯粗盐”的实验中,用蒸发皿蒸发滤液时,下列操作正确的是()A. 把浑浊的滤液倒入蒸发皿里,进行加热B. 等到开始出现固体时,用玻璃棒不断搅拌液体C. 等到出现多量固体时,停止加热D. 待滤液完全蒸干后,停止加热10.某校化学活动小组査阅资料发现,粗盐中除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质,他们要除去杂质得到精盐,设计了下列实验方案:序号①〜⑧表示实验操作,用于沉淀的试剂稍过量。
个性化辅导教案教师张敏科目化学时间2020年2月11号学生陈星妤年级初三学校德阳一中授课内容海洋化学资源难度星级★★★★教学内容课堂主要内容:1、掌握海水晒盐的过程2、掌握溶解度的相关知识点3.掌握粗盐提纯的步骤内容详解:第八单元海水中的化学第二节海水“晒盐”知识点一、海水晒盐的过程。
阅读课本P35-37,完成下列题目:1、海水晒盐的具体生产流程为:2、海水“晒盐”的原理是:利用把海水变成,继续蒸发水,结晶析出。
3.结晶:定义___________________________________________________________4、固体物质从它的中以的形式析出的过程叫做结晶。
使溶液中的溶剂不断减少,溶质的质量分数逐渐,直至形成,继而析出,这便是蒸发结晶,它是结晶的途径之一。
【针对性训练一】1.(2011.龙岩市) (6分)在部分地区发生“抢盐”风波后,我国政府及时发布公告称:核事故对我国海域污染可能性极小,且我国85%以上的食盐是湖盐(来自内陆盐湖)而不是海盐。
已知:盐湖原盐主要成分是NaCl,还含有泥沙和芒硝等。
右图为芒硝和氯化钠的溶解度曲线。
请回答:(1)为除去原盐中的泥沙,可先将原盐溶解,再通过操作除去。
(3)可用“夏季采盐,冬季捞硝”的方法来分离湖水中的芒硝和食盐。
这种方法的化学原理。
知识点二:溶解度。
溶解度:在一定温度下,某固态物质在溶剂(通常为水)里,达到状态时所能溶解的质量。
(1)四个要点:①条件:在一定下,说溶解度必须指明;②标准:溶剂的质量必须是克;③状态:溶液必须,也就是该条件下物质的最大溶解限量;④单位:一般以为单位。
(2)含义:NaCl在20℃时溶解度为36克,它的含义是:①在20℃,100克水中最多溶解NaCl 克,②在20℃,向100克水中加入克NaCl,溶液恰好,③在20℃,要使100克水变为饱和溶液,最少加入NaCl 克。
④在20℃,NaCl饱和溶液中,溶质、溶剂、溶液的质量比为。