气体分子热运动速率和能量的统计分布律
- 格式:doc
- 大小:347.50 KB
- 文档页数:14


《气体分子运动的统计规律》讲义一、气体分子的热运动在我们的日常生活中,气体无处不在,比如我们呼吸的空气、充满气球的氢气等。
那么,这些气体分子是如何运动的呢?气体分子处于永不停息的无规则运动之中,这种运动被称为热运动。
想象一下,在一个封闭的容器中,充满了气体分子,它们就像一群顽皮的孩子,四处乱跑,相互碰撞,没有固定的方向和轨迹。
气体分子的热运动具有以下几个特点:速度的多样性:不同的气体分子具有不同的速度。
有的分子运动速度快,有的则慢。
无规则性:它们的运动方向是随机的,无法预测下一刻某个分子会往哪个方向跑。
频繁的碰撞:分子之间会不断地发生碰撞,这使得它们的运动状态不断改变。
二、气体分子运动的统计规律既然气体分子的运动如此复杂和无规则,那我们要如何去描述和理解它们的整体行为呢?这就需要依靠统计规律。
什么是统计规律呢?简单来说,就是通过对大量个体行为的观察和分析,总结出的总体的、平均的规律。
对于气体分子,我们无法确切知道每个分子在每一时刻的具体运动状态,但我们可以通过统计方法来了解它们的一些总体特征。
比如,我们可以统计在一定温度和压强下,气体分子的速度分布情况。
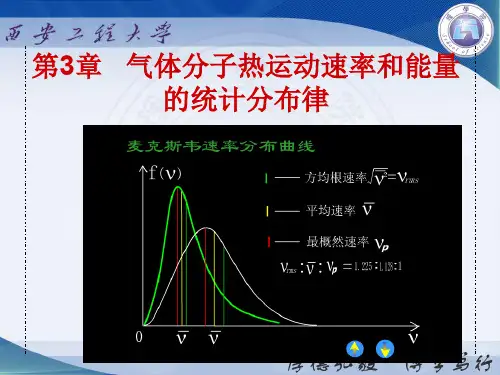
麦克斯韦速度分布律就是描述气体分子速度分布的重要规律。
它告诉我们,在一定条件下,气体分子的速度分布呈现出一定的规律性,速度较小和较大的分子较少,而具有中等速度的分子较多。
再比如,气体分子对容器壁的压强,也是通过对大量分子撞击容器壁的行为进行统计得出的。
三、麦克斯韦速度分布律麦克斯韦速度分布律是描述气体分子运动速度分布的关键规律。
假设在一个容器中充满了理想气体,处于平衡态。
麦克斯韦速度分布律表明,分子速度在三个方向上(x、y、z)的分量的分布都是独立的,且满足一定的概率分布。
具体来说,速度分量 vx 的分布函数为 f(vx) , vy 和 vz 的分布函数类似。
通过对这些分布函数的积分,可以得到分子速度的大小 v 的分布函数 f(v) 。
麦克斯韦速度分布律在许多方面都有重要的应用。


![热学[李椿 章立源 钱尚武]习题解答_第三章气体分子热运动速率与能量的统计分布律](https://uimg.taocdn.com/581192a543323968001c927e.webp)
第 三 章 气体分子热运动速率和能量的统计分布律3-1 设有一群粒子按速率分布如下:试求(1)平均速率V ;(2)方均根速率2V (3)最可几速率Vp解:(1)平均速率:18.32864200.5200.4800.3600.2400.12≅++++⨯+⨯+⨯+⨯+⨯=V (m/s)(2) 方均根速率37.322≅∑∑=ii i N V N V(m/s)3-2 计算300K 时,氧分子的最可几速率、平均速率和方均根速率。
解:s m RTV P /395103230031.8223=⨯⨯⨯==-μs m RTV /446103214.330031.8883=⨯⨯⨯⨯==-πμs m RTV/483103230031.83332=⨯⨯⨯==-μ3-3 计算氧分子的最可几速率,设氧气的温度为100K 、1000K 和10000K 。
解:μRTV P 2=代入数据则分别为:T=100K 时 s m V P /1028.22⨯= T=1000K 时 s m V P /1021.72⨯= T=10000K 时 s m V P /1028.23⨯=3-4 某种气体分子在温度T 1时的方均根速率等于温度T 2时的平均速率,求T 2/T 1。
解:因μRTV32=πμ28RT V =由题意得:μRT3πμ28RT =∴T 2/T 1=83π3-5 求0℃时1.0cm 3氮气中速率在500m/s 到501m/s 之间的分子数(在计算中可将dv 近似地取为△v=1m/s )解:设1.0cm 3氮气中分子数为N ,速率在500~501m/s 之间内的分子数为△N ,由麦氏速率分布律:△ N=V V e KTm N V KTm∆⋅⋅⋅-22232)2(4ππ ∵ V p2= 2KTm ,代入上式 △N=VV V ppe V V VN∆--⋅⋅222214ρπ因500到501相差很小,故在该速率区间取分子速率V =500m/s , 又s m V P /402102827331.823≅⨯⨯⨯=- △V=1m/s (vv p=)代入计算得:△N=×10-3N 个3-6 设氮气的温度为300℃,求速率在3000m/s 到3010m/s 之间的分子数△N 1与速率在1500m/s 到1510m/s 之间的分子数△N 2之比。




第 三 章 气体分子热运动速率和能量的统计分布律3-1 设有一群粒子按速率分布如下:试求(1)平均速率V ;(2)方均根速率2V (3)最可几速率Vp解:(1)平均速率:18.32864200.5200.4800.3600.2400.12≅++++⨯+⨯+⨯+⨯+⨯=V (m/s)(2) 方均根速率37.322≅∑∑=ii i N V N V(m/s)3-2 计算300K 时,氧分子的最可几速率、平均速率和方均根速率。
解:s m RTV P /395103230031.8223=⨯⨯⨯==-μs m RTV /446103214.330031.8883=⨯⨯⨯⨯==-πμs m RTV/483103230031.83332=⨯⨯⨯==-μ3-3 计算氧分子的最可几速率,设氧气的温度为100K 、1000K 和10000K 。
解:μRTV P 2=代入数据则分别为:T=100K 时 s m V P /1028.22⨯= T=1000K 时 s m V P /1021.72⨯= T=10000K 时 s m V P /1028.23⨯=3-4 某种气体分子在温度T 1时的方均根速率等于温度T 2时的平均速率,求T 2/T 1。
解:因μRTV32=πμ28RT V =由题意得:μRT3πμ28RT =∴T 2/T 1=83π3-5 求0℃时1.0cm 3氮气中速率在500m/s 到501m/s 之间的分子数(在计算中可将dv 近似地取为△v=1m/s )解:设1.0cm 3氮气中分子数为N ,速率在500~501m/s 之间内的分子数为△N ,由麦氏速率分布律:△ N=V V e KTm N V KTm∆⋅⋅⋅-22232)2(4ππ ∵ V p2= 2KTm ,代入上式△N=VV V ppe V V VN∆--⋅⋅222214ρπ因500到501相差很小,故在该速率区间取分子速率V =500m/s , 又s m V P /402102827331.823≅⨯⨯⨯=- △V=1m/s (vv p =1.24)代入计算得:△N=1.86×10-3N 个3-6 设氮气的温度为300℃,求速率在3000m/s 到3010m/s 之间的分子数△N 1与速率在1500m/s 到1510m/s 之间的分子数△N 2之比。

《气体分子运动的统计规律》速率分布曲线《气体分子运动的统计规律——速率分布曲线》当我们谈论气体时,往往会想到它们的自由扩散、压力和温度等特性。
而这些宏观现象的背后,其实是无数气体分子微观运动的结果。
在研究气体分子的运动时,速率分布曲线是一个非常重要的概念。
要理解速率分布曲线,首先得明白气体分子的运动是极其复杂和无序的。
想象一下,在一个封闭的容器中,充满了大量的气体分子,它们以不同的速度和方向在空间中自由移动,相互碰撞,不断改变着运动状态。
那么,这些分子的速率是如何分布的呢?简单来说,速率分布曲线就是用来描述在一定温度下,气体分子速率的分布情况的图形。
假设我们能够测量容器中每一个气体分子的速率,并将它们按照大小进行分类统计。
我们会发现,大多数分子的速率并不是集中在某个特定的值上,而是呈现出一种“中间多、两头少”的分布特点。
具体来看,速率较小和速率较大的分子数量相对较少,而速率处于中间某个范围内的分子数量则相对较多。
这就像是在一场考试中,成绩特别好和特别差的学生是少数,成绩中等的学生占了大多数。
为什么会出现这样的分布呢?这其实与分子的热运动有关。
在一定温度下,分子具有一定的平均动能。
但是由于分子之间的碰撞和能量交换,使得它们的速率存在差异。
速率分布曲线通常是一条光滑的曲线。
它的横坐标表示分子的速率,纵坐标则表示对应速率的分子数占总分子数的比例。
通过这条曲线,我们可以得到很多有用的信息。
比如,曲线的峰值对应的速率,就是在这个温度下出现概率最大的速率,我们称之为最概然速率。
它反映了在该温度下分子运动的一种典型情况。
另外,曲线下的面积表示分子的总数。
这意味着,如果我们对曲线进行积分,就可以得到分子的总数。
不同温度下的速率分布曲线也是有所不同的。
一般来说,温度越高,曲线会变得更加平坦和宽阔。
这是因为温度升高,分子的平均动能增大,运动速度加快,速率的分布范围也就更广了。
除了温度,气体的种类和压强等因素也会对速率分布曲线产生影响。
第 二 章 分子动理学理论的平衡态理论2-1 设有一群粒子按速率分布如下:试求(1)平均速率V ;(2)方均根速率2V(3)最可几速率Vp解:(1)平均速率:18.32864200.5200.4800.3600.2400.12≅++++⨯+⨯+⨯+⨯+⨯=V (m/s)(2) 方均根速率37.322≅∑∑=iii NV N V(m/s)2-2 计算300K 时,氧分子的最可几速率、平均速率和方均根速率。
解:sm RTV P/395103230031.8223=⨯⨯⨯==-μsm RTV /446103214.330031.8883=⨯⨯⨯⨯==-πμsm RTV /483103230031.83332=⨯⨯⨯==-μ2-3 计算氧分子的最可几速率,设氧气的温度为100K 、1000K 和10000K 。
解:μRTV P2=代入数据则分别为:T=100K 时 sm V P /1028.22⨯= T=1000K 时 sm V P/1021.72⨯= T=10000K 时 sm V P/1028.23⨯=2-4 某种气体分子在温度T 1时的方均根速率等于温度T 2时的平均速率,求T 2/T 1。
解:因μRTV32=πμ28RTV=由题意得:μRT3πμ28RT=∴T 2/T 1=83π2-5 求0℃时1.0cm 3氮气中速率在500m/s 到501m/s 之间的分子数(在计算中可将dv 近似地取为△v=1m/s )解:设1.0cm 3氮气中分子数为N ,速率在500~501m/s 之间内的分子数为△N ,由麦氏速率分布律: △ N=VVeKTm NVKTm ∆⋅⋅⋅-22232)2(4ππ∵ V p2= 2KT m ,代入上式△N=VVV ppeVV VN∆--⋅⋅222214ρπ因500到501相差很小,故在该速率区间取分子速率V =500m/s , 又sm V P/402102827331.823≅⨯⨯⨯=- △V=1m/s(vv p =1.24)代入计算得:△N=1.86×10-3N 个2-6 设氮气的温度为300℃,求速率在3000m/s 到3010m/s 之间的分子数△N 1与速率在1500m/s 到1510m/s 之间的分子数△N 2之比。
解: 取分子速率为V 1=3000m/s V 2=1500m/s, △V 1=△V 2=10m/s由5题计算过程可得: △V 1=12212214V VV pppeV V VN∆--⋅⋅π△N 2=22222214V VV pppeVV VN∆--⋅⋅π∴ △N/△N 2=2121)(21)(21)()(pppVV VV peVV eVV --⋅其中V P =331018.210257331.82⨯=⨯⨯⨯-m/sv 1v p =1.375,v 2v p =0.687∴969.0687.0375.122687.02375.1221≅⨯⨯=∆∆--ee NN解法2:若考虑△V 1=△V 2=10m/s 比较大,可不用近似法,用积分法求△N 1,△N 2dN=dVVVV pPeVN22234--⋅π△N 1=⎰⎰⎰-=122100V V V V dN dN dN △N 2=⎰⎰⎰-=34430V V V V dNdN dN令X i =v iv pi=1、2、3、4利用16题结果:22)([0iix i i V ex x erf N dN--=⎰π∴ △N 1=]2)([]2)([2122112x x i ex x erf N ex x erfN -----ππ(1)△N 2=]2)([]2)([23243344x x ex x erf N ex x erfN -----ππ(2)其中V P =sm RT/10182.223⨯=μ375.111==P V V x 379.122==PV V x687.033==PV V x 6722.044==PV V x查误差函数表得:erf(x 1)=0.9482 erf(x 2)=0.9489 erf(x 3)=0.6687 erf(x 4)=0.6722将数字代入(1)、(2)计算,再求得:703.021=∆∆NN2-7 试就下列几种情况,求气体分子数占总分子数的比率: (1) 速率在区间v p ~1.0v p 1内 (2) 速度分量v x 在区间v p ~1.0v p 1内(3) 速度分量v p 、v p 、v p 同时在区间v p ~1.0v p 1内解:设气体分子总数为N ,在三种情况下的分子数分别为△N 1、△N 2、△N 3 (1) 由麦氏速率分布律: △ N=⎰⎰⎰-=1221V V V V dNdN dN 令v 2=1.01v p ,v i =v p ,pi i v v x =,则111==pv v x ,01.122==pv v x ,利用16题结果可得;2122112212)(2)(x x ex x erf ex x erf NN --+--=∆ππ查误差函数表:erf (x 1)=0.8427 erf (x 2)=0.8468 ∴008.01=∆NN(2) 由麦氏速率分布律:xvv pxdvevNdNpx 221--=π∴xvv v pxvv v pdve vNdve vNN px px 2122)(1)(12----⎰⎰-=∆ππ)(])(exp[1)(])(exp[122212px px vv pxpx vv vv d vv vv d vv NN pp⎰⎰---=∆ππ令px v v x=, 111==pv v x ,01.122==p v v x∴dxe dx e NN xx xx ⋅-=∆--⎰⎰2122211ππ利用误差函数:dxx xp e x erf x)(2)(2-=⎰π%21.0]8427.08468.0[21)()([21122=-=-=∆x erf x erf N N(3)令px v v x=,由麦氏速度分布律得:zyxvv v v pdvdvdve vNdN pzy x ⋅=++--2222331ππ8332333108.0)002.0()(][)1(211222---⨯==∆=-=∆⎰⎰NN dx edx eN N x x x x π2-8根据麦克斯韦速率分布函数,计算足够多的点,以dN/dv 为纵坐标,v 为横坐标,作1摩尔氧气在100K 和400K 时的分子速率分布曲线。
解:由麦氏速率分布律得:22232)2(4ve KTm N dvdN vKTm -=ππ将π=3.14,N=N A =6.02×1023T=100K m=32×10-3代入上式得到常数: A=eKTm N A23)2(4ππ KTm B2=∴22VAe dvdN BV⋅=- (1)为了避免麻烦和突出分析问题方法,我们只做如下讨论:由麦氏速率分布律我们知道,单位速率区间分布的分子数随速率的变化,必然在最可几速率处取极大值,极大值为: 令22VAedvdN y BV⋅==-则)]2(2[222=-⋅+⋅=--BV eV V e A dv dy BVBV得BV VP 1==又在V=0时,y=0,V →∞时,y →0 又mKT B V P 11121==mKT B V P 22221==∵T 1=100K <T 2=400K ∴1P V <2P V 由此作出草图2-9根据麦克斯韦速率分布律,求速率倒数的平均值v 1。
解:VKT m emKT KTm VKTm d VemKT KT m VdVeKT m dvV f VvKTmV KTm KTmvππππππππ42)()2(4)2()()2(4)2(4)(1102232222322322==⋅-⋅=-⋅⋅-===∞-∞-∞-∞⎰⎰⎰2-10一容器的器壁上开有一直径为0.20mm 的小圆孔,容器贮有100℃的水银,容器外被抽成真空,已知水银在此温度下的蒸汽压为0.28mmHg 。
(1) 求容器内水银蒸汽分子的平均速率。
(2) 每小时有多少克水银从小孔逸出?解:(1))/(1098.11020114.337331.88823s m RTV ⨯=⨯⨯⨯⨯==-πμ(2)逸出分子数就是与小孔处应相碰的分子数,所以每小时从小孔逸出的分子数为:ts V n N ⋅⋅=41其中KTV P V n ⋅=4141是每秒和器壁单位面积碰撞的分子数,2)2(d sπ=是小孔面积,t=3600s ,故ts V KTP N ⋅⋅⋅=41,代入数据得:N=4.05×1019(个) ∴)(1035.11005.41002.610201219233g N NmNMA--⨯=⨯⨯⨯⨯===μ2-11如图3-11,一容器被一隔板分成两部分,其中气体的压强,分子数密度分别为p 1、n 1、p 2、n 2。
两部分气体的温度相同,都等于T 。
摩尔质量也相同,均为μ。
试证明:如隔板上有一面积为A 的小孔,则每秒通过小孔的气体质量为:)(221P P A RTM-=πμ证明:设p 1>p 2,通过小孔的分子数相当于和面积为A 的器壁碰撞的分子数。
从1跑到2的分子数:tA V n N ⋅⋅=11141 从2跑到1的分子数:tA V n N ⋅⋅=22241实际通过小孔的分子数:(从1转移到2))221121(41Vn V n At NN N -=-=∆因t=1秒,KTP n =,πμRTV8=T 1=T 2=T∴)(2)(841)(841212121P P A RTP P RTRTAKT P KTP RTAmn m M -=-=-==∆=πμπμμπμ若P 2>P 1,则M <0,表示分子实际是从2向1转移。
2-12 有N 个粒子,其速率分布函数为)0()(0〉〉==v v C NdvdN v f)(0)(0v v v f 〈=(1)作速率分布曲线。
(2)由N 和v 0求常数C 。
(3)求粒子的平均速率。
解:(1) )0()(0〉〉=v v C v f)(0)(0v v v f 〈=得速率分布曲线如图示(2)∵1)(0=⎰∞dv v f∴10)(0==⎰⎰∞v cdv dv v f即1=cv 01v c=(3)0202121)(v cv dv v vf v===⎰∞2-13 N 个假想的气体分子,其速率分布如图3-13所示(当v >v 0时,粒子数为零)。
(1)由N 和V 0求a 。
(2)求速率在1.5V 0到2.0V 0之间的分子数。
(3) 求分子的平均速率。
解:由图得分子的速率分布函数: NV Va 0 (00V V 〈〈)Na (02VV V 〈〈)f(v)= 0 (02V V 〉)(1) ∵dvV NfdN)(=∴aV aVV V a advdV V Va dV V f N NVVV0020202321)(0=+=+==⎰⎰⎰∞32V N a =(2) 速率在1.5V 0到2.0V 0之间的分子数33221)5.12()(000025.125.10N V V N V V a adVdV V NfN VVVV=⋅=-===∆⎰⎰2-14 证明:麦克斯韦速率分布函数可以写作:)(2x F dxdN =其中pvv x=mKT v p2=2224)(xexNx F -⋅=π证明:dxx eNvv d ve Ndvv e vN dvv eKTm N dvv Nf dNxpvpvv vv p KTmvpp222323222322222224)(44)2(4)(------⋅=⋅=⋅⋅===ππππππ∴)(4222x F xeNdxdN x=⋅⋅=-π2-15设气体分子的总数为N ,试证明速度的x 分量大于某一给定值v x 的分子数为:)](1[2x erf N N xv-=∆∞∝(提示:速度的x 分量在0到∞之间的分子数为2N )证明:由于速度的x 分量在区间v x ~v x +dv x 内的分子数为:xvv pxdvevNdNvpx ⋅=--221π故在v x ~∞范围内的分子数为:⎰⎰⎰-==∆∞∞∞→xxxxx vv xv v V dNdNdNN由题意:2N dNxv =⎰∞xvv v pvv dve vNdNpx xxx⋅=--⎰⎰22010π令px vv x=利用误差函数得:)(2222x erf N dxeN dN xxvv xx=⋅=⎰⎰-π∴)](1[2)(22x erf N x erf N N Nx V -=-=∞→2-16 设气体分子的总数为N ,试证明速率在0到任一给定值v 之间的分子数为:]2)([20xvex erf N N-→-=∆π其中pvv x=,v p 为最可几速率。