气体分子热运动的统计规律
- 格式:doc
- 大小:500.01 KB
- 文档页数:14

第7章 气体动理论7.1基本要求1.理解平衡态、物态参量、温度等概念,掌握理想气体物态方程的物理意义及应用。
2.了解气体分子热运动的统计规律性,理解理想气体的压强公式和温度公式的统计意义及微观本质,并能熟练应用。
3.理解自由度和内能的概念,掌握能量按自由度均分定理。
掌握理想气体的内能公式并能熟练应用。
4.理解麦克斯韦气体分子速率分布律、速率分布函数及分子速率分布曲线的物理意义,掌握气体分子热运动的平均速率、方均根速率和最概然速率的求法和意义。
5.了解气体分子平均碰撞频率及平均自由程的物理意义和计算公式。
7.2基本概念1 平衡态系统在不受外界的影响下,宏观性质不随时间变化的状态。
2 物态参量描述一定质量的理想气体在平衡态时的宏观性质的物理量,包括压强p 、体积V 和温度T 3 温度宏观上反映物体的冷热程度,微观上反映气体分子无规则热运动的剧烈程度。
4 自由度确定一个物体在空间的位置所需要的独立坐标数目,用字母i 表示。
5 内能理想气体的内能就是气体内所有分子的动能之和,即2iE RT ν= 6 最概然速率速率分布函数取极大值时所对应的速率,用p υ表示,p υ==≈其物理意义为在一定温度下,分布在速率p υ附近的单位速率区间内的分子在总分子数中所占的百分比最大。
7 平均速率各个分子速率的统计平均值,用υ表示,υ==≈8 方均根速率各个分子速率的平方平均值的算术平方根,用rms υ表示,rms υ==≈ 9 平均碰撞频率和平均自由程平均碰撞频率Z 是指单位时间内一个分子和其他分子平均碰撞的次数;平均自由程λ是每两次碰撞之间一个分子自由运动的平均路程,两者的关系式为:Zυλ==或λ=7.3基本规律1 理想气体的物态方程pV RT ν=或'm pV RT M=pV NkT =或p nkT =2 理想气体的压强公式23k p n ε=3 理想气体的温度公式21322k m kT ευ==4 能量按自由度均分定理在温度为T 的平衡态下,气体分子任何一个自由度的平均动能都相等,均为12kT 5 麦克斯韦气体分子速率分布律 (1)速率分布函数()dNf Nd υυ=表示在速率υ附近单位速率区间内的分子数占总分子数的百分比或任一单个分子在速率υ附近单位速率区间内出现的概率,又称为概率密度。



气体分子运动的统计分析气体是由大量分子组成的,这些分子在空间中运动着。
气体分子的运动是随机的、无序的,并受到各种因素的影响。
然而,通过对气体分子运动的统计分析,我们可以揭示出一些有趣的规律和现象。
首先,让我们来看看气体分子的速度分布。
根据金-蒙塔卡洛分布定律,气体分子的速度分布近似服从麦克斯韦尔速度分布定律。
简单地说,这个定律告诉我们,气体分子的速度并不是完全随机的,而是呈现一定的概率分布。
高速分子的数量比低速分子的数量少,因此大部分分子的速度较低,而只有很少一部分分子的速度较高。
当我们观察一个气体系统时,可以看到分子之间发生着碰撞。
这些碰撞不仅改变了分子的运动方向和速度,还决定了气体的温度。
根据动量守恒定律和能量守恒定律,我们可以推导出气体分子之间碰撞的一些规律。
例如,当两个分子碰撞时,它们的总动量和总能量保持不变。
这意味着,如果一个分子的速度增加,那么碰撞对象的速度就会相应地减小。
这种速度的交换使得气体整体上保持了热平衡,即温度恒定。
除了速度分布和碰撞规律,气体分子还有一个重要的特性,即分子之间的间距。
气体分子的间距是非常大的,相比于分子的大小来说。
这意味着气体分子之间的相互作用力十分微弱,可以近似地看作是自由运动的粒子。
这种近似成为理想气体模型,它在研究气体行为时非常有用。
通过对气体分子的统计分析,我们可以推导出一些重要的公式和关系,例如理想气体状态方程和玻尔兹曼方程。
理想气体状态方程描述了气体的压强、体积和温度之间的关系。
根据这个方程,我们可以计算出气体的体积或温度在一定条件下的变化情况。
而玻尔兹曼方程则描述了气体分子的分布情况,即分子在不同速度范围内的概率密度分布。
通过这个方程,我们可以预测在给定条件下,高速或低速分子的比例。
除了以上几个基本的统计分析方法外,还有很多其他的技术和方法可以用来研究气体分子的运动。
例如,分子动力学模拟可以通过计算机模拟气体分子的运动轨迹,从而研究气体的宏观性质。



气体热现象的微观意义【学习目标】1.知道气体分子的运动特点,知道气体分子的运动遵循统计规律.2.知道气体压强的微观意义.3.知道三个气体实验定律的微观解释.4.了解气体压强公式和推导过程.【要点梳理】要点一、统计规律1.统计规律由于物体是由数量极多的分子组成的,这些分子并没有统一的运动步调,单独看来,各个分子的运动都是不规则的,带有偶然性,但从总体来看,大量分子的运动却有一定的规律,这种规律叫做统计规律.2.分子的分布密度分子的个数与它们所占空间的体积之比叫做分子的分布密度,通常用n 表示.3.气体分子运动的特点(1)气体分子之间的距离很大,失约是分子直径的10倍.因此除了相互碰撞或者跟器壁碰撞外,气体分子不受力的作用,在空间自由移动.(2)分子的运动杂乱无章,在某一时刻,向着任何一个方向运动的分子都有,而且向各个方向运动的气体分子数目都相等.(3)每个气体分子都在做永不停息的运动,常温下大多数气体分子的速率都达到数百米每秒,在数量级上相当于子弹的速率.(4)气体分子的热运动与温度的关系○1温度越高,分子的热运动越激烈.○2理想气体的热力学温度T 与分子的平均动能k E 成正比,即:k T aE (式中a 是比例常数),因此可以说,温度是分子平均动能的标志.要点诠释:理想气体没有分子势能,所以其内能仅由温度决定,温度越高,内能越大,温度越低,内能越小.要点二、对气体的微观解释1.气体压强的微观意义(1)气体压强的大小等于气体作用在器壁单位面积上的压力.(2)产生原因:大量气体分子无规则运动碰撞器壁,形成对器壁各处均匀的持续的压力而产生.(3)决定因素:一定气体的压强大小,微观上决定于分子的平均动能和单位体积内的分子数;宏观上决定于气体的温度T 和体积V2.对气体实验定律的微观解释(1)一定质量的气体,分子的总数是一定的,在温度保持不变时,分子的平均动能保持不变,气体的体积减小到原来的几分之一,气体的密度就增大到几倍,因此压强就增大到几倍,反之亦然,所以气体压强与体积成反比,这就是玻意耳定律.(2)一定质量的气体,体积保持不变而温度升高时,分子的平均动能增大,因而气体压强增大,温度降低时,情况相反,这就是查理定律所表达的内容.(3)一定质量的气体,温度升高时要保持压强不变,只有增大气体体积,减小分子的分布密度才行,这就是盖一吕萨克定律所表达的内容.要点三、分子的平均动能1.分子的平均动能物体分子动能的平均值叫分子平均动能.温度是分子平均动能的标志,温度越高,分子平均动能越大.物体内部各个分子的运动速率是不相同的,所以分子的动能也不相等.在研究热现象时,有意义的不是一个分子的动能,而是物体内所有分子动能的平均值——分子平均动能.物体的温度是大量分子热运动剧烈程度的特征,分子热运动越剧烈,物体的温度越高,分子平均动能就越大,所以说温度是分子平均动能的标志这是对温度这一概念从物体的冷热程度的简单认识,进一步深化到它的微观含义、本质的含义.2.判断气体分子平均动能变化的方法(1)判断气体的平均动能的变化,关键是判断气体温度的变化,因为温度是气体分子平均动能的标志.(2)理解气体实验定律的微观解释关键在于理解压强的微观意义.要点四、宏观、微观的区别与联系1.宏观、微观的区别与联系从宏观上看,一定质量的气体仅温度升高或仅体积减小都会使压强增大,从微观上看,这两种情况有没有什么区别?分析:因为一定质量的气体的压强是由单位体积内的分子数和气体的温度决定的.气体温度升高,即气体分子运动加剧,分子的平均速率增大,分子撞击器壁的作用力增大,故压强增大.气体体积减小时,虽然分子的平均速率不变,分子对容器的撞击力不变,但单位体积内的分子数增多,单位时间内撞击器壁的分子数增多,故压强增大,所以这两种情况下在微观上是有区别的.2.气体压强的公式现在从分子动理论的观点推导气体压强的公式.设想有一个向右运动的分子与器壁发生碰撞(图8-5-1),碰撞前的速率为v ,碰撞前的动量为mv ,碰撞后向左运动。

初识分子热运动的统计规律-教科版选修3-3教案一、教学目标1.了解分子热运动的基本概念及其统计规律;2.掌握理论计算与实验测量的基本方法;3.能够熟练运用理论计算与实验测量解决分子热运动的相关问题;4.培养学生分析问题、创新思维、协作能力和实验操作能力。
二、知识概括1. 分子热运动物体内部的分子具有热运动,它们不断地碰撞、运动,相互间的碰撞与作用引起物体产生压力,从而表现出物体的热力学性质。
2. 统计规律根据分子热运动的统计规律,可以研究物体的温度、压强等热力学性质。
其中,气体的热力学性质主要由分子的平均动能、自由程、碰撞频率等参数决定。
3. 热力学基本规律热力学基本规律主要包括热力学第一定律(能量守恒定律)、热力学第二定律(熵增定律)和热力学第三定律(绝对零度定律)。
三、教学重点1.分子热运动的基本概念;2.统计规律的应用;3.实验测量方法与数据处理。
四、教学难点1.热力学基本规律的理解;2.实验测量方法的掌握;3.研究分子热运动相关问题的实践操作。
五、教学方法1.理论与实验相结合的教学方法;2.采用课堂讲授和实验操作相结合的方式;3.引导学生自主探究,鼓励创新思维。
六、教学内容1.分子热运动的概念及基本规律;2.热力学基本规律;3.分子热运动的实验测量方法;4.分子热运动相关问题的理论计算与实验验证。
七、教学流程第一课时一、知识点讲解1.分子热运动的基本概念;2.统计规律的应用;3.热力学基本规律。
二、实验讲解1.实验现象及实验装置;2.实验步骤与方法。
第二课时一、实验操作1.实验操作;2.数据记录。
二、数据处理1.数据处理及分析;2.实验结果的解释。
第三课时一、理论计算1.分子热运动的理论计算;2.理论与实验结果的比较。
二、作业布置及讲解1.布置作业;2.作业讲解。
八、板书设计第一课时一、知识点讲解二、实验讲解第二课时一、实验操作二、数据处理第三课时一、理论计算二、作业布置及讲解九、教学评估1.期末考试;2.实验报告评分;3.课堂表现及作业完成情况。


气体分子的热运动与速度分布在我们的生活中,气体无处不在,无论是我们呼吸的空气,还是我们家中使用的燃气,都是由气体组成的。
那么,气体分子是如何运动的呢?它们的速度分布又是怎样的呢?让我们一起来探索气体分子的热运动和速度分布。
首先,让我们来了解一下气体分子的热运动。
气体分子无线自由运动着,距离彼此远去,而且它们之间的相互作用力较小。
这使得气体分子可以在容器中快速移动,并不断与容器壁碰撞。
这种热运动使得气体分子呈现出多种不同的运动方式,如直线运动、旋转运动和振动运动等。
可以说,气体分子的热运动是密不可分的。
接下来,我们来讨论气体分子的速度分布。
根据统计力学的理论推导,气体分子的速度分布服从麦克斯韦速度分布定律。
麦克斯韦速度分布定律告诉我们,在给定温度下,气体分子的速度可以呈现出一个特定的分布情况。
根据麦克斯韦速度分布定律,气体分子的速度分布呈现出高斯分布曲线。
也就是说,在给定温度下,大部分气体分子的速度集中在一个平均速度附近,而少部分气体分子的速度偏离平均速度。
这个平均速度可以由麦克斯韦-波尔兹曼速度分布定律计算得到。
麦克斯韦-波尔兹曼速度分布定律告诉我们,气体分子的平均速度与温度成正比。
具体地说,平均速度与平方根温度成正比,即$v_{avg} \propto \sqrt{T}$。
这意味着,温度越高,气体分子的平均速度也越高。
除了平均速度,气体分子的速度分布还涉及到速度的分散程度。
可以使用速度的标准差来度量速度的分散程度。
根据麦克斯韦速度分布定律,气体分子的速度标准差与平均速度成正比,即$\sigma \propto v_{avg}$。
这意味着,平均速度越高,气体分子的速度分散程度也越大。
此外,气体分子速度的分布还与气体分子的质量有关。
根据麦克斯韦-波尔兹曼速度分布定律,质量较大的分子相对运动较慢,质量较小的分子相对运动较快。
因此,在相同温度下,质量较大的气体分子的平均速度要比质量较小的分子的平均速度小。
《分子运动速率分布的统计规律》讲义一、分子热运动的基本概念在我们生活的这个世界中,物质是由无数微小的分子组成的。
这些分子时刻都在进行着无规则的运动,这就是分子热运动。
想象一下,在一个封闭的容器中充满了气体,比如氧气。
这些氧气分子并不会整齐地排列在那里,而是以极高的速度四处乱撞。
它们之间相互碰撞,又与容器壁碰撞,这种碰撞是完全随机的。
分子热运动的剧烈程度与温度密切相关。
温度越高,分子的热运动就越剧烈,分子的运动速度也就越快。
二、分子运动速率分布的实验研究为了了解分子运动速率的分布情况,科学家们进行了一系列的实验。
其中一个著名的实验是利用蒸汽通过小孔进入一个真空容器。
当蒸汽进入真空容器后,它们会逐渐扩散。
通过测量不同位置的蒸汽密度,就可以间接得到分子运动速率的分布情况。
另一个实验是利用射线照射气体分子,通过观察射线的散射情况来推断分子的运动速率。
这些实验都为我们揭示了分子运动速率分布的一些重要特征。
三、分子运动速率分布的统计规律经过大量的实验和理论研究,科学家们发现分子运动速率分布遵循一定的统计规律。
在一定的温度下,气体分子的速率分布呈现出中间多、两头少的特点。
也就是说,大部分分子的运动速率处于某个特定的范围内,而速率特别大或特别小的分子相对较少。
如果我们以分子的速率为横坐标,以具有该速率的分子数占总分子数的比例为纵坐标,画出的图像就称为分子速率分布曲线。
这条曲线具有以下几个重要的特点:1、曲线呈现出单峰的形状,峰值对应的速率就是最概然速率。
最概然速率表示在这个温度下,出现概率最大的分子速率。
2、曲线的两侧逐渐下降,但永远不会降为零。
这意味着无论速率多么大或多么小,都有一定数量的分子具有这样的速率。
3、随着温度的升高,曲线整体向右移动,最概然速率增大,同时曲线变得更加平坦。
这表明温度升高时,更多的分子具有较高的速率,分子运动更加剧烈。
四、麦克斯韦速率分布函数为了更精确地描述分子运动速率的分布情况,科学家麦克斯韦提出了麦克斯韦速率分布函数。
《气体分子运动的统计规律》速率分布曲线《气体分子运动的统计规律——速率分布曲线》当我们谈论气体时,往往会想到它们的自由扩散、压力和温度等特性。
而这些宏观现象的背后,其实是无数气体分子微观运动的结果。
在研究气体分子的运动时,速率分布曲线是一个非常重要的概念。
要理解速率分布曲线,首先得明白气体分子的运动是极其复杂和无序的。
想象一下,在一个封闭的容器中,充满了大量的气体分子,它们以不同的速度和方向在空间中自由移动,相互碰撞,不断改变着运动状态。
那么,这些分子的速率是如何分布的呢?简单来说,速率分布曲线就是用来描述在一定温度下,气体分子速率的分布情况的图形。
假设我们能够测量容器中每一个气体分子的速率,并将它们按照大小进行分类统计。
我们会发现,大多数分子的速率并不是集中在某个特定的值上,而是呈现出一种“中间多、两头少”的分布特点。
具体来看,速率较小和速率较大的分子数量相对较少,而速率处于中间某个范围内的分子数量则相对较多。
这就像是在一场考试中,成绩特别好和特别差的学生是少数,成绩中等的学生占了大多数。
为什么会出现这样的分布呢?这其实与分子的热运动有关。
在一定温度下,分子具有一定的平均动能。
但是由于分子之间的碰撞和能量交换,使得它们的速率存在差异。
速率分布曲线通常是一条光滑的曲线。
它的横坐标表示分子的速率,纵坐标则表示对应速率的分子数占总分子数的比例。
通过这条曲线,我们可以得到很多有用的信息。
比如,曲线的峰值对应的速率,就是在这个温度下出现概率最大的速率,我们称之为最概然速率。
它反映了在该温度下分子运动的一种典型情况。
另外,曲线下的面积表示分子的总数。
这意味着,如果我们对曲线进行积分,就可以得到分子的总数。
不同温度下的速率分布曲线也是有所不同的。
一般来说,温度越高,曲线会变得更加平坦和宽阔。
这是因为温度升高,分子的平均动能增大,运动速度加快,速率的分布范围也就更广了。
除了温度,气体的种类和压强等因素也会对速率分布曲线产生影响。
第十四章 气体分子热运动的统计规律(statistical law of thermal motion of gas molecular ) §14-1 平衡态 概率 统计平均值(equilibrium state ,probability ,statistical mean quantity ) 一、平衡态(equilibrium state ) 1、概念(concept )宏观性质长时间不改变的状态 2、描述(describe )(1)状态参量① 体积V:气体分子所能到达的空间(3m ) ② 压强P:单位面积上受到的压力 () 单位面积的动量变化率 ()③ 温度T:气体的冷热程度 (K)VPT间关系——物态方程RT MpV μ=(但只有两个是独立变量)(2)几何图形(P-V图)① 平衡态:点a(p、v ) ② 准静态过程过程:物态随时间的变化, 多点集合——曲线准静态过程:过程变化缓慢,每一步均可视为平衡态。
它在P-V图上为一曲线,如ab 。
二、概率(probability )1、 概念(concept )事件出现的相对机会,即可能性 2、 表示(expression )N (N 很大)次试验中,x 事件出现了i N 次则X 事件出现的概率P (X )=NN i(离散事件) 如果事件连续分布,且f (x )表示单位间隔中出现的概率, (亦称概率密度或分布函数)则出现在d x 间隔中的概率 p (x )= f (x )d x 3、 特性(specific property ) (1) 小于1 , p (x )≤1 (2) 归1 , ∑p (x )=1 ,1)(0=⎰∞dx x f4、 等概率假设(postulate of equal probability )处于平衡态时,分子向各个方向运动概率相等三、平均值(mean quantity )1、 概念(concept )物理量的平均大小,表示量上加“一”,如x 2、 计算(computer ) (1) 离散情况 n n ii p x p x p x NN x x +++=∑= (2211)(2) 连续情况⎰=dx x xf x )(某变量的平均值=该量与分布函数的乘积对变量积分§14—2 气体压强与温度的统计意义(statistical meaning of gas pressure and temperature )一、气体的微观模型(microscopic model of gas )1、 微观模型 (microscopic model )(1) 分子可视为质点,同类分子的质量相同(2) 分子除碰撞外无其它相作用,而分子的碰撞为弹性碰撞 2、 验证(verification )不能直接用实验而是根据其推论与宏观实际(气体宏观实验)一致性来检验二、压强(pressure )1、 实质(substance )大量分子对器壁的碰撞, 单位面积的动量变化率st p s F p ∆∆∆=∆=2、 公式(formula )(1)如图,一个分子质量为m ,速率为i v 的分子与器壁s ∆碰后动量大小的变化(在x 方向上)ivix i i mv mv p 2cos 2-=-=∆θ (力学) (2)一群处于斜高为i v t ∆,底面为s ∆ 的柱体中速率基本为i v 的分子与s ∆碰后的动量变化① 柱体中速率基本为i v 的分子数(设分子数密度为i n , θcos 'i tv s ni N ∆∆= ② 它们与 s ∆碰后动量的变化t s nimv p N P ix i i ∆∆-=∆=∆22''但据等概率假设,有一半的分子可能反向运动而不能与s ∆同时相碰,故动量变化应修正减半,即 t s nimv P ix i ∆∆-=∆2斜柱体中各种速率分子与s ∆相碰后引起总动量变化ts v nm t s v n n nm nnts v n m Pi P x ix i ix i ∆∆-=∆∆∑-=∆∆∑-=∆∑=∆222(统计)据等概率假设2222223x y x v v v v v =++=即 322vv x= (统计) 故气体动量的变化 t s vnmp ∆∆-=∆32气体受到器壁的作用:s v nm tp F ∆-=∆∆=3'2(4)根据牛顿第三定律,气体对器壁的作用力'F F -=压强公式 据定义st pp ∆∆∆=k n v m n v nm ε3221323122===式中 ,221v m k =ε 为单个分子的平均动能统计力学处理问题方法小结(1) 对单个粒子:用牛顿力学规律(2) 对大量粒子:用统计规律(求平均值) 3、统计意义(statistical meaning )∵公式的推导应用了统计的概念及方法 ∴压强是个统计量,是大量分子的集体表现,对少数几个分子说它们有多大压强无意义。
三、温度(temperature )1、 公式(formula )由物态方程为玻耳兹曼常量为分子数密度式中得加工整理AkA N Rk VNn n nkT T N R v n m VN NmRT V MRT p RT Mpv ========,32,,4εμμ故得2~23v kT x ε=2、 微观意义(microscopic meaning )从温度公式可以看出,温度随分子运动速度增减面增减 温度是分子热运动剧烈程度的量度 3、 统计意义(statistical meaning )从温度公式可以看出 K T ε~ (统计平均量)∴温度是个统计量,是大量分子热运动的集体表现,离开了大量分子,仅说单个分子或少数几个分子,有多高温度是没有意义的。
4、说明(explain )(1)在很多物理公式中,k ,T 均以乘积形式同时出现,互不分离,故我们亦无必要将其拆开,由于k T 的量纲与能量相同,故也有人用能量单位来表示温度(2)P=n kT 由物态方程PV =RT Mμ导出,因此也有人将其符为物态方程① 随堂小议(discuss on the class )关于温度的概念:下列说法中不正确的是(3)(1) 温度的高低反映了物体内部分子运动剧烈程度的不同; (2) 气体的温度是分子平均平动动能的是度;(3) 从微观上看,气体的温度表示气体每个分子的冷热程度; (4) 气体的温度是大量气体分子的集体形为,具有统计性§14—3 玻耳兹曼分布律 (Boltzmann distribution )一、气体分子在重力场中的分布(distribution of gas molecular in gravity field )1、 等温气压公式(isothermal-pressure formula )(1) 公式(formula )dpp +dzz +p 0z s ∆利用空气柱模型可得压力差 pgdz smgdp -=∆-= 利用p=nkt 可得密度)2(ln ln )1(ln 000000000--------==-------==-==→------===∆=--⎰⎰pp g RT p p mg kT z ep e p p kT mgz pp z p dz kTmgp dp kTmpnm sdz m p RTgzkt mgzzp μμ对应高度故积分得处压强故式(1):等温气压公式 式(2):等温高度公式 (2) 物理意义在温度不变情况下,大气压强随高温增加而接指数规律减少(Z ↑,P ↓)2、 气体分子在重力场中的分布(distribution of gas molecular in gravity field )利用P=nkT 可得KTmgzen n -=0分子数密度n 随高z 的增加而接指数规律减少 二、玻耳兹曼他分布(Boltzmann distribution )1、 公式(formula )可以得出(推导过程不要求)KTE eIA n -=n ——分子数密度 A ——常量i E ——粒(分)子的能量 kTEi-——玻耳兹曼因子2、 物理意义(meaning of physics )具有i E 能量的分子数密度n 随i E 的增加而按指数规律减少——微观粒子优先占领低能级。
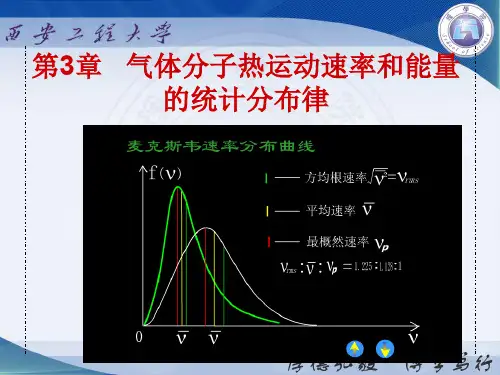
3、 应用(application )很广,如分离同位素,激光理论等§14-4 麦克斯韦速率分布律(Maxwell speed distribution )一、麦克斯韦速率分布律(Maxwell speed distribution )1、内容(content )处于平衡态的气体,其分子处于某一速率附近(v ~dv v +) 的数目dN 与总分子数N 之比dv v f dv v e nKTm n N dN KTmv )()2(422232==-(其推导不作要求) 2、实质(substance ) 是一概率分布反映分子以速率v 出在dv 速率间隔内的分子占总分子数的比率,亦即出现概率。
3、特点(characteristic )具有归一性,即⎰⎰==dv v f N dN)(1二、分布函数与分布曲线(distribution function and distribution curve )4、 分布函数(distribution function )(1) 概念N d vdNv e nKT m n v f KT mv ==-22232)2(4)( (2)实质概率密度5、 分布曲线(distribution curve )(1) 概念反映分布函数f (v )随v 而变化的曲线(2) 得来① 定量法制表—计算一连点成图v 1v 2v ……f(v) 1f 2f ……..② 定性法(f1) v = 0, f (v ) = 0,过O 点, 2) 初时 ↓⇒↑-↑↑22,kv evv 小陡3) 而后 ↓↓↑⇐-2kv v v 大 缓慢4) 拐点 p v v =(3) 几何意义曲线下方面积→概率曲线下方总面积=1 (归一化) (A ) 最概然速率① 概念:对应拐点的速率② 物理意义:分子以该速率出现概率最大③ 大小:μRTm kT v dvdfp 41.141.10===可得由(4) 影响分布曲线形状的因素:①m=c T ↑, p v ↑,右移,线矮平 ②T=c , m ↑,p v ↓,左移,线陡峭(参见附图)三、应用(application )——两种速率的计算1、平均速率(mean speed ) ⎰=====μRTm kT m KT dr v vf v 60.160.18......)( 利用积分公式⎰∞-=3212dx ex x 。
2、平均根速率(root-mean-square speed )μRTm kT m kT V mkT drv f v v 73.173.133)(222===∴==⎰3、三种速率比较(1)大小41.1:60.1:73.1::2=p v v v(它们有公共因子mkT ) (2)用途分子按速率分布平均自由程分子运动能量动能分子——)(——)(——2p v v v 三、随堂练习(practice on the class )1、 注意(take note )(1) 理解f (v )的物理意义,会用它来分析简单情况下的分子分布。