第十八章 碳水化合物
- 格式:ppt
- 大小:731.50 KB
- 文档页数:29


第一章测试1.我国的法定分析方法有中华人民共和国国家标准(GB)、行业标准和地方标准等。
其中行业标准为仲裁法。
A:错B:对答案:A2.国际组织中与食品质量安全有关的组织主要有国际标准化组织(ISO)、世界卫生组织(WHO)、食品法典委员会(CAC)、国际制酪业联合会(IDF)、国际辐射防护委员会(ICRP)、国际葡萄与葡萄酒局(IWO)。
A:错B:对答案:B3.CAC制定的9项限量标准,包括了食品中农药残留最大限量标准、兽药最大限量标准、农药再残留最大限量,但不包括有害元素和生物毒素的限量标准。
A:错B:对答案:A4.按照标准的具体内容可将CAC的标准分为商品标准、技术规范标准、限量标准、分析与取样方法标准、一般准则及指南五大类。
A:错B:对答案:B5.国际AOAC是世界性的会员组织,但不属于标准化组织。
A:对B:错答案:A第二章测试1.测定样品中挥发性酸含量时,可用水蒸汽蒸馏样品,将馏出的蒸汽冷凝,测定冷凝液中酸的含量即为样品中挥发性酸的含量。
A:错B:对答案:B2.灭酶法预处理样品中常用的温度是100℃左右。
A:错B:对答案:A3.皂化法是利用热碱溶液处理样品提取液,以除去脂肪等干扰杂质。
其原理是利用盐酸-乙醇溶液将脂肪等杂质皂化除去,以达到净化目的。
A:对B:错答案:B4.对样品进行理化检验时,采集样品必须有。
A:随意性B:适时性C:代表性D:典型性答案:C5.常压干法灰化的温度一般是。
A:100℃~150℃B:200℃~300℃C:300℃~400℃D:500℃~600℃答案:D第三章测试1.误差的计算结果值可能有正数也可能有负数。
A:错B:对答案:B2.真实值是指某物理量本身具有的客观值或实际值。
随着科学技术的进步,检测结果能逼近真值并达到真值。
A:错B:对答案:A3.误差和偏差是两个不同的概念,误差是以真实值作为标准,偏差是以多次测量值的平均值作为标准。
A:对B:错答案:A4.系统误差可以进行修正,随机误差无法进行修正。


2.写出庚烷的同异构体分的构造式,用系统命名法命名之:3.用系统命名下列化合物:(6)(C2H5)2CHCH(C2H5)CH2CH(CH3)24.指出习题2中符合条件的烷烃:(1).没有叔氢的:(2)含一个季碳原子的:(3)含异丙基的:(4).含有叔氢的:5.写出构造式,并用系统命名法命名之。
(1) C5H12仅含有伯氢,没有仲氢和叔氢的(2) C5H12仅含有一个叔氢的(3) C5H12仅含有伯氢和仲氢6.写出下列化合物的构造式和简式:(1) 2,2,3,3-四甲基戊烷(2) 由一个丁基和一个异丙基组成的烷烃:(3) 含一个侧链和分子量为86的烷烃:(4) 分子量为100,同时含有伯,叔,季碳原子的烷烃7.试指出下列各组化合物是否相同?为什么?(1)(2)8.用轨道杂化理论阐述丙烷分子中C-C和C-H键的形式.9.(1)把下列三个透视式,写成纽曼投影式,它们是不是不同的构象呢?(2)把下列两个楔形式,写成纽曼投影式,它们是不是同一构象?10.写出戊烷的主要构象式(用纽曼投影式表示)11.试估计下列烷烃按其沸点的高低排列成序(把沸点高的排在前面)(1)2-甲基戊烷(2)正己烷(3)正庚烷(4)十二烷12.写出在室温时,将下列化合物进行一氯代反应预计到的全部产物的构造式:⑴.正己烷:⑵.异己烷⑶.2,2-2甲基丁烷13.试给出下列反应能量变化的曲线图.CH3-H + F· ' H-F +·CH314. 给出下列反应能量变化的曲线图.CH3CH2-H + Cl·'HCl + CH3CH2· E1=-16.7KJ/mol或-21KJ/mol. E活=4.1KJ/mol,用E2表示15.氯,溴分别与甲烷起卤代反应的活化能为16.7KJ/MOL,75.3KJ/mol,说明何者较易起反应呢?16.在下列一系列反应步骤中,⑴A'B B+C'D+E E+A'2F试回答:a哪些质点可以认为是反应物,产物,中间体?b写出总的反应式:c给出一张反应能量变化草图.17.写出乙烷氯代(日光下)反应生成氯乙烷的历程:18.试写出下列各反应生成的一卤代烷,预测所得异构体的比例:19.用反应式表示从含三个碳的化合物制备己烷?20.试根据甲烷只有一种一元取代物的事实,说明甲烷为什么不可能排成正方平面构型,也不可能为梯形构型呢?绪论1.甲基橙是一种含氧酸的钠盐,它的含碳量51.4%、氮12.8%、硫9.8%和钠7.0%,问甲基橙的实验式是什麽?2、胰岛素含硫3.4%,其分子量为5734,问一分子中可能有多少硫原子?3、元素定量分析结果,指出某一化合物的实验式为CH,测得其分子量为78,问它的分子式是什麽?4、根据键能数据,当乙烷(CH3-CH3)分子受热裂解时,哪种共价键首先破裂?为什么?这个过程是吸热反应还是放热反应?5.写出下列反应能量的变化?6、根据电负性数据,用和标明下列键或分子中带部分正电荷和部分负电荷的原子。


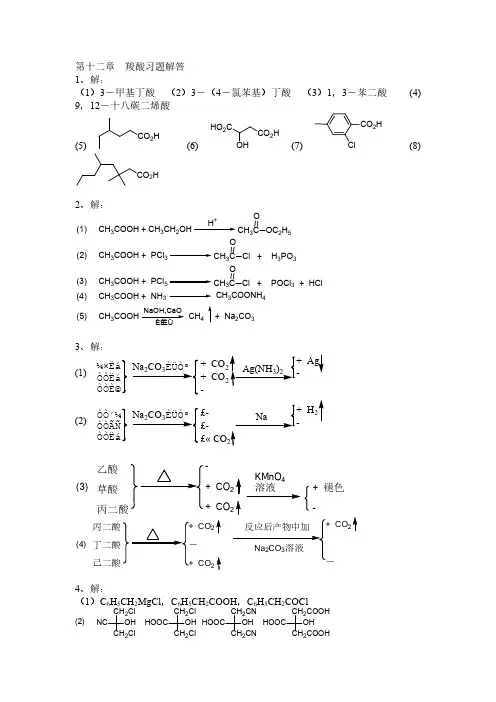
第十二章 羧酸习题解答1、解:(1)3-甲基丁酸 (2)3-(4-氯苯基)丁酸 (3)1,3-苯二酸 (4)9,12-十八碳二烯酸(5)CO 2H(6)HO 2CCO 2HOH(7)CO 2HCl(8)CO 2H2、解:(1) CH 3COOH + CH 3CH 2OHH +CH 3C OOC 2H 5(2) CH 3COOH + PCl 3CH3C O Cl + H 3PO 3(3) CH 3COOH + PCl 5CH 3C O Cl + POCl 3 + HCl(4) CH 3COOH + NH 3CH 3COONH 4(5) CH 3COOHCH 4NaOH,CaO+ Na 2CO 33、解:¼×ËáÒÒËáÒÒÈ©+ CO+ CO -(1)ÒÒ´¼ÒÒÃÑÒÒËá£-£- £« CO(2)乙酸草酸丙二酸-+CO 2+CO 2KMnO 4溶液+褪色-(3)丙二酸丁二酸己二酸CO 2CO 2CO (4)4、解:(1)C 6H 5CH 2MgCl ,C 6H 5CH 2COOH ,C 6H 5CH 2COClNC CH 2Cl CH 2ClOHHOOC CH 2Cl CH 2Cl OH HOOC CH 2CN CH 2CN OH HOOC CH 2COOHCH 2COOHOH(2)5、解:H 2C CH 23C CH 2NaCN3CH 2H 3O +3CH 2COOH(1)CH 3CH 2CH 2H +∆H 3CHC CH 2HBr¹ýÑõ»¯ÎïCH 3CHCH 3BrNaCNCH 3CHCH 3CNH 3O +CH 3CHCH 3COOH(2)CH 3CH 2COOH P + BrCH 3Br OH -CH 3CHCOOHOH (3)CH 3CH 2COOH +(4)CH 3CH 2COOH P 2O5∆(CH 3CH 2CO)2OBrEt 2OMgBr CO 2H 2OCOOH 2C 2H 5(5)6三个碳原子,只能是CH 3CH 2COOH 。
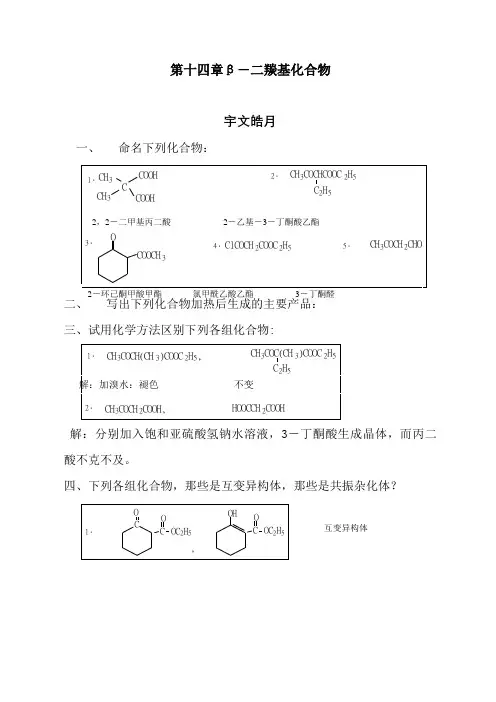
第十四章β-二羰基化合物宇文皓月一、 命名下列化合物:三、试用化学方法区别下列各组化合物:解:分别加入饱和亚硫酸氢钠水溶液,3-丁酮酸生成晶体,而丙二酸不克不及。
四、下列各组化合物,那些是互变异构体,那些是共振杂化体?互变异构体五、完成下列缩合反应: 六、完成下列反应式: 七、写出下列反历程:八、以甲醇,乙醇为原料,用丙二酸酯法合成下列化合物:1.α-甲基丁酸3. 3-甲基己二酸4.1,4-环己烷二甲酸5.环丙烷甲酸共振杂化体互变异构解:反应历程:九、以甲醇、乙醇以及无机试剂为原料,经乙酰乙酸乙酯合成下列化合物:(1) 3-乙基-2-戊酮(2)α-甲基丙酸(3)γ-戊酮酸(4) 2,7-辛二酮(5)甲基环丁基甲酮十、某酮酸经硼氢化钠还原后,依次用溴化氢,碳酸钠和氰化钾处理后,生成腈。
腈水解得到2-甲基戊二酸。
试推测此酮酸的结构,并写出各步反应式。
解:十一、某酯类化合物A(C5H10O2),用乙醇钠的乙醇溶液处理,得到另一个酯B(C8H14O3),B能使溴水褪色,将B用乙醇钠的乙醇溶液处理后,再与碘乙烷反应,又得到另一个酯C(C10H18O3).C和溴水在室温下不反应。
把C用稀碱水解再酸化,加热,即得一个酮D(C7H14O),D不发生碘仿反应。
用锌汞齐还原则生成3-甲基己烷,试推测A,B,C,D的结构,并写出各步反应式。
解:A,B,C,D的结构及各步反应式如下:(完)第十五章硝基化合物和胺一、命名下列化合物:N, N-二甲基-4-亚硝基苯胺丙烯腈二、写出下列化合物的构造式:1, 间硝基乙酰苯胺 2,甲胺硫酸盐 3,N-甲基-N -乙基苯胺4,对甲基苄胺 5, 1,6-己二胺 6,异氰基甲烷7,β-萘胺 8,异氰酸苯酯三、用化学方法区别下列各组化合物:1,乙醇,乙醛,乙酸和乙胺2、邻甲苯胺 N-甲基苯胺 N,N-二甲基苯胺解:分别与亚硝酸钠+盐酸在低温反应,邻甲苯胺反应产品溶解,N-甲基苯胺生成黄色油状物, N,N-二甲基苯胺生成绿色固体。
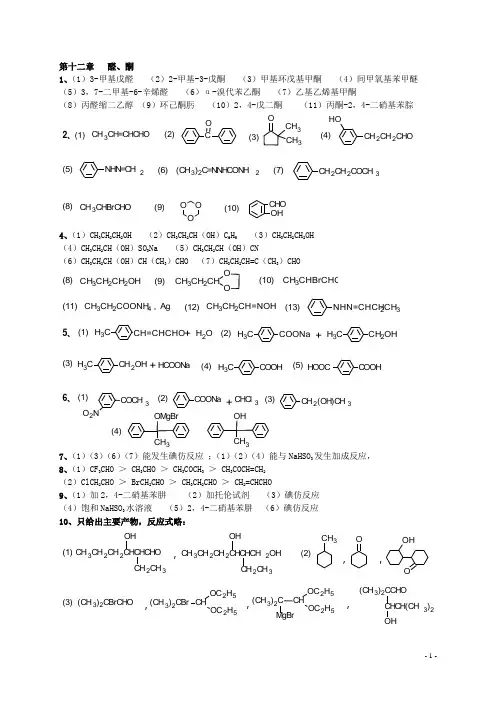
第十二章 醛、酮 1、(1)3-甲基戊醛 (2)2-甲基-3-戊酮 (3)甲基环戊基甲酮 (4)间甲氧基苯甲醚 (5)3,7-二甲基-6-辛烯醛 (6)α-溴代苯乙酮 (7)乙基乙烯基甲酮(8)丙醛缩二乙醇 (9)环己酮肟 (10)2,4-戊二酮 (11)丙酮-2,4-二硝基苯腙(2)(1)(3)(4)C O CH 3CH 3O CH 2CH 2CHO OH CH 3CH=CHCHO 2、 (6)(5)(7)NHN=CH 2CH 2CH 2COCH 3(CH 3)2C=NNHCONH 2(10)(9)(8)CHO OHCH 3CHBrCHOO OO4、(1)CH 3CH 2CH 2OH (2)CH 3CH 2CH (OH )C 6H 5 (3)CH 3CH 2CH 2OH (4)CH 3CH 2CH (OH )SO 3Na (5)CH 3CH 2CH (OH )CN(6)CH 3CH 2CH (OH )CH (CH 3)CHO (7)CH 3CH 2CH=C (CH 3)CHO(10)(9)(8)OCH 3CH 2CHO CH 3CH 2CH 2OHCH 3CHBrCHO(13)(12)(11)NHN=CHCH 2CH 3CH 3CH 2COONH 4 , Ag CH 3CH 2CH=NOH(2)(1)C H 3CH 2OHCH 3COONaCH 3CH=CHCHO H 2O ++5、(3)(5)(4)CH 3COOH CH 3CH 2OH HOOCCOOHHCOONa +(3)(2)(1)(4)CH 2(OH)CH 3COONa OMgBr3COCH 3O 2N+CHCl 3OH 36、7、(1)(3)(6)(7)能发生碘仿反应 ;(1)(2)(4)能与NaHSO 3发生加成反应, 8、(1)CF 3CHO > CH 3CHO > CH 3COCH 3 > CH 3COCH=CH 2 (2)ClCH 2CHO > BrCH 2CHO > CH 3CH 2CHO > CH 2=CHCHO 9、(1)加2,4-二硝基苯肼 (2)加托伦试剂 (3)碘仿反应 (4)饱和NaHSO 3水溶液 (5)2,4-二硝基苯肼 (6)碘仿反应 10、只给出主要产物,反应式略:(2)(1)CH 3CH 2CH 2CHCHCHO OH2CH 3CH 3CH 2CH 2CHCHCH 2OHOHCH 2CH 3CH 3OOOH,,,(3)(CH 3)2CBrCHO CH OC 2H 5OC 2H 5(CH 3)2C CHCH(CH 3)2(CH 3)2CCHO,,,(CH 3)2CBr CHOC 2H 5OC 2H 5MgBr(4)OMgBr CH 3OH CH 3①H+,△② B 2H 6 , H 2O 2/OH ,,,-(1)CH 3CH=CH 2CH 3CH 2CH 2BrNaC≡CNaCH 3CH 2CH 2C≡C CH 2CH 2CH 3CH 3CH 2CH 2COCH 2CH 2CH 2CH 3HBr2322242411、也可通过格氏试剂增碳、水解、氧化得到。

第十八章 碳水化合物基本要求1、掌握概念:醛糖、酮糖、Fischer 投影式、氧环式、Hawarth 结构式、构象式、α,β—构型,变旋现象,异头物,差向异构体等。
2、掌握单糖的化学性质。
3、掌握几种双糖的结构与性质,如蔗糖、麦芽糖、乳糖等。
4、掌握淀粉、纤维素的结构特点及其加工应用。
重点与难点:单糖的各种结构的表示法及其化学性质。
前言(Introduduction ):碳水化合物即糖类(Saccharides )。
糖类是自然界中数量最多,分布最广的重要天然化合物,几乎存在于所有的生物体内,起着重要作用。
糖、脂肪、蛋白质是生物体代谢中不可缺少的。
碳水化合物是光合作用的产物,由光合作用生成的有机物占植物干重的95%左右。
植物中的叶绿素吸收太阳能,将CO 2和H 2O 经光合作用转化为碳水化合物,同时放出氧气。
糖类在人体经缓慢氧化转化为CO 2和H 2O ,同时放出能量,以供给肌肉活动并保持人正常的体温,如淀粉、葡萄糖、果糖、蔗糖等。
另外,棉、麻织物、木材等的结构是纤维素,糖元是动物的储备粮,甲壳质(壳多糖)是虾蟹等的甲壳的主要成分。
脱氧核糖和核糖是生物体内遗传物质的主要组成成分。
观察淀粉、纤维素、蔗糖等的分子式与结构及其水解产物发现这些糖类均具有C n (H 2O)m 的通式,故称碳水化合物。
但并非所有的糖类都具有C n (H 2O)m 的通式,如鼠李糖C 6H 12O 5。
而一些符合该通式的化合物如甲醛(CH 2O )、乳酸(C 3H 6O 3)、乙酸(C 2H 4O 2)等却不是糖类。
严格的讲这个名称并不科学,但由于历史的原因一直沿用。
它表示简单和复杂的糖类及其有关物质的总称。
所有糖类其元素组成均含有C 、H 、O ,少数含有N ,如氨基糖。
从结构上分析均为多羟基醛、酮及其衍生物。
因此根据现代化学知识:碳水化合物即糖类——多羟基醛酮及其水解后能生成多羟基醛酮及其衍生物的物质。
单糖:不能水解成为小分子的多羟基醛酮及其衍生物。
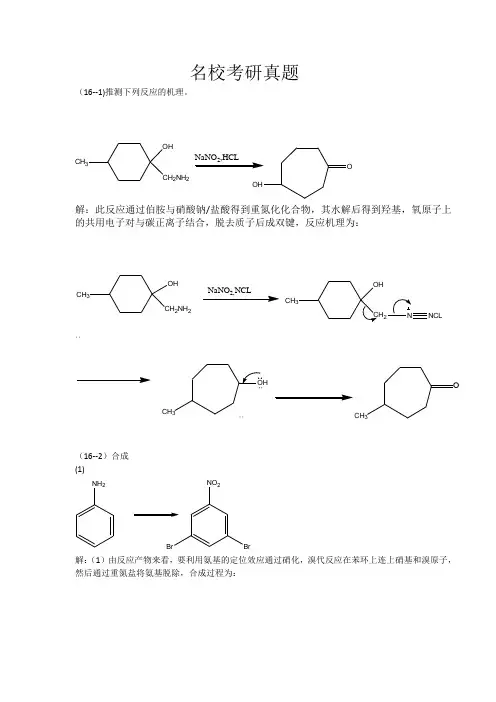
名校考研真题(16--1)推测下列反应的机理。
CH 3OHCH 2NH 2解:此反应通过伯胺与硝酸钠/盐酸得到重氮化化合物,其水解后得到羟基,氧原子上的共用电子对与碳正离子结合,脱去质子后成双键,反应机理为:OHCH 2NH 2CH 3CHCHCH 3O(16--2)合成 (1)NH2解:(1)由反应产物来看,要利用氨基的定位效应通过硝化,溴代反应在苯环上连上硝基和溴原子,然后通过重氮盐将氨基脱除,合成过程为:NH2CH COCL NHCOCH32Br 22N 2CLBrNO 22(2)NHCOCH 3OHBr(2)由乙酰苯胺合成对溴硝基苯,可以先通过与溴水进行取代反应,然后再水解得到对溴苯胺,再经过重氮化水解得到产物。
NHCOCH3NHCOCH3BrNH 2BrN 2HSO 4BrNaNO 24(16-3) 请按照要求设计下列目标分子的合成路线CH 2CLOHCN解:通过取代反应将甲基上的氯原子取代为氰基,然后通过硝化反应在苯环上连上硝基,将硝基还原为氨基,然后重氮化、水解得到酚羟基。
合成过程为:Me2SO4 TBAB,NaOHCNHNO3H2SO4CN NO2Fe4CNNH2(1)NaNO+浓HCl,0C~5C°°(2)H2SO4/H20refluxCNOH(16—4)按要求从指定原料出发合成目标化合物,其他有机与无机试剂任选。
(1),OOHNH2解:(1)通过酰基化在苯环上连上羟基,然后用锌汞齐将羟基还原为烷基,可以用硝化反应在苯环上取代硝基,然后还原为胺,得到产物。
合成过程为:OH SOClCl+AlCl3OZn(Hg)HClNO2 NH2(2)ONH,CH2CH2CHCN(16--5)用重氮化反应,由甲苯制备邻苯甲腈。
解:根据重氮化反应在苯环上连上重氮基,然后再用CuCN取代苯环上的重氮基得到反应产物,合成过程为:CH3CH 3NO 2+CH 3ON 2CH 3NO2CH3NNCl -CH 3CN(16--6)完成转化(除指定原料外,可选用任何有机、无机原料和试剂)CH3解:要利用氨基的定位效应通过溴代反应在苯环上连上溴原子,然后通过重氮盐将氨基脱除,合成过程为:CH 33H SOCH3NH2CH 3BrBr(16--7)由苯、丙二酸二已醋和不超过4个碳的原料和必要的试剂合成下列化合物。
第十八章健康风险评估和分析学习单元1 健康风险识别1. WHO在2002年指出,高血压、高血脂、超重及肥胖、缺乏身体活动、蔬菜水果摄入量不足、吸烟,是引起慢性病的重要危险因素,而这些危险因素都与人们的生活方式息息相关。
2. 健康(相关)危险因素包括个人特征、环境因素、生理参数、疾病或亚临床疾病状态。
3. 健康危险因素是健康风险评估的依据,按是否可以纠正分为不可改变危险因素和可改变危险因素。
不可改变危险因素包括:家族遗传史、老龄化与性别、环境等。
可改变危险因素包括:心理不健康、不良生活方式((吸烟、酗酒、身体活动不足、膳食不平衡、压力)、腰围超标(肥胖或超重)、血脂异常、血糖/血压/血尿酸偏高。
4. 生活方式相关的危险因素:1) 吸烟:几乎已停滞吸烟,肺部就开始恢复健康。
戒烟10~15年后,危险性降低至与非吸烟者几乎相同的水平。
2) 不合理膳食:健康饮食的目标是为了保持恒定理想体重、预防疾病和摄入充足、平衡的各种营养素。
3) 缺乏身体活动:一定强度的锻炼(有氧运动)能改善心肺功能。
4) 酗酒:能暂时性的升高血压并导致高血压的发生。
5) 压力:压力能够暂时性的升高血压,若持续较长时间就会导致高血压。
5. 体检中常用的健康风险评估指标及其意义:1) 体重与体质指数:将自己的体重控制在理想体重的120%以内。
2) 血压:通常,血压以分数表示:收缩压/舒张压。
经常参加运动、减少食盐和钠的摄入、减肥以及避免酗酒通常就能有效降低血压。
3) 总胆固醇(TC):由肝脏经脂肪、碳水化合物和蛋白质合成,在它的作用下,细胞膜相互结合。
他还是肾上腺素和维生素D的合成原料。
总胆固醇=LDL+HDL+VLDL。
4) 高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C):偏低的HDL水平比偏高的LDL水平对预测心脏病发作更有价值。
5) 总胆固醇/HDL之比:比值越高,罹患心血管疾病的风险越大。
6) 甘油三酯动物性食物与植物性食物中都含有甘油三酯。
第十八章糖类化合物Contents18.1 分类18.2 单糖的结构与命名18.3 单糖的化学18.4 双糖的结构18.1 分类糖,又称碳水化合物,是一类多羟基醛或多羟基酮,以及能够水解生成多羟基醛或多羟基酮的有机化合物。
是自然界存在最广泛的一类有机物。
根据糖的水解情况,可将其分为四类,即单糖、双糖、寡糖和多糖。
单糖是不能再被水解成更小分子的糖。
如葡萄糖、半乳糖、甘露糖等。
水解后产生两分子单糖者称为双糖,如蔗糖、乳糖等。
水解后产生3 ~ 10 个单糖的称为寡糖或低聚糖。
完全水解后产生10 个以上单糖的称为多糖,如淀粉、纤维素、糖元等。
18.2 单糖的结构与命名从结构上,单糖可分为醛糖和酮糖两类;按照分子中所含碳原子的数目,又可将单糖分为丙糖,丁糖,戊糖和己糖等。
这两种分类方法常结合使用。
一、单糖的立体构型所有的单糖分子中都含有一个或多个手性碳原子,都有旋光异构体。
如己醛糖分子中有四个手性碳原子,有24 = 16 个异构体,葡萄糖是其中的一种。
单糖的立体结构通常用Fischer 投影式表示。
构型通常采用D、L构型标记法标记,即以甘油醛为标准,通过逐步增长碳链的方法来确定。
凡由D-(+)-甘油醛经过逐步增长碳链的反应转变而成的醛糖,其构型为D-构型;由L-(-)-甘油醛经过逐步增长碳链的反应转变成的醛糖,其构型为L-构型。
例如,从D-甘油醛出发,经与HCN 加成、水解、内酯化、再还原,可得两种D-构型的丁醛糖。
以同样的方法,可以导出四种D-型戊醛糖和八种D-型己醛糖。
HCHO CH 2OHOH CN H OH HOH CH 2OH CNHO H HOH CH 2OH1) 水解2) 内酯化3) 还原CHOH OH HOH CH 2OH CHOHO H HOH CH 2OHD-(-)-赤藓糖D-(-)-苏阿糖1) 水解2) 内酯化3) 还原为简便起见,在构型式中可以省去手性碳原子上的氢原子,并以半短线“-”表示手性碳原子上的羟基,用一竖线表示碳链。
第六篇消化和吸收(digestion and absorption)1第十八章概述机体需要的营养物质:蛋白质脂肪碳水化合物维生素无机盐水需要消化不需要消化消化和吸收的概念消化(digestion) :食物在消化道内分解的过程。
吸收(absorption) :食物经消化后,透过消化管壁进入血液循环的过程。
消化的方式:机械消化(mechanical digestion):平滑肌活动化学消化(chemical digestion) :消化酶“脾胃为后天之本”,消化功能的好坏直接影响人体的健康水平和许多疾病。
第一节消化道平滑肌的生理特性一般生理特性1.兴奋性、传导性、收缩性均比骨骼肌低2.自动节律性低且不规则3.紧张性:使消化道保持一定的基础压力,形状位置,肌肉各种活动产生的基础4.富有较大的伸展性5.对各种刺激有选择敏感性1.静息电位(RP)电生理特性平滑肌RP较小(-50~-60mV),主要由K+外流形成的;也与钠泵的生电作用有关;此外,静息状态下的Na+少量内流和Cl-的外流也有关。
导致RP发生变化的因素:去极化牵张肌肉ACh刺激迷走N某些胃肠激素超极化E/NE刺激交感神经2.基本电节律(basic electrical rhythm ,BER)(1)定义:消化道平滑肌RP并不恒定地维持在一定水平上,能够在RP的基础上自发地周期性地去极化和复极化形成缓慢的电位波动,称为慢波电位(slow wave)或基本电节律(basic electrical rhythm)。
10-15mV(2)机制:尚未完全阐明,可能与生电性钠泵的周期活动有关。
慢波电位起源于纵行肌和环行肌之间的Cajal细胞,是一种兼有成纤维细胞和平滑肌细胞特性的间质细胞,也称ICC。
ICC产生的电活动可以电紧张形式很快扩布到纵行肌和环形肌细胞,从而启动BER。
目前认为它是胃肠运动的起搏细胞。
(3)作用:在此基础上激发AP,并决定肌肉收缩的频率;本身不引起肌肉收缩,但能降低AP产生的阈值(使RP接近于产生AP的阈电位)。
第十四章 β— 二羰基化合物1、(1)2,2 -二甲基丙二酸 (2)2-乙基-3-丁酮酸乙酯 (3)2-氧代环己烷甲酸甲酯 (4)甲酰氯基乙酸 (5)3-丁酮酸(乙酰乙酸)2、(1)环戊酮 (2)CH 3COCH 2CH 2CH 2COOH (3)CH 3CH 2CH 2COOH3、(1)加FeCl 3/H 2O CH 3COCH(CH 3)COOC 2H 5 有颜色反应. (2)加FeCl 3/H 2O CH 3COCH 2COOH 有颜色反应.4、(1)互变异构 (2)共振异构 (3)互变异构5、(1)(2)CH 3CH 2CHC OOC 2H 53OC 2H 5OH++C 2H 5OHCOCH (CH3)COOC 2H 5(3)(5)CHCOOC 2H 52H 5C H 3C 2H 5OHCHOO++C 2H 5OH(4)C 2H 5OHC H 2C O H 2CC H C OOC 2H 5C H 2C H 2+(1)CHOCHOCHO;6、(2) C 2H 5ONa , CH 3CH(Br)COOC 2H 5 , CH 3COCH 2CH(CH 3)COOC 2H 5 (3) HOCH 2CH 2OH / 干HCl , CH 3COCH 2C(OH)(C 6H 5)2 (4)NaCH(C OOC2H 5)22(C 2H 5OC O)2CCH 2CH 2COCH 32HOOCCHCH 2CH 2COCH3OOC 6H 5CH 2CH 32HOOCCHCH 2CH 2CH(OH)CH3,,,C 6H 5CH 2COCH 2C 6H 5C 6H 5CHC OCH 2C 6H 5CH 2CH 2CH CCH CCH 36H 5OC 6H 5CH 2CH 2CH CC CH OHCH 3C 6H 56H 5OCH 2CH 2CHC CH C 6H 5365CH 2CH 2CH C C CH 2CH 36H 5OC 6H 5O CH 2CH 2CHC C CH C 6H 5O -CH 36H 5OCH 2=CHCOCH 33NaOCH 3CH OH2--7、8、丙二酸酯合成: CH 3CH 2OHCH 2(COOC 2H 5)2[O]2① NaCN ②OH 3+2C 3H 5OH H(1)CH 3CH 2OHCH 3CH 2Br CH 3OHCH 3BrCH 2(COOC 2H 5)2NaBr 2425NaBr24NaHC(COOC2H 5)2253①②CH 3CH 2CH(CH 3)COOHC 2H 5CH(COOC 2H 5)2252△2H +(2)CH 3CH 2CH 3CH 2Br24+2H 2CCH 2OCH 3CH 2M gBrCH 2=CH 2CH 3CH 2OHMg 干醚CH 2(COOC 2H 5)225H 2SO 42△CH 3CH 2CH 2CH 2CH 3CH 2CH 2CH 2Br32223CH 2CH 2CH 2CH 2COOHH +OH 2(3)△CH 3CH 2Br2CH 2(COOC 2H 5)2242△CH 3CH 2OHH +OH 2NaCN222C 2H 5ONaCH 3CH 2CH 3CH 2COOH 4CH 3CH 2CH 2OHCH 2=CHCH3CH 3CH(Br)CH 2Br32CH 2CH 2COOH 2COOHCH 32NaCH(C OOC2H 5)2H++21,2-二溴乙烷合成酮 (3).(4)2CH 2(COOC 2H 5)22△CH 3CH 2OHH +222C 2H 5ONaCH 2BrCH 2BrCH 2CH(COOC 2H 5)22CH(COOC 2H 5)22NaCH(COOC2H 5)2+2CH 2=CH 225COOC 2H 5COOC 2H 5C 2H 5OCOC 2H 5OCO COOHHOOC CH 2BrC H 2Br22(5) 1,2-二溴乙烷合成同 (4). 2△22+22C H ONaC H 2(C OOC 2H 5)2C OOC 2H 5C OOC 2H 5C OOH9、乙酰乙酸乙酯合成: 3225CH 3CH 2H+H+3COOHCH 3COOC 2H 53COCH 2COOC 2H 5(1)CH 3CH 2Br C H ONa NaBr 2425②CH 3CH 2OHCH 3COCH 2COOC 2H 5C H ONa 25②CH 3CH 2CH(C 2H 5)COCH 3(2)CH 3OH CH 3Br C 2H 5ONa NaBr 24CH 3Br②CH 3COCH 2COOC 2H 5C H ONa CH 3Br②40%NaOH(CH 3)2CHC OOH(3)CH CH OH2PC H ONa ①②CH 3CH 2OH H+CH 3COOH CH 3COCH 2COOC 2H 5225ClCH 2COOHClCH 2COOC 2H 5CH 3COCH 2CH 2COOH(4)①②CH 3CH 2OHH+2Br 2222C 2H 5ONa CH 3COCH 2COOC 2H 5CH 3COCH 2CH 2CH 2CH 2COCH 3CH 2BrC H 2Br2(5)- H 2OCH 3CH 2Br CH 3OH②3+24①②CH 3CH 2MgBr CH 3CH 2OH干醚22C H ONaCH 3CH 2CH 2OH+CH 3COCH 2COOC 2H 55%NaOHCrO 3 / 吡啶HCHOCH 3CH=CH2222光过氧化物CH 3CH 2MgBrBr H BrC H 2CH 2CH 2BrC OCH 310、该化合物为:CH 3COCH 2CH 2COOH 反应式略。
《有机化学》(7学分)教学大纲《有机化学7学分》(有机化学上4学分,有机化学下3学分)(建议本课程放于二年级)一、教学基本目标有机化学是化学学科的重要分支,它是研究有机化合物的组成、结构、合成、物理性质及有机化合物之间相互转化规律的学科,是化工类各专业的重要基础课,是一门理论和实践性并重的课程。
通过学习使学生了解近代有机化学的基本理论,并具备必要的基本知识和一定的基本技能,为后继课程和进一步掌握新的科学技术打下必要的基础。
在教学过程中,注意培养学生正确的学习和研究方法,逐步培养学生的自学能力、思维能力和创新意识。
树立辨证唯物主义的科学世界观,结合科研和生产实际使学生具有初步的分析问题和解决问题的能力。
二、教学基本内容第一章有机化合物的结构和性质(2学时)*有机化合物的含义和有机化学研究的对象;有机化合物的特点;*有机化合物中的化学键,共价键的性质:键长、键角、键能及其键的极性;共价键的断裂方式:均裂、异裂;自由基反应和离子型反应的特点;*有机化合物的酸碱概念;有机化合物的分类;有机化学的现状和发展;*学习有机化学的方法。
第二章烷烃(5学时)烷烃的通式、同系列和构造异构;烷烃的命名——系统命名法;烷烃的结构:甲烷的结构,*碳原子的SP3杂化,?键;*构象:乙烷、正丁烷的构象;*构象的表示方法:透视式、纽曼投影式;烷烃的物理性质;烷烃的化学性质:取代反应:自由基卤代反应,*自由基取代反应历程,*反应中能量的变化、*反应热、*活化能;氧化反应:低级和高级烷烃的氧化,有机化学中氧化反应的含义;异构化反应、裂化反应和裂解反应。
第三章烯烃(7学时)烯烃的通式、同系列和构造异构;烯烃的命名:系统命名、顺反和Z-E命名(次序规则);烯烃的结构:乙烯的结构、*碳原子的SP2杂化、*键;分子轨道理论、成键轨道和反键轨道;*构型;烯烃的主要来源和制法:石油裂解气的分离、*醇脱水、*卤代烷烃脱卤化氢、邻二卤化物脱卤素烯烃的化学性质:双键的加成反应:催化加氢;*亲电加成(X2、HX、H2SO4、HOX、H2O及硼氢化—氧化水解),亲电加成规则(马氏规则)及亲电加成反应历程(含顺式、反式加成);*自由基加成——过氧化物效应及其反应历程;烯烃的氧化:*臭氧化分解、环氧化;聚合反应;-H的卤代、氧化。