小肽在反相色谱中的保留行为
- 格式:pdf
- 大小:334.97 KB
- 文档页数:6

反相色谱对色谱保留值变化规律式的推导
反相色谱(Reversed-Phase Chromatography, Rpc)作为有机和芳基有机分析
中常用的分离、鉴定和测定技术,它的特点是溶剂流和色谱保留值之间有很强的关系,根据反相色谱拟合的色谱保留值变化规律,可以更加贴近实际实现快速、准确的分析,其保留值的变化规律一般采用叫做Bedrossyan推导的公式来描述:
Bedrossyan推导的反相色谱保留值变化规律是:
K = K'0(1-v/V0)m
其中:K为溶剂浓度的函数;K'0为溶剂流的基线保留值;v为溶剂占有体积;V0为溶剂流总体积;m为色谱保留值变化曲线的斜率。
这条变化规律表明,随着溶剂流占有体积变化,色谱保留值会随之发生变化,
K值会随着溶剂占有体积增加而减小,当溶剂占有体积变化至V0时,K即为K'0,
溶剂流基线保留值;当溶剂浓度的函数K的变化幅度越大,m参数越大,表明反相
色谱保留值变化过程越明显。
反相色谱保留值变化规律公式由Bedrossyan推导而来,通过该公式,分析师
可以根据实际情况更准确、快速的反映出溶剂浓度对色谱保留值的影响,这对大规模实验及色谱拟合非常具有价值。

分离小肽的高效液相柱子
分离小肽的高效液相柱子通常使用反相高效液相色谱(RP-HPLC)或亲水作用色谱(HILIC)等方法。
反相高效液相色谱(RP-HPLC)是一种常用的分离小肽的方法。
在这种方法中,小肽被固定在非极性固定相上,并利用不同溶剂的洗脱能力将其分离。
通过调整洗脱液的组成和流动相的比例,可以改变小肽的保留时间和洗脱顺序,从而实现分离。
亲水作用色谱(HILIC)也是一种常用的分离小肽的方法。
在这种方法中,小肽被固定在极性固定相上,并利用溶剂和固定相之间的相互作用将其分离。
与RP-HPLC不同的是,HILIC主要利用亲水性相互作用来分离小肽,因此对于一些疏水性较弱的小肽分离效果可能更好。
对于不同的分离需求,可以选择不同的高效液相柱子。
例如,对于一些较大和较为疏水的小肽,可以选择使用较粗的粒径填料的柱子,以提高分离效果和降低柱压。
对于一些较小和较为亲水的小肽,可以选择使用较细粒径填料的柱子,以提高分辨率和分离效果。
以上内容仅供参考,可以查阅专门的研究资料或者文献,了解具体的色谱条件和最佳分离方案,也可咨询相关的色谱专家获取准确和专业的判断和建议。

反相液相色谱对多肽的分离、纯化与制备作者:闫凤来源:《科学与财富》2017年第35期摘要:随着现代生物技术的发展,出现了各种多肽类药物,多肽在临床医学中有巨大的应用价值。
用反相高效液相色谱(RPLC)对两种化学合成多肽-32肽和21肽进行了分离、纯化和制备,能够提高多肽的纯度。
基于此,文章主要对多肽反相液相色谱法的分离、纯化与制备进行了简单的分析与研究。
关键词:多肽;反相液相;分离、纯化、制备引言多肽是氨基酸以肽链连接形成的化合物,其多肽在临床医学中有着较高的应用价值。
在现代化生物技术的影响下,多肽化学合成技术水平也在不断提升,但是,由于多肽化学合成的产物成分比较复杂,对其混合物进行分离提纯优化就显得格外重要。
只有对多肽化学产物进行分离提纯,才能提高多肽产物的纯度,保证多肽的药用价值。
1反相液相色谱法概述反相液相色谱法是液相色谱分离模式中使用最为广泛的一种,该方法具有柱效高、分离能力强、保留机理清楚等优点,对于生物大分子、蛋白质及酶的分离分析,反相液相色谱正受到越来越多的关注。
在分配色谱中,组分在色谱柱上的保留程度,取决于它们在固定相和流动相之间的分配系数,组分在固定相上的保留时间越长,固定相与流动相之间的极性差值越大。
而流动相为极性,固定相为非极性的液相色谱就是反相液相色谱。
2多肽反相液相色谱实验分析2.1实验仪器与试剂选择第一,实验仪器。
选用型号为SCL-10AVP液相色谱仪,该色谱仪包括系统控制器、LC-10ATVP色谱泵、进样阀、SPD-M10AVP二极管阵列检测器、CLASS-VP5.33色谱工作站。
色谱柱为200×4mmID的不锈钢管,用匀浆法装填德国进口Nucleosil4000-7C18反相色谱填料。
KQ-250型超声波清洗器、TLL-C台式冷冻离心机、E-Pure纯水器。
第二,试剂。
试剂选择色谱纯乙腈、三氟乙酸(TFA)、32肽、21肽粗品。
2.2实验方法将合成多肽粗品用含乙腈水溶液溶解后,离心,保留上清液,弃去沉淀。
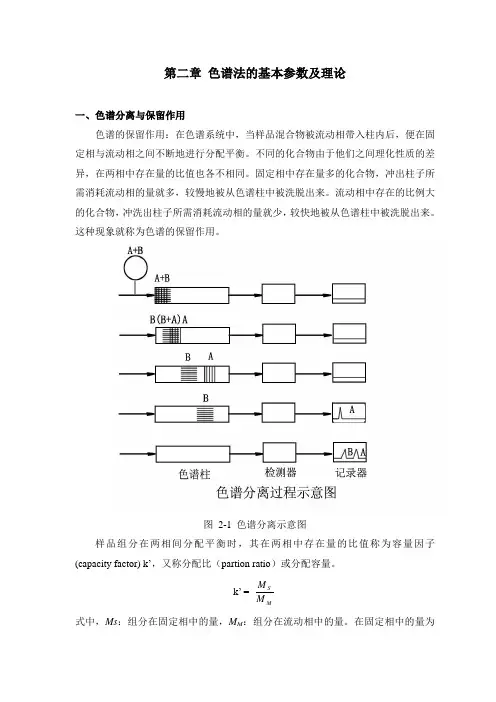
第二章 色谱法的基本参数及理论一、色谱分离与保留作用色谱的保留作用:在色谱系统中,当样品混合物被流动相带入柱内后,便在固定相与流动相之间不断地进行分配平衡。
不同的化合物由于他们之间理化性质的差异,在两相中存在量的比值也各不相同。
固定相中存在量多的化合物,冲出柱子所需消耗流动相的量就多,较慢地被从色谱柱中被洗脱出来。
流动相中存在的比例大的化合物,冲洗出柱子所需消耗流动相的量就少,较快地被从色谱柱中被洗脱出来。
这种现象就称为色谱的保留作用。
图 2-1 色谱分离示意图样品组分在两相间分配平衡时,其在两相中存在量的比值称为容量因子(capacity factor) k ’,又称分配比(partion ratio )或分配容量。
k ’ = MS M M 式中,Ms :组分在固定相中的量,M M :组分在流动相中的量。
在固定相中的量为零的化合物,其k ’=0,这些组分被称为在该色谱条件下的非保留物质。
容量因子(分配比)可通过实验计算:k ’ =MR t t ' 。
即k ’为组分在固定相中消耗的时间与其在流动相中消耗的时间之比。
样品组分在两相中分配平衡时,其在固定相和流动相中的浓度比称为分配系数(partion factor ),分配系数以K 表示。
其公式如下:Ms c c K ==组分在流动相中的浓度组分在固定相中的浓度 K =m m S S V M V M // = k ’· S m V V 式中,Ms/Vs 为样品组分在固定相中的浓度,M m /V m 为样品组分在流动相中的浓度。
分配系数大的组分保留时间长(色谱的保留作用强),分配系数小的组分保留时间短(色谱的保留作用弱)。
K = k ’· Sm V V = k ’· β 式中β = Sm V V 称为相比率,即色谱柱中流动相体积与固定相体积之比。
例在毛细管GC 中壁涂空心柱的相比为:β = 固定相体积(柱中)流动相体积(柱中) = dfrl l r ⋅ππ22 = df r 2式中r为毛细管柱横截面的半径,d f为柱内壁固定液的膜厚。

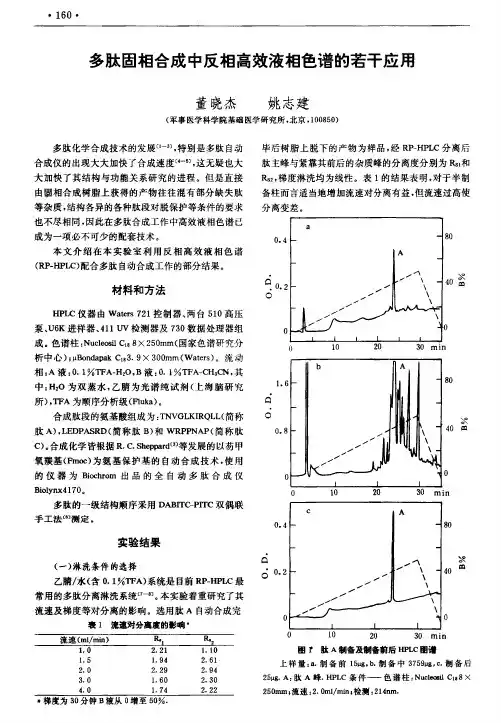
四种神经肽的反相高效液相色谱法分离刘雪松 田津斌 方 明 许 伟 韩济生(北京医科大学神经科学研究中心,北京100083)摘 要 以反相高效液相色谱法(R P2H PL C)分离甲硫脑啡肽(M EK)、亮脑啡肽(L eu2EN K)、强啡肽A1217(D yn A1217)、胆囊收缩素(CCK28s)。
色谱柱为Z O RBA XC18(211mm I D×150mm);流动相:乙腈 水 三氟乙酸(T FA),梯度洗脱,紫外检测器检测:U V215nm。
上述条件下,四种神经肽在微克水平得到较好分离。
关键词 反相高效液相色谱法;甲硫脑啡肽;亮脑啡肽;强啡肽A1217;胆囊收缩素 在H PL C中,分离纯化肽最常用的是R P2 H PL C,回收率较高、分离效果好[1~2],但某些场合不太适用,例如用放射免疫方法对神经肽进行定量分析时,如果用缓冲盐作为流动相,放免分析前要对样品进行脱盐预处理,导致样品损失。
本方法对四种与镇痛及抗镇痛有关的神经肽进行了分离并获得了比较满意的效果。
1 仪器与试剂岛津L C26A(U21)型高效液相色谱仪、7125手控进样器、岛津SPD26AV紫外检测器和C2R3A色谱数据处理机。
M EK、L eu2EN K、D yn A1217、CCK28s,(Sigm a公司);乙腈(色谱纯;中科院上海脑研所上海脑海生物科技公司);三氟乙酸(T FA,F luka公司);超纯水为M illi po re处理后的去离子水。
2 色谱条件色谱柱为Z O RBA X C18反相柱(211mm I D ×150mm,填料粒径5Λm、孔径300∼);保护柱(5mm×150mm,填料为C18,10Λm)。
梯度洗脱神经肽所用的流动相:A液为含011%T FA的纯水,B液为含011%T FA的乙腈,在0~30m in内流动相中B液的终浓度从15%上升到45%。
紫外检测器检测波长为215nm,检测灵敏度0116AU FS,输出信号由CR23A数据处理机处理。


小肽的营养原理与应用技术小肽的营养原理与应用技术蛋白质营养在动物营养中占有非常重要的地位,尤其在蛋白质饲料原料价格猛涨的时期,如何使动物充分而合理地利用饲料蛋白质已成为动物营养学家们和整个饲料行业所关注的问题,也就是要在满足畜禽营养需要的基础上,尽可能降低饲料中的蛋白质水平,从而在获得高生产性能的同时,降低畜禽排泄物中含氮物质的含量、降低养殖业对环境造成的污染。
肽是指氨基酸间彼此以肽键 (酰胺键)相互连接的化合物,含有少量 (2一6个)氨基酸残基的肽称为小肽或寡肽。
其中,寡肽通常是指由2一9个氨基酸构成的肽,而小肽则特指由2一3个AA构成的OP(徐风霞,2004)。
在传统的蛋白质代谢模式中,人们认为蛋白质必须水解成游离氨基酸后才能被吸收利用,所以,长期以来,游离氨基酸一直被认为是主要的吸收形式。
有关必需氨基酸、理想蛋白质、可利用氨基酸等应用理论,都是在这一观点上建立起来的。
动物营养学家们发现,动物对饲料中各种氨基酸的利用程度并不完全受单一限制性氨基酸水平的影响,也并不完全遵循营养学经典理论"木桶法则"。
另外,喂给动物按理想氨基酸模式配制的纯合饲料或低蛋白质氨基酸平衡饲料时,也不能获得最佳的生产状态。
因而,一些学者提出了完整蛋白质或其降解产生的小肽也能被动物直接吸收的观点,小肽营养的研究开始受到重视。
20世纪50一60年代,Agor首先观察到肠道能完整的吸收转运双苷肽。
此后,Ne-way 和Smith证实了肽可以完整转运吸收的观点:小肽载体在小肠黏膜上被发现;小肽I型和Ⅱ型载体分别被克隆。
从20世纪80年代以来20年的研究表明,蛋白质在动物消化道中消化酶作用下的水解终产物大部分是2个或3个氨基酸残基组成的小肽 (简称SP).它们以完整形式被吸收进人循环系统从而被组织利用。
近年来,国内外学者对小肽的研究主要集中在吸收机制、吸收速率的影响因素、吸收部位、活性肽的作用及机体对小肽的利用等方面 (于辉,2003)。

常州工程职业技术学院毕业设计报告(论文)( 2009 届)系别:制药与生物工程技术系课题名称:利用反相高效液相色谱分析和制备多肽指导教师:郝志芳班级:化学制药0611班学生姓名:刘骏摘要随着现代生物技术的发展,出现了各种多肽类药物,多肽在临床医学中有巨大的应用价值。
自从发明固相法化学合成多肽以来,有关各种活性多肽的化学合成有了很大发展[1] ,但产物成分比较复杂,一般是以目标多肽为主的几种结构相似的多肽混合物,因此,对其分离纯化的最优化研究就显得格外重要。
此外,提供高纯度的多肽样品,对于其物化性质、生物活性及其医药功能的研究具有重要的作用。
从现代分离科学理论得出,色谱和电泳是目前所知的分离效果最佳的两种方法。
电泳仅能用于分离而不能用于多肽的制备[2 ~4]。
反相高效液相色谱(RP-HPLC) 具有分离效果好、分辨率高、回收率高的特点,在多肽的分离纯化和制备中备受青睐,因此,RP-HPLC是目前分离纯化和制备多肽的主要手段[4~9] 。
本文拟用RP-HPLC对化学固相合成的多肽进行分离和制备。
关键词:多肽;反相高效液相色谱;分离;制备As the development of modern biological technology, many peptide medicines have been invented and produced. In the field of the clinical medicine, the peptide holds the massive value. Since the invention of the solid phase synthesis, chemical synthesis related a great number of activated peptide has skyrocket advancement [1]. However, the production contains certain impurities which have the similar structure as contrast the target peptide, therefore, it is important that the optimization research of the purification. And then, high purity peptide also can help the research of the physical and chemical character, biological activity and medicament function.We can conclude that the chromatography and electrophoresis are the best isolation effect methods at present.Nevertheless, the electrophoresis only use the qualitative experiments not preparation [2 ~4]. RP-HPLC holds high isolation, resolution and recycle ratio. As the upward reasons, RP-HPLC is the major method of the peptide purification in this world[4~9].Key W ords: Peptide; RP-HPLC; Separation; Preparation1前言与文献综述 (1)1.1 HPLC简介 (1)1.1.1HP LC起源 (1)1.1.2H P LC发展 (2)1.1.3HP L C前景 (3)1.1.4HP L C原理 (4)1.1.5R P-H P L C的应用与优点 (5)1.2多肽的简介 (6)1.2.1 多肽的合成方法 (6)1.2.2多肽的应用 (7)2多肽的纯化实验 (10)2.1仪器以及用具 (10)2.2试剂 (10)2.3实验方案 (10)3结果与讨论 (12)3.1粗肽的RP-HP LC分析 (12)3.2粗肽的RP-HP LC制备 (13)3.3ES I-MS以及纯品纯度的鉴定 (14)4结论 (17)致谢 (18)参考文献 (19)第一章前言及文献综述1.1色谱法(LC)、高效液相色谱(HPLC)以及反相高效液相色谱(RP-HPLC)的简介色谱法又称色谱分析、色谱分析法、层析法,是一种分离和分析方法,在分析化学、有机化学、生物化学等领域有着非常广泛的应用。
特异性小肽亲和整体柱对单抗药的富集纯化策略研究随着单克隆抗体药物在药学、治疗学和诊断学上的迅猛发展,发展单克隆抗体药物的富集纯化技术变得十分重要。
目前使用最为广泛的是以蛋白质A为亲和配基的琼脂糖亲和色谱,虽然该方法特异性强,但是配基存在成本高、稳定性差、配基易脱落、易降解、对pH敏感、寿命短等缺点,同时,琼脂糖基质导致的非特异性吸附也为后续的纯化分析带来极大的困难。
小肽配基价格低廉、化学性质稳定、生物相容性好、洗脱条件非常温和、使用寿命长,是替代蛋白质A的最佳候选者之一。
另一方面,有机聚合物整体色谱柱的基质是由原位聚合得到的聚合物,具有孔隙度高、比表面积大、表面易修饰、耐酸碱性好等优点,更重要的是通过改变交联剂的种类可以显著降低材料表面的非特异性吸附。
本文的研究重点就是将小肽配基与有机聚合物整体材料相互结合,使用不同的制备方案,充分利用两者各自的优势,将其用于单克隆抗体药物的富集纯化。
同时结合小肽配基的研究现状,对小肽亲和整体柱在单抗药物富集纯化方面的应用潜力、发展方向进行了展望。
第一章,系统介绍了蛋白纯化技术的分类及发展现状和小肽配基亲和纯化策略研究概况,并对其在单抗药物富集纯化中的应用研究进行了详细研讨,探讨了小肽配基与整体材料相结合的优势。
同时总结了常见的两大类制备方法对整体柱色谱性能的影响及各自带来的优缺点,并在此基础上提出了本论文的研究思路、实验方案及创新点。
第二章,His-tag-DAAG被设计作为亲和配基,首次利用金属螯合多步法制备取得DAAG功能化亲和整体柱,该制备方法首先以甲基丙烯酸缩甘油酯(GMA)作为单体,乙二醇二甲基丙烯酸酯(EDMA)作为交联剂,偶氮二异丁腈(AIBN)为引发剂,水、异丙醇和1,4-丁二醇作为三元生孔体系,制备取得基质整体柱poly(GMA-co-EDMA);然后,利用开环反应,将螯合剂N,N-双(羧甲基)-L-赖氨酸(ANTA)固定于材料表面;接着,硫酸镍灌柱获得固定化镍离子亲和整体柱;最后,将修饰后的小肽配基His-tag-DAAG以金属螯合的方式固定于整体柱,获得DAAG 功能化亲和整体柱。
色谱分析(中国药科大学)第2章色谱法的基本参数及理论第二章 色谱法的基本参数及理论一、色谱分离与保留作用色谱的保留作用:在色谱系统中,当样品混合物被流动相带入柱内后,便在固定相与流动相之间不断地进行分配平衡。
不同的化合物由于他们之间理化性质的差异,在两相中存在量的比值也各不相同。
固定相中存在量多的化合物,冲出柱子所需消耗流动相的量就多,较慢地被从色谱柱中被洗脱出来。
流动相中存在的比例大的化合物,冲洗出柱子所需消耗流动相的量就少,较快地被从色谱柱中被洗脱出来。
这种现象就称为色谱的保留作用。
图 2-1 色谱分离示意图样品组分在两相间分配平衡时,其在两相中存在量的比值称为容量因子(capacity factor) k ’,又称分配比(partion ratio )或分配容量。
k ’ = MS M M 式中,Ms :组分在固定相中的量,M M :组分在流动相中的量。
在固定相中的量为零的化合物,其k ’=0,这些组分被称为在该色谱条件下的非保留物质。
容量因子(分配比)可通过实验计算:k ’ =MR t t ' 。
即k ’为组分在固定相中消耗的时间与其在流动相中消耗的时间之比。
样品组分在两相中分配平衡时,其在固定相和流动相中的浓度比称为分配系数(partion factor ),分配系数以K 表示。
其公式如下:Ms c c K ==组分在流动相中的浓度组分在固定相中的浓度 K =m m S S V M V M // = k ’· S m V V 式中,Ms/Vs 为样品组分在固定相中的浓度,M m /V m 为样品组分在流动相中的浓度。
分配系数大的组分保留时间长(色谱的保留作用强),分配系数小的组分保留时间短(色谱的保留作用弱)。
K = k ’· Sm V V = k ’· β 式中β = Sm V V 称为相比率,即色谱柱中流动相体积与固定相体积之比。
例在毛细管GC 中壁涂空心柱的相比为:β = 固定相体积(柱中)流动相体积(柱中) = dfrl l r ⋅ππ22 = df r 2式中r为毛细管柱横截面的半径,d f为柱内壁固定液的膜厚。
反相液相色谱纯化生物肽
反相液相色谱是一种常用的色谱技术,可用于纯化生物肽。
反相液相色谱使用非极性固定相和极性流动相来分离化合物。
对于生物肽的纯化来说,常用的反相固定相为碳链链长较长的
C18或C4链。
流动相通常是由水和有机溶剂(如甲醇、乙腈)混合而成的溶液。
纯化生物肽的反相液相色谱可以按照以下步骤进行:
1. 准备流动相:根据生物肽的性质和溶解度,选择适当的流动相体系,通常是水和乙腈的混合物。
可以尝试不同比例的混合溶剂来优化分离效果。
2. 准备样品:将待纯化的生物肽溶解在适当的溶剂中,以获得所需的初始浓度。
3. 准备色谱柱:选择合适的反相色谱柱,并将其装置在液相色谱系统中。
调节流速、柱温等参数。
4. 进样和分离:使用自动进样器或手动进样器将样品注入色谱柱中。
随着流动相的通过,生物肽将根据其亲水性与非极性固定相相互作用,发生分离。
5. 分析检测:通过紫外-可见光谱测定器或其他检测器检测溶
出物,可实时监测分离过程,以确定目标肽的出现和纯度。
6. 收集样品:根据分析结果,收集纯度较高的目标肽,可以通
过分级洗脱或逐渐增加流动相极性来收集目标肽。
反相液相色谱是一种常用的纯化生物肽的方法,具有分离效果好、灵敏度高、适应性强等优点。
在使用过程中应根据具体情况进行优化,如调整溶剂流动速度、温度和流动相的组成,以达到最佳分离效果。