疏水作用色谱中流动相组成对溶质保留行为的影响
- 格式:pdf
- 大小:182.20 KB
- 文档页数:4

第九节疏水作用色谱疏水作用色谱(Hydrophobic interaction chromatography HIC)是采用具有适度疏水性的填料作为固定相,以含盐的水溶液作为流动相,利用溶质分子的疏水性质差异从而与固定相间疏水相互作用的强弱不同实现分离的色谱方法。
关于在疏水作用色谱条件下进行分离的概念最早在1948年就由Tiselius提出,该技术真正得到发展和应用是在20世纪70年代早期开发出一系列适合进行疏水作用色谱的固定相以后。
此后随着新型色谱介质的开发生产和对机理认识的逐步深人,该技术得到了广泛的应用,并且随着高效疏水作用色谱介质的出现,HIC 已在HPLC平台上被使用,称为高效疏水作用色谱(High performance hydrophobic interaction chromatography HP-HIC)。
由于疏水作用色谱的分离原理完全不同于离子交换色潜或凝胶过滤色谱等色谱技术,使得该技术与后两者经常被联合使用分离复杂的生物样品。
目前该技术的主要应用领域是在蛋白质的纯化方面,成为血清蛋白、膜结合蛋白、核蛋白、受体、重组蛋白等,以及一些药物分子,甚至细胞等分离时的有效手段。
一、疏水作用色谱基本原理(一) 疏水作用疏水作用是一种广泛存在的作用,在生物系统中扮演着重要角色,它是球状蛋白高级结构的形成、寡聚蛋白亚基间结合、酶的催化和活性调节、生物体内一些小分子与蛋白质结合等生物过程的主要驱动力,同时也是磷脂和其他脂类共同形成生物膜双层结构并整合膜蛋白的基础。
根据热力学定律,当某个过程的自由能变化(△G)为负值时,该过程在热力学上是有利的,能够自发发生,反之则不能。
而根据热力学公式△G=△H一T△S (6.9-1) 式中,△G是由该过程的烩变(△H) ,熵变(△S)和热力学温度(T)决定的。
当疏水性溶质分子在水中分散时,会迫使水分子在其周围形成空穴状结构将其包裹,此有序结构的形成会导致熵的减小(△S<0),致使△G为正值,在热力学上不利。


金属螯合亲和色谱中的疏水作用李 蓉31,2 陈国亮2 赵文明11(西安交通大学生命科学与技术学院,西安710049) 2(西北大学化工学院,西安710069)摘 要 通过考察盐溶盐和盐析盐浓度对蛋白质在I D A 裸柱和金属螯合柱上保留行为的影响,详细研究了金属螯合色谱中的疏水作用,疏水作用的发生、形成的条件以及不同条件下对蛋白质保留值的贡献。
实验结果表明,在高浓度和低浓度的盐溶盐以及低浓度盐析盐中,蛋白质在金属螯合柱上的保留主要受静电和配位作用控制,而疏水作用对蛋白质的保留影响很小。
对弱亲和性的金属螯合柱以静电作用为主,其大小可用参数Q 表征;对强亲和性的I D A 2Cu (Ⅱ)柱以配位作用为主。
仅在高浓度的盐析盐中,金属螯合柱才呈现较强的疏水作用,支配蛋白质保留。
实验证明,金属螯合色谱中疏水作用主要来自固定相间隔臂中的疏水碳链和盐析盐对蛋白质的增疏作用,利用这种疏水作用有可能改善金属螯合色谱分离的选择性。
关键词 金属螯合亲和色谱,疏水作用,蛋白质 2004210225收稿;2005201217接受本文系陕西省科委资助项目(No .96H09)1 引 言金属螯合色谱又称固定金属亲和色谱(I M AC ),1975年由Porath 等[1]首先提出,该法是基于蛋白质与固定金属离子的配位作用进行分离。
与其它亲和色谱法相比,金属螯合色谱具有较高通用性、柱容量、柱寿命;色谱柱的制备与再生比较容易;在不同色谱条件下柱子具有多种分离功能[2];多数情况下蛋白质通过柱子仍保持生物活性,并且容易放大和工业化。
由于上述特点,I M AC 技术成为蛋白质识别和分离纯化的重要工具[3]。
关于蛋白质在金属螯合色谱中的保留机理,蛋白质与固定金属间的相互作用以及影响这些作用的因素,相关文献已进行过讨论[4]。
这些作用力主要包括静电与配位作用,但很少涉及疏水作用。
蛋白质在金属螯合色谱中的疏水作用现象,虽然早已发现[5],然而疏水作用产生原因、形成的条件以及不同条件下对蛋白质保留的影响却未深入研究。

疏水色谱的原理和应用疏水色谱是利用样品分子与固定相的疏水力作用的不同,用流动相洗脱时,各组分迁移速度不同而达到分离的目的。
流动相一般为pH6-8的盐水溶液,具有对蛋白质的回收率高,蛋白质变性可能性小等优势。
由于流动相中不使用有机溶剂,也有利于蛋白质保持固有的活性。
疏水作用色谱是在高离子强度的条件下,蛋白质溶解度降低,易吸附在中等疏水性的填料表面。
随着离子强度的降低,蛋白质的溶解度增加,逐步从柱子上洗脱下来。
该法具有高分辨率及保持蛋白质生物活性的特点。
疏水作用色谱的固定相表面为弱疏水性基团,它的疏水性比反相色谱用的固定相低几十到几百倍,而流动相为高离子浓度的盐溶液。
蛋白质分子在这样的固定相和流动相中进行分配,蛋白质分子上的疏水性基团和固定相的疏水基团作用而被保留。
当用流动相洗脱时逐渐降低流动相的离子强度,洗脱能力增强。
利用被分离组分分子表面的疏水微区、(可逆)变性后暴露出的疏水残基,或在高盐环境下暴露于分子表面的疏水残基与固定相的疏水性配体之间的作用强弱,依次用从高至低离子强度洗脱液可将疏水作用由弱到强的组分分离开。
蛋白质分子按其疏水性大小被依次洗脱出来,疏水性小的先流出。
在这样的高盐水溶液中,蛋白质不会失活。
高浓度盐与水分子发生强烈作用,导致疏水分子周围形成空穴的水分子减少,促进疏水性分子与介质的疏水配基之间发生结合。
这种疏水作用的大小取决于固定相和溶质的极性、流动相的组成和浓度。
由于各种蛋白质表面氨基酸残基极性不同,因此有可能通过改变固定相的极性和流动相的组成使蛋白质得到分离。
疏水层析的原理完全不同于离子交换层析或凝胶过滤层析等技术,使该技术与后两者经常联合使用来分离复杂的生物样品。
目前该技术主要应用领域是在蛋白质的纯化方面,成为血清蛋白、膜结合蛋白、核蛋白、受体、重组蛋白等,以及一些药物分子,甚至细胞等分离时的有效手段。
1。
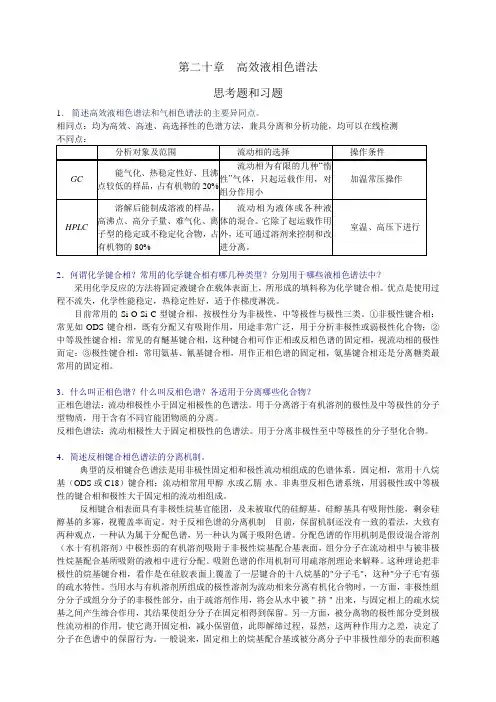
第二十章 高效液相色谱法思考题和习题1. 简述高效液相色谱法和气相色谱法的主要异同点。
相同点:均为高效、高速、高选择性的色谱方法,兼具分离和分析功能,均可以在线检测不同点:2.何谓化学键合相?常用的化学键合相有哪几种类型?分别用于哪些液相色谱法中?采用化学反应的方法将固定液键合在载体表面上,所形成的填料称为化学键合相。
优点是使用过程不流失,化学性能稳定,热稳定性好,适于作梯度淋洗。
目前常用的Si-O-Si-C 型键合相,按极性分为非极性,中等极性与极性三类。
①非极性键合相:常见如ODS 键合相,既有分配又有吸附作用,用途非常广泛,用于分析非极性或弱极性化合物;②中等圾性键合相:常见的有醚基键合相,这种键合相可作正相或反相色谱的固定相,视流动相的极性而定:③极性键合相:常用氨基、氰基键合相,用作正相色谱的固定相,氨基键合相还是分离糖类最常用的固定相。
3.什么叫正相色谱?什么叫反相色谱?各适用于分离哪些化合物?正相色谱法:流动相极性小于固定相极性的色谱法。
用于分离溶于有机溶剂的极性及中等极性的分子型物质,用于含有不同官能团物质的分离。
反相色谱法:流动相极性大于固定相极性的色谱法。
用于分离非极性至中等极性的分子型化合物。
4.简述反相键合相色谱法的分离机制。
典型的反相键合色谱法是用非极性固定相和极性流动相组成的色谱体系。
固定相,常用十八烷基(ODS 或C18)键合相;流动相常用甲醇-水或乙腈-水。
非典型反相色谱系统,用弱极性或中等极性的键合相和极性大于固定相的流动相组成。
反相键合相表面具有非极性烷基官能团,及未被取代的硅醇基。
硅醇基具有吸附性能,剩余硅醇基的多寡,视覆盖率而定。
对于反相色谱的分离机制两种观点,一种认为属于分配色谱,另一种认为属于吸附色谱。
分配色谱的作用机制是假设混合溶剂(水十有机溶剂)中极性弱的有机溶剂吸附于非极性烷基配合基表面,组分分子在流动相中与被非极性烷基配合基所吸附的液相中进行分配。

色谱分配系数k的特点
色谱分配系数的特点如下:
1.反映物质的亲水性与疏水性:分配系数是描述溶质在两相中溶
解度差异的参数,可以反映物质的亲水性或疏水性。
亲水性物质在流
动相中具有更高的溶解度,分配系数较小;疏水性物质则更容易被固
定相吸附,分配系数较大。
2.用于物质的分离和富集:分配系数可以用于物质的分离和富集。
在分离技术中,根据溶质在两相中的不同分配行为,可以通过调节流
动相的性质以实现物质的分离。
分配系数越大,溶质更容易被固定相
吸附,也就更容易被分离和富集。
3.偏析效应:色谱分配系数还可以反映溶质在两相中的偏析效应。
当两相中有多种物质存在时,溶质与固定相和流动相之间的相互作用
会导致分配系数的变化。
这种偏析效应可以用来研究混合物中各成分
的分离特性。
4.与物质结构相关:分配系数的值与溶质的结构和性质有关。
通
常来说,具有较大分子量、较长碳链、较高极性或较多官能团的物质
具有较大的分配系数。
这是因为这些结构特征使得溶质更容易与固定相相互作用,从而被固定相吸附。
5.温度依赖性:分配系数的值通常随着温度的升高而增大。
这是因为在较高的温度下,溶质的扩散速率增加,有利于固定相和流动相之间的相互作用,从而增大了分配系数。

第九节疏水作用色谱疏水作用色谱(Hydrophobic interaction chromatography HIC)是采用具有适度疏水性的填料作为固定相,以含盐的水溶液作为流动相,利用溶质分子的疏水性质差异从而与固定相间疏水相互作用的强弱不同实现分离的色谱方法。
关于在疏水作用色谱条件下进行分离的概念最早在1948年就由Tiselius提出,该技术真正得到发展和应用是在20世纪70年代早期开发出一系列适合进行疏水作用色谱的固定相以后。
此后随着新型色谱介质的开发生产和对机理认识的逐步深人,该技术得到了广泛的应用,并且随着高效疏水作用色谱介质的出现,HIC已在HPLC平台上被使用,称为高效疏水作用色谱(High performance hydrophobic interaction chromatography HP-HIC)。
由于疏水作用色谱的分离原理完全不同于离子交换色潜或凝胶过滤色谱等色谱技术,使得该技术与后两者经常被联合使用分离复杂的生物样品。
目前该技术的主要应用领域是在蛋白质的纯化方面,成为血清蛋白、膜结合蛋白、核蛋白、受体、重组蛋白等,以及一些药物分子,甚至细胞等分离时的有效手段。
一、疏水作用色谱基本原理(一) 疏水作用疏水作用是一种广泛存在的作用,在生物系统中扮演着重要角色,它是球状蛋白高级结构的形成、寡聚蛋白亚基间结合、酶的催化和活性调节、生物体内一些小分子与蛋白质结合等生物过程的主要驱动力,同时也是磷脂和其他脂类共同形成生物膜双层结构并整合膜蛋白的基础。
根据热力学定律,当某个过程的自由能变化(△G)为负值时,该过程在热力学上是有利的,能够自发发生,反之则不能。
而根据热力学公式△G=△H一T△S (6.9-1) 式中,△G是由该过程的烩变(△H) ,熵变(△S)和热力学温度(T)决定的。
当疏水性溶质分子在水中分散时,会迫使水分子在其周围形成空穴状结构将其包裹,此有序结构的形成会导致熵的减小(△S<0),致使△G为正值,在热力学上不利。




HPLC中固定相和流动相在色谱分析中,如何选择最佳的色谱条件以实现最理想分离,是色谱工作者的重要工作,也是用计算机实现HPLC分析方法建立和优化的任务之一。
以下是填料基质、化学键合固定相和流动相的性质及其选择。
一、基质(担体)HPLC填料可以是陶瓷性质的无机物基质,也可以是有机聚合物基质。
无机物基质主要是硅胶和氧化铝,无机物基质刚性大,在溶剂中不容易膨胀;有机聚合物基质主要有交联苯乙烯-二乙烯苯、聚甲基丙烯酸酯,有机聚合物基质刚性小、易压缩,溶剂或溶质容易渗入有机基质中,导致填料颗粒膨胀,结果减少传质,最终使柱效降低。
1、基质的种类:1)硅胶硅胶是HPLC填料中最普遍的基质。
除具有高强度外,还提供一个表面,可以通过成熟的硅烷化技术键合上各种配基,制成反相、离子交换、疏水作用、亲水作用或分子排阻色谱用填料。
硅胶基质填料适用于广泛的极性和非极性溶剂。
缺点是在碱性水溶性流动相中不稳定。
通常,硅胶基质的填料推荐的常规分析pH范围为2~8。
硅胶的主要性能参数有:①平均粒度及其分布。
②平均孔径及其分布,与比表面积成反比。
③比表面积:在液固吸附色谱法中,硅胶的比表面积越大,溶质的k值越大。
④含碳量及表面覆盖度(率):在反相色谱法中,含碳量越大,溶质的k值越大。
⑤含水量及表面活性:在液固吸附色谱法中,硅胶的含水量越小,其表面硅醇基的活性越强,对溶质的吸附作用越大。
⑥端基封尾:在反相色谱法中,主要影响碱性化合物的峰形。
⑦几何形状:硅胶可分为无定形全多孔硅胶和球形全多孔硅胶,前者价格较便宜,缺点是涡流扩散项及柱渗透性差,后者无此缺点。
⑧硅胶纯度:对称柱填料使用高纯度硅胶,柱效高,寿命长,碱性成份不拖尾。
2)氧化铝具有与硅胶相同的良好物理性质,也能耐较大的pH范围。
它也是刚性的,不会在溶剂中收缩或膨胀。
但与硅胶不同的是,氧化铝键合相在水性流动相中不稳定。
不过现在已经出现了在水相中稳定的氧化铝键合相,并显示出优秀的pH稳定性。
DNA疏水相互作用色谱是一种用于分离和纯化DNA的技术,其原理基于DNA与疏水相互作用的特性。
在疏水相互作用色谱中,使用了含有疏水性固定相的柱子,通过DNA分子与固定相之间的疏水作用来实现DNA的分离。
具体原理如下:
1.疏水性固定相:色谱柱填充有疏水性固定相,常用的固定相包括疏水性树脂或疏水
修饰的聚合物。
这些固定相具有较强的疏水性质,能够与DNA中的疏水部分发生相互作用。
2.DNA样品加载:待分离的DNA样品通过柱子时,DNA分子中的碱基对和疏水区域
会与固定相发生疏水相互作用,从而使DNA分子滞留在色谱柱中,而非极性或疏水性较低的杂质则会迅速流过色谱柱。
3.洗脱:在DNA样品加载完成后,通过改变溶剂条件(如溶剂类型、浓度或pH 值
等),可以改变DNA与固定相之间的相互作用强度,进而实现DNA分子的逐步洗脱。
DNA疏水相互作用色谱的原理基于DNA分子的结构特性和与固定相的相互作用,通过调控疏水相互作用的强度来实现DNA的选择性吸附和洗脱分离。
这种方法通常用于分离DNA的不同构象或大小,以及用于DNA的富集和纯化等应用。
烟台师范学院学报(自然科学版)Yantai No r ma l U niv er sity Jo ur na l (Na tural Science )2002,18(2):135—140综述 收稿日期:2002-01-24 作者简介:王云(1974—),男,讲师,理学硕士,主要从事生物大分子分离纯化研究.疏水色谱法及其在生物大分子分离纯化中的应用王 云1,常 玲2,吴金男1(常熟高等专科学校,1.生化系;2.人事处;江苏常熟215500)摘要:综合评述了疏水相互作用色谱法(hydro pho bic inter actio n ch roma tog raphy ,HI C )的理论及其在生物大分子分离纯化方面的研究进展.关键词:疏水相互作用色谱法;分离纯化;生物大分子中图分类号:O 658;Q 51 文献标识码:A 文章编号:1004-4930(2002)02-0135-06 在生物工程下游技术中通常需要从复杂的混合体系中分离提纯生物活性物质.色谱法因其具有较高的分辨能力而成为一种主要的分离手段(如凝胶过滤色谱法、离子交换色谱法、亲和色谱法和疏水相互作用色谱法等).其中,疏水相互作用色谱法(hydropho bic interactio n chro mato g raphy ,HIC )是利用蛋白质表面疏水性区域与固定相上疏水性配基相互作用力的差异,将不同蛋白质组份分离开来.与离子交换色谱法、亲和色谱法相比,疏水相互作用色谱法中,蛋白质与固定相的相互作用力较弱,蛋白质活性在色谱分离过程中不易丧失[1].因此,自1972年文[2]成功地利用疏水相互作用色谱法分离纯化糖原磷酸化酶以来,疏水相互作用色谱法得到了广泛地应用.近几年来,该法在研究蛋白质的折叠机理和结构等方面也有重要的应用[3,4].1 疏水相互作用色谱法的原理 和其他色谱方法一样,疏水相互作用色谱法是利用样品中各组份与色谱填料上配基相互作用力的差异,在洗脱时由于各组份移动速度的不同而达到分离的目的.配基通常是一些疏水性基团,如丁基、苯基等.蛋白质表面多由亲水性基团组成,也有一些由疏水性较强的氨基酸(如亮氨酸、缬氨酸和苯丙氨酸等)组成的疏水性区域.不同种类蛋白质的表面疏水性区域多少不同,疏水性强弱也不同;对于同一种蛋白质在不同介质中,其疏水性区域(裂隙)伸缩程度也不同,从而使疏水性基团暴露的程度呈现出一定的差异.疏水相互作用色谱法正是利用盐-水体系中样品组份的疏水性基团和色谱填料的疏水性配基相互作用力的不同而使样品组份得以分离的.136烟台师范学院学报(自然科学版)第18卷 已有文献虽然对蛋白质在疏水色谱柱上的保留机理进行了大量研究,但到目前为止尚无统一的说法,主要有以下几种观点. 1)疏溶剂化理论(solv o phobic theo ry) 文[5,6]在“空穴理论”(cavity theo ry)的基础上提出了“疏溶剂化理论”,认为蛋白质与色谱填料之间的相互作用分两步:首先,在填料表面的水层中形成一空穴,然后蛋白质分子填充到这一空穴中,并被吸附在色谱填料的表面.蛋白质与色谱填料表面的相互作用包括范德华力和静电相互作用力.在疏水相互作用色谱中,起初随着盐浓度的增加,由于静电相互作用力的增强,蛋白质结合量减少,容量因子(K′)也降低;当盐浓度继续上升时,疏水相互作用力成为主要作用力,蛋白质结合量、容量因子均随之上升,当盐浓度足够高时,log K′与盐摩尔浓度呈现线性关系:Log K′=ΔA e m+c.式中,A是配基和蛋白质暴露在流动物中表面结合与非结合区域的比值,e 为摩尔表面张力增量(盐的一个特征常数),m为摩尔浓度,c为与盐无关的一个常数.因此,高盐浓度可以增加溶剂的表面张力和蛋白质在疏水色谱填料上的滞留时间.部分盐的摩尔表面张力增量见表 1.表1 几种盐的摩尔表面张力增量[7]盐KClO3NaCl Na2HPO4M gSO4(N H4)2SO4K2SO4Na2SO4M g Cl2e/[N(m·mol)-1] 1.40 1.64 2.02 2.10 2.16 2.58 2.73 3.16 2)优先水化理论(preferential interactio n model) 该理论是由Arakaw a[8]提出的,他认为,在高盐浓度下,盐被从紧邻的区域排斥出来,因为蛋白质优先进行水化,因此盐的存在增大了体系的自由能,且自由能增量与蛋白质表面的疏水区域成正比.分子间疏水基团间的相互作用可以减少蛋白质分子上疏水基团与极性分子的接触,从而减弱这种自由能的增加.因此,在高盐浓度下,与疏水性配基结合的蛋白质从热力学角度来看要比没结合的蛋白质稳定,即在高盐浓度下,蛋白质疏水性区域有减少与水接触的倾向;蛋白质与疏水性配基的结合是伴随着它暴露在极性溶剂中非极性表面减少而进行的.文[9]则认为蛋白质在色谱柱上的保留行为取决于蛋白质构象的变化,盐对表面张力的影响与疏水相互作用并不存在着象M elander描述的简单的相互关系,而是蛋白质构象经常发生变化,不同的疏水色谱填料、不同种类及浓度的盐对这种蛋白质构象变化有不同的影响,这种构象变化有利于蛋白质表面相互作用区域的暴露,从而有利于疏水相互作用.2 疏水色谱填料 疏水色谱填料通常由惰性基质(inert suppo rt)和共价连接在基质上的配基组成. 1)基质(suppo rt,matrix) 多聚糖(如琼脂糖)是疏水色谱填料最常用的基质,它具有表面基团丰富、较宽的p H使用使用范围及与生物大分子良好的相容性等优点,但其机械强度不能用于高压疏水色谱.另外,在与配基偶联时常需剧毒CN Br活化.目前有采用其他一些多糖类物质作为疏水色谱填料基质的报道,如文[10]用壳聚糖为基质研制出了一种新型的疏水色谱填料,并成功地用于T-淀粉酶的分离纯化.另外一种常用的疏水色谱填料基质是硅胶,其最大的优点是机械强度好,可用于高压色谱.但硅胶作为色谱填料基质,只有形成Si O Si C键或Si C键的键合相衍生物才稳定.另外,其p H使用范围较多聚糖相比较窄(p H 2—8).近年来,采用表面包被一层高分子材料的硅胶作基质,然后在高分子表层上共价连接上疏水配基作疏水色谱填料,这样可以兼有两种色谱填料基质的优点. 2)配基(ligand ) 疏水色谱填料配基的一个重要特征是具弱疏水性,与蛋白质作用温和,从而能保证蛋白质的生物活性不丧失.疏水色谱填料配基密度一般较低,碳链长度一般在C 4C 8之间.烷基、苯基是目前常用的疏水色谱填料配基.但有时由于结合力过强,使蛋白质难以被洗脱下来,需用一些高离液序列盐类(chao tro pic salt)或有机溶剂作洗脱液,但此时蛋白质极易丧失生物活性.3 影响疏水色谱的因素 1)不同盐类对疏水色谱的影响 有些盐(如Na 2SO 4,(N H 4)2SO 4等)可以提高蛋白质的稳定性,使其溶解度下降,对蛋白质有盐析效应,使蛋白质与固定相的疏水作用增强;有些盐(如M g Cl 2)虽然能增加溶剂表面张力,但同时也增加蛋白质的溶解度,并不能增强蛋白质与色谱填料的相互作用.盐的种类不同,不仅影响着蛋白质在色谱柱上的保留行为,同时也影响着蛋白质分离纯化的效果[11].不同种类的盐对蛋白质与疏水色谱填料相互作用的影响遵循Hofmeister 顺序[12].对于阴离子,PO 3-4>SO 2-4>C H 3COO ->Cl ->Br ->NO -3;对于阳离子,N H +4>Rb +>K +>Li +>Mg 2+>Ca 2+>B a 2+(盐析能力强的盐能增加蛋白质与色谱填料的相互作用). 2)盐浓度对疏水色谱的影响 盐浓度也影响着蛋白质在色谱柱上的选择性吸附[13].在疏水色谱中,平衡液及样品中的高盐浓度能促进蛋白质与配基的相互作用,在一定盐浓度范围之内,蛋白质的吸附量与盐浓度成线性关系.被吸附的蛋白质可以通过降低盐浓度而被洗脱下来. 3)p H 对疏水色谱的影响 流动相的p H 值是影响蛋白质在色谱柱上保留行为的一个重要因素.pH 的改变必然改变蛋白质的电荷性质及电荷量,从而影响蛋白质与色谱填料间的静电相互作用,也影响蛋白质在色谱柱上的保留行为.文[14]等曾报道,增大缓冲液的p H 值至9—10,能使蛋白质与配基之间疏水相互作用力减弱.文[15]等发现,pH 值在 5.0—8.5范围内,p H 值变化对细胞色素c 和溶菌酶在色谱柱上保留行为的影响微乎其微;但当p H >8.5或pH <5.0时,p H 的变化则能引起蛋白质在色谱柱上保留行为的剧烈变化.由于每一种蛋白质在某一特定p H 条件下,其空间构象、所带电荷情况不一致,因此,pH 对蛋白质在色谱柱上保留行为的影响具有一定的复杂性. 4)柱温对疏水色谱的影响[16] 疏水相互作用是一吸热过程,增加温度可以提高蛋白质与配基间疏水相互作用力;在一定范围之内,柱温和容量因子之间的关系满足ln K ′=ln j -ΔG /R T .其中R 为气体常数,j 为相比,T 为绝对温度.因此,增加柱温有利于蛋白质的吸附,但同时温度上升易使蛋白质变性失活. 5)添加剂对疏水色谱的影响 在疏水色谱的洗脱液中有时要加入一些添加剂(如水溶性醇(乙醇、乙二醇))、去污剂(如Trito n X-100)等.它们可以通过竞争结合到疏水配基137第2期王 云,等:疏水色谱法及其在生物大分子分离纯化中的应用138烟台师范学院学报(自然科学版)第18卷 上,而使结合在柱上的蛋白质更易被洗脱下来.4 疏水色谱法成功用于蛋白质分离纯化的实例 疏水色谱法是一种非常有效的分离纯化技术,它和其他分离手段组合在一起已成功地对多种蛋白质进行了分离纯化(表2).表2 疏水色谱法用于分离纯化蛋白质的部分实例名称来源柱型收率/%文献细菌霉素基因工程Butyl-Sepharose68[17]CD4-抗体鼠Phenyl-Sepharose57[18]溶菌酶牛Phenyl-Sepharose91[19]V K依赖凝血因子细胞Phenyl-Sepharose—[20]脂肪酶细菌PEG-Seph aros e50[21]纤维素酶细菌Epxo-Sepharose60[22]己糖激酶兔Phenyl-Sepharose90[23]乳酶脱氢酶牛Phenyl-Sepharose82[24]淀粉酶细菌n-amyl-Chitosan82[10]抗凝血酶血浆TSK-Ph en yl—[25]W-内毒素基因工程Phenyl-Sepharose65[26]神经元钙传感蛋白大肠杆菌TSK-Ph en yl—[27]性纤维化质粒载体大肠杆菌Butyl-Sepharose90[28]变性质粒大肠杆菌Butyl-Sepharose—[29]5 展望 随着基因工程的飞速发展,下游技术中分离纯化已显得越来越重要.疏水相互作用色谱法,由于其具有色谱条件温和、不易使蛋白质变性失活等优点,被成功地用于多种蛋白质的分离纯化.天然状态的核酸,其疏水基团(碱基)包埋在分子中心,与色谱填料的疏水相互作用较弱;变性核酸,由于其碱基暴露在外部,可与色谱填料形成疏水相互作用.利用这一特性,文[28,29]指出疏水相互作用色谱法可成功地用于基因工程核酸产物(如质粒、基因疫苗等)的分离纯化.因此,疏水相互作用色谱作为一种有效的分离纯化手段,必将在生物大分子的分离纯化领域得到广泛地应用.另外,变性蛋白质经过疏水色谱柱以后,可以得到一系列连续的复性中间体,因此疏水色谱也可以用于蛋白质的折叠机理和结构研究[3,4].参考文献:[1] Rengier F E.The ro le of pro tein st ructure in chro matog r aphic behav io r[J].Science,1987,238:319—323.[2] Er-el Z,Zaidenaig Y,Shaltiel S.Hydr ocar bo n-coa ted sephar ose use in purification of glycog en-pho spho rilase[J].Biochem B io phy s Res Co mmun,1972,49(2):383—390.[3] Arakaw a T,Tima sheff S N.M echanism o f pr otein sa lting in a nd salting o ut by div a lent ca tio nsalts :bala nce betw een hy dration and salt binding [J ].Biochemist ry ,1984,23:5912—5923.[4] Geng X D ,Chang X Q.High-per for mance h ydro pho bic inter actio n chr oma tog raphy a s a to ol fo rpro tein r efolding [J].J Ch ro ma tog r A ,1992,599:185—194.[5] M ela nder W ,Cor radini D,Hov ath C.Salt media ted retentio n of pro teins in hydr oph obic interac-tio n ch roma tog ra phy :application of so lv ophobic theo ry [J ].J Chr omato g r A ,1984,317:67—85.[6] Singa nog lu O ,Abdulnur S.Effect of w ater a nd o ther solv ents o n the structure of bio po ly mers[J].Fed Pro c,1965,24:12—23.[7] M elande r W ,Horv a th C .Salt effect s on hy drophobic inter actio n in pr ecipitatio n and chro mato g ra-ph y o f pro teins :an inte rpreta tio n o f lyo tro pic se ries [J ].Arch B io chem Bio phy s ,1977,183:200_215.[8] Arkaw a T.Ther modynamic analy sis o f th e effect of concentrated salts on pr otein inte ractio n withhydr ophobic and po ly saccharide co lumns [J ].Arch Biochem Bioph ys ,1986,248:101—105.[9] Oscar sso n S .Influe nce o f sa lts on pro tein interactions at interfaces o f amphiphilic polymer s andadsor be nts [J].J Ch ro matog r B,1995,666:21—31.[10] 王云,郭敏亮,姜守磊,等.一种疏水色谱填料的特性及应用研究[J].色谱,2000,18(4):354—356.[11] Rippel G ,Szepesy L .Hydro pho bic interactio n chro mato g raph y of pro teins o n an alkyl -supe ro secolumn [J].J Chr oma to g r A,1994,664,27—32.[12] Pah lman S,Ro seng ren J,Hjer ten S.Hydr oph obic interac tio n ch ro ma tog ra phy o n uncha rg edsepha ro se deriv ativ es :effects of neutral sa lts on the adso rptio n o f pro teins [J ].J Chro matog r ,1977,131:99—108.[13] O sca rsson S,Ka rsna s P.Sa lt-pro moted adso r ption o f pro teins onto amphiphilic ag a rose-base ad-sor bents Ⅱ:effects o f salt and salt concentration [J].J Ch roma tog r A,1998,803:83—93.[14] Po ra th J ,Sunderberg L ,Fo rnstedt N ,et al .Salting -o ut in amphiphilic g els a s a new appro ach tohydr ophobic adso rption [J].N ature ,1977,245:465—466.[15] Hjerten S,Ya o K ,Eriksso n K O ,Johansso n B .Gradient and isocra tic high-per for mance hydro pho -bic inter actio n chro matog r aphy o f pr o teins o n ag aro se co lumn [J ].J Ch ro ma tog r A ,1986,359:99—109.[16] El Rassi Z.Rece nt prog r ess inrev er sed-phase and hydro pho bic interactio n chro mato g raph y o f ca r-bohydr ate species [J].J Chro matog r A,1996,720:93—118.[17] Brend S ,M anuela W ,et al .Hy drophobic interac tio n ch roma tog raphy fo r th e purifica tio n of cy-to ly tic bacterial toxins [J ].J Chr oma tog ra A ,1994,667:131—139.[18] Gause A H,M ilito n A D.Purifica tio n and a na ly tic char acteriza tio n of a n anti-CD4monoco lo na lantibo dy for huma n the rapy [J].J Chro matog r A,1994,661:13—23.[19] N opple W Hasse ns .Simple two -step pro cedure o f hig hly activ e pure equine milk lyso zym e [J ].JChro mato g r,1996,719:327—331.[20] Ho lg er H,M alco lm D W.Seper atio n o f human vitamin k-depend co agulatio n pro tein using h y-dro pho bic interaction ch ro matog ra phy [J].J Chr oma to g r,1999,566:77—88.[21] Dio go M M ,Cabral M S .Pr elimina ry study on h ydro pho bic inte ractio n chro mato g raph y ofchro ba cterium visco sum lipa se on poly pr oplyene g ly co l immo blized o n sephar ose [J ].J Chro -mato g r,1998,796:177—180.139第2期王 云,等:疏水色谱法及其在生物大分子分离纯化中的应用140烟台师范学院学报(自然科学版)第18卷 [22] Belew M,Zho u Y.Purifica tion r eco mbinant huma n g r anulocy te-macr ophage clony stimula tingfacter the inclusio n bodies produced by t ransefo r med Escherichia coli cells[J].J Chro matog r, 1994,679:67—83.[23] Ceccar oli P,Ca rdo ni C.Seper atio n of hex o kina se ac tiv ity using differ ent h ydro pho bic intera ctio nchro mato gr aphic suppo r t[J].J Chr oma to g r B,1997,702:275—284.[24] Per-Erikn G,Anders A.Super po ro us ag r ose beads a s a hydro pho bic inter actio n chr oma tog raphysuppo rt[J].J Chro matog r A,1999,830:275—284.[25] Go ra n K,Stefan W.Sepera tio n o f nativ e and latent fo rms of huma n antithro mbin by hy drophobichig h-perfo rma nce liquid chro mato g raphy[J].Pro tein Ex pr essio n a nd Purificatio n,2001,21:149—155.[26] Rat nesh C,Vinod B,Rakesh T.The W-endo tox in pr otein accumula te in Escherichia coli as a pro-tein-DN A co mplex that can be dissocia ted by hy drophobic inter actio n ch ro matog ra phy[J].Pro-tein Ex pressio n and Purificatio n,2000,20:21—26.[27] Jon R F,Yog endr a S,Sheila I,et a l.Purificatio n o f my risto ylated a nd no nmyristo yla ted neuro na lcalcium sensor-1using sing le-step hydro pho bic interactio n chro matog r aphy[J].Pro tein Ex pres-sio n a nd Purificatio n,2000,20:66—72.[28] Diog o M M,Queir o z J A,M o nteir o G A,e t a l.Purification o f a cystic fibrosis pla smid v ecto r fo rg ene ther apy using h ydro pho bic inter actio n chr oma tog raphy[J].B io tech Bioeng,2000,68:576—583.[29] Diog o M M,Queiro z J A,M o nteir o G A,et al.Sepe ration a nd analysis of plasimd dena tured fo rmsusing hy dr ophobic inte ractio n chr oma tog raphy[J].Analytica l bio chemistry,1999,275:122—124.Hydrophobic interaction chromatography and its applicationin purification of biopolymersW ANG Yun1,C HANG Ling2,W U Jin-na n1(1.Department of Biology and Ch emistry;2.Pers onnel D ivision;Ch angs hu College,Changsh u215500,China)Abstract:The dev elopment of hydrophobic interaction chromatog raphy(HIC)is mainly concerned in this a rticle.Several theo ries fo r the retention m echa nism of pro tein in HIC and main parameters related to chroma tog raphic behavio r are review ed respectively.The selected exam ples of proteins purified by HIC are also presented.Key words:hydro phobic interaction chrom atog raphy;iso latio n and purificatio n;bio poly-m ers(责任编辑 司丽琴)。
第九节疏水作用色谱疏水作用色谱(Hydrophobic interaction chromatography HIC)是采用具有适度疏水性的填料作为固定相,以含盐的水溶液作为流动相,利用溶质分子的疏水性质差异从而与固定相间疏水相互作用的强弱不同实现分离的色谱方法。
关于在疏水作用色谱条件下进行分离的概念最早在1948年就由Tiselius提出,该技术真正得到发展和应用是在20世纪70年代早期开发出一系列适合进行疏水作用色谱的固定相以后。
此后随着新型色谱介质的开发生产和对机理认识的逐步深人,该技术得到了广泛的应用,并且随着高效疏水作用色谱介质的出现,HIC已在HPLC平台上被使用,称为高效疏水作用色谱(High performance hydrophobic interaction chromatography HP-HIC)。
由于疏水作用色谱的分离原理完全不同于离子交换色潜或凝胶过滤色谱等色谱技术,使得该技术与后两者经常被联合使用分离复杂的生物样品。
目前该技术的主要应用领域是在蛋白质的纯化方面,成为血清蛋白、膜结合蛋白、核蛋白、受体、重组蛋白等,以及一些药物分子,甚至细胞等分离时的有效手段。
一、疏水作用色谱基本原理(一) 疏水作用疏水作用是一种广泛存在的作用,在生物系统中扮演着重要角色,它是球状蛋白高级结构的形成、寡聚蛋白亚基间结合、酶的催化和活性调节、生物体内一些小分子与蛋白质结合等生物过程的主要驱动力,同时也是磷脂和其他脂类共同形成生物膜双层结构并整合膜蛋白的基础。
根据热力学定律,当某个过程的自由能变化(△G)为负值时,该过程在热力学上是有利的,能够自发发生,反之则不能。
而根据热力学公式△G=△H一T△S (6.9-1) 式中,△G是由该过程的烩变(△H) ,熵变(△S)和热力学温度(T)决定的。
当疏水性溶质分子在水中分散时,会迫使水分子在其周围形成空穴状结构将其包裹,此有序结构的形成会导致熵的减小(△S<0),致使△G为正值,在热力学上不利。
用芳香醇同系物研究疏水色谱的保留机理
芳香醇是一类具有特殊芳香气味的有机化合物,用芳香醇同系物研究疏水色谱
保留机理既具有理论价值,又有重要的实际应用价值。
在芳香醇小分子的研究中,疏水色谱技术的应用是对它的质谱行为的关键研究。
由于芳香醇小分子的极性较小,受极性作用疏水色谱柱很难通过传统的极性梯度方法获得分离极限,在大多数情况下,由于其疏水性,在柱表面几乎没有保留,因此难以实现分离分析。
为了解决芳香醇小分子的分离问题,专家研究了相对较新的保留机理,即芳香
醇同系物研究疏水色谱的保留机理。
在这种保留机理中,将芳香醇小分子与其自身的氨基或含硫替代物或其它电离型同系物结合,将芳香醇及其同系物构成一个由静电作用矩形组成的化合物,新形成的化合物具有明显的极性,易在柱表面发生氢键或疏水性保留作用,使得柱表面的分子贴附,从而实现良好的分离效果。
以上是芳香醇同系物研究疏水色谱保留机理的原理。
芳香醇同系物研究疏水色
谱保留机理不仅能够有效地解决芳香醇小分子的分离问题,而且能够更好地发挥质谱技术信息丰富的优势,极大地丰富疏水色谱技术的应用范围。
流动相组成对丹皮酚保留值的影响一、目的要求1、掌握流动相组成对保留值的影响。
2、熟悉高效液相色谱仪的使用。
二、仪器与试剂仪器:LC-20AT型高效液相色谱仪,超声清洗器,超纯水器,微孔滤膜,微量进样器,注射器,试剂:甲醇(色谱纯),超纯水。
丹皮酚样品(药学系学生天然药物化学实验提取),丹皮酚标准品(中国生物制品检验中心购买)三、方法原理在反相高效液相色谱法,流动相的极性总是大于固定相的极性,固定相最常用的是非极性的十八烷基硅烷键合硅胶,而可做流动相的溶剂种类则很多。
并且可以组成不同配比的二元或多元溶剂系统。
反相高效液相色谱法中流动相极性增大,洗脱能力降低;流动相极性减小,洗脱能力增强。
四、色谱条件色谱柱:Zorbax Eclipse XDB-C18色谱柱(150×4.6mm)流动相:甲醇-水流速:1ml/min检测器:SPD-20A五、操作步骤1. 开机准备①流动相按要求用过滤装置过滤,超声脱气30分钟。
②用流动相配制一定浓度的样品和标准品(浓度相近),用微孔滤膜过滤。
2.开机打开泵A和泵B的电源开关,将排液阀逆时针旋转180°按purge,灯remote亮,液晶显示purging line,等待,此时仪器自动排除气体;待液晶显示…ML、AX20.0、…MPA、MIN0.0…时,排气结束,将排液阀顺时针旋转180°,按pump键,灯pump亮。
②打开检测器电源开关,仪器自检,待液晶显示…nm OVER,自检结束。
③打开电脑主机和显示器。
3.方法设置双击LC-solution(如要求填写密码,直接点击“确定”)双击“分析”进入实时分析页面,左上方显示“LC:就绪”,窗口下方点击“正常”“简单设置”-时间程序0.01min(默认);泵:“等浓度洗脱”,设泵A(水):0.3ml/min、泵B(甲醇):0.7ml/min;(注:泵A、泵B流速之和为总流速),(或“二元高压”,总流速1.0min,B泵70% )。
强极性中药组分的亲水作用色谱保留行为韩超;戴小军;雷根虎;卫引茂【摘要】采用亲水作用色谱模式,以二醇基硅胶为固定相,水-有机溶剂为流动相,通过改变流动相中有机溶剂种类及浓度、缓冲盐、有机酸种类及其浓度、柱温等条件,研究了强极性中药组分在亲水作用色谱中的保留行为.结果表明: 流动相中水的比例在0~100%(V/V)变化时,溶质保留呈"U"型曲线,属于亲水色谱和反相色谱的混合保留机理.水含量在0~50%(V/V)范围时,亲水作用控制溶质的保留.溶质保留随流动相中缓冲盐浓度的增大而增强.对于酸性溶质,其保留随有机酸三氟乙酸、甲酸、乙酸的酸性降低而增大.【期刊名称】《分析化学》【年(卷),期】2010(038)011【总页数】5页(P1615-1619)【关键词】亲水作用色谱;二醇色谱柱;强极性化合物;保留行为【作者】韩超;戴小军;雷根虎;卫引茂【作者单位】西北大学合成与天然功能分子化学教育部重点实验室,化学与材料科学学院,西安,710069;西北大学合成与天然功能分子化学教育部重点实验室,化学与材料科学学院,西安,710069;西北大学合成与天然功能分子化学教育部重点实验室,化学与材料科学学院,西安,710069;西北大学合成与天然功能分子化学教育部重点实验室,化学与材料科学学院,西安,710069【正文语种】中文亲水作用色谱(HILIC)的概念是Alpert于1990年提出的[1]。
该技术是采用极性固定相,有机溶剂-水为流动相的一种分离技术,能有效保留反相色谱中保留不完全或不保留的强极性样品,目前已被广泛应用于蛋白质、肽、氨基酸、寡核苷酸、糖和天然产物提取物的分析和分离中[2,3]。
其中,天然产物的分离与分析对于中药研究有重要意义。
中药通常是以水煎给药,其水溶性成分中包含着大量的强极性组分。
这些强极性组分可能是中药活性组分的重要组成部分,或者对中药发挥药效起着重要作用[4]。
对于中药中复杂组分,以反相色谱和HILIC组成的二维色谱有可能对中药各组分进行有效分离[4,5]。