配位化学发展简史及基本概念
- 格式:ppt
- 大小:2.43 MB
- 文档页数:81





第1章配位化学导论配位化学(coordination chemistry)是无机化学的一个重要分支学科。
配位化合物(coordination compounds)(有时称络合物complex)是无机化学研究的主要对象之一。
配位化学的研究虽有近二百年的历史,但仅在近几十年来,由于现代分离技术、配位催化及化学模拟生物固氮等方面的应用,极大地推动了配位化学的发展。
它已广泛渗透到有机化学、分析化学、物理化学、高分子化学、催化化学、生物化学等领域,而且与材料科学、生命科学以及医学等其他科学的关系越来越密切。
目前,配位化合物广泛应用于工业、农业、医药、国防和航天等领域。
1.1 配位化学发展简史历史上记载的第一个配合物是普鲁士蓝。
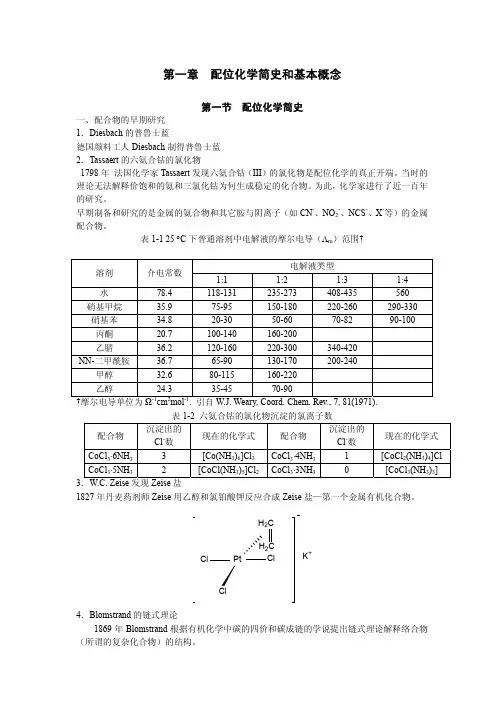
它是1704年由柏林的普鲁士人迪斯巴赫(Diesbach)制得,它是一种无机颜料,其化学组成为Fe4[Fe(CN)6]3·nH2O。
但是对配位化学的了解和研究的开始一般认为是1798年法国化学家塔萨厄尔(B.M.Tassaert)报道的化合物CoCl3·6NH3,他随后又发现了CoCl3·5NH3、CoCl3·5NH3·H2O、CoCl3·4NH3以及其他铬、铁、钴、镍、铂等元素的其他许多配合物,这些化合物的形成,在当时难于理解。
因为根据经典的化合价理论,两个独立存在而且都稳定的分子化合物CoCl3和NH3为什么可以按一定的比例相互结合生成更为稳定的“复杂化合物”无法解释,于是科学家们先后提出多种理论,例如,布隆斯特兰德(W.Blomstrand)在1869年、约尔更生(S.M.Jørgensen)在1885年分别对“复杂化合物”的结构提出了不同的假设(如“链式理论”等),但由于这些假设均不能圆满地说明实验事实而失败。
1893年,年仅27岁的瑞士科学家维尔纳(A.Werner)发表了一篇研究分子加合物的论文“关于无机化合物的结构问题”,改变了此前人们一直从平面角度认识配合物结构的思路,首次从立体角度系统地分析了配合物的结构,提出了配位学说,常称Werner配位理论,其基本要点如下:(1) 大多数元素表现有两种形式的价,即主价和副价;(2) 每一元素倾向于既要满足它的主价又要满足它的副价;(3) 副价具有方向性,指向空间的确定位置。





第一章配位化学的基本概念一、什么是配位化合物二、配合物的组成三、配合物的命名四、配合物的异构现象一、什么是配位化合物1. 配合物的形成1.1 铜氨络离子的形成•向氯化铜溶液中逐滴加入NH3·H2O溶液,首先得到蓝色Cu(OH)2沉淀。
•继续向溶液中加入NH3·H2O溶液,Cu(OH)2沉淀则逐渐溶解,溶液变为深蓝色•向溶液中加入95%乙醇,则可以得到深蓝色沉淀,抽滤后,取少量沉淀,用水溶解,加入过量NaOH (10%)溶液,溶液无明显变化CuSO4 + 2NH3·H2O → Cu(OH)2↓ + 2NH4+NH3·H2O——-——→ [Cu(NH3)4]SO4(深蓝色) + 4H2O[Cu(NH3)4]SO4 ——配位化合物[Cu(NH3)4]2+ ——配离子(1)定义:具有孤对电子的离子或分子和具有空轨道的原子或离子组成的化合物。
二、配合物的组成内界: 中心体(原子或离子)与配位体,以配位键成键外界:与内界电荷平衡的相反离子(1)中心离子(或原子):提供空的价电子轨道①过渡金属阳离子。
②某些非金属元素:如[SiF6]2-中的Si(IV) 。
③中性原子:如Ni(CO)4和Fe(CO)5中的Ni 和Fe(2)配体的分类按配体所含配位原子的数目分:单齿配体:只含一个配位原子的配体(NH3,H2O等)多齿配体:含有两个或两个以上的配位原子的配体(3)配位数:直接与中心原子结合的配位原子的数目。
①若为单齿配体,配位数=配位体数。
例:[Ag(NH3)2]+ 、[Cu(NH3)4]2+、[CoCl3(NH3)3]和[Co(NH3)6]3+的配位数分别为2、4、6和6。
②若为多齿配体,配位数≠配位体数。
例:[Cu(en)2]2+的配位数为4,Cu-edta的配位数为6。
一般中心原子的配位数为2,4,6,8。
最常见的4,6。
而5,7或更高配位数则较少见。
(4)配离子的电荷:中心原子和配体电荷的代数和。
配位化学史
配位化学是化学的一个分支,研究形成有机和无机化合物中的中心金属离子(称为配位中心)和周围配体之间的结构、性质和反应。
配位化学起源于18世纪末和19世纪初的化学研究,当时化学家开始注意到一些化合物中金属离子与其他分子之间的特殊相互作用。
然而,直到19世纪中叶,配位化学的独立分支才开
始发展起来。
在19世纪,研究人员开始注意到一些群体非常稳定地与金属
离子结合,并且能够形成命名化合物。
这些分子或离子被称为配体,可以通过与金属离子形成配位键。
在19世纪中叶,法
国化学家亨利·卡斯规定了一组基本的配位化合物形成规则,
为配位化学奠定了基础。
随着对配位化学的研究的不断深入,越来越多的配体和配位化合物被发现。
在20世纪初,研究人员开始提出有关配位键的
理论模型。
对于有机金属化合物,研究人员提出了茂金属的结构和反应机理。
随着X射线晶体学的发展,研究人员能够解
析配位化合物的结构,从而揭示了它们的空间构型和键的类型。
在20世纪50年代和60年代,配位化学得到了广泛的发展和
应用。
研究人员发展了许多用于合成和控制配位化合物性质的方法。
此外,他们还研究了配位化合物在催化、光化学和磁性材料方面的应用。
现代配位化学也与生物无机化学及其在药物设计和生物催化等领域的应用有着密切的关联。
总的来说,配位化学的发展经历了几个关键的阶段,包括发现和命名配体、提出配位键的理论模型以及应用于不同领域的研究。
该领域的研究为我们对金属离子和配位化合物性质的理解提供了重要的基础,也为材料科学和生物无机化学方面的研究提供了重要的支持。