配位化学-发展史和基础知识概要
- 格式:ppt
- 大小:3.10 MB
- 文档页数:90


配位化学的发展史摘要自从1893年瑞士化学家维尔纳创立配位化学已来,配位化学理论得到不断发展,逐渐完善。
经过化学家们100多年的努力,由传统经典的配合物,发展到今天的配位超分子化合物,并显示出结构和功能上的优越特性,成为现代无机化学的一个发展方向。
关键词配位化学晶体工程配位超分子化学自从1893年瑞士化学家维尔纳(Werner)在德国《Journal of Inorganic Chemistry》上发表了题为“对于无机化合物结构的贡献”的配位化学方面的第一篇经典著作之后[1],原本作为无机化学分支的配位化学发展极为迅速,并始终处于无机化学研究的主流。
配位化学的发展打破了传统的有机化学和无机化学之间的界限,在众多配合物中金属离子和有机配体形成的配合物以其花样繁多的价键形式和空间结构,在化学键理论发展、配合物性能等多样性方面引起了人们广泛的研究兴趣。
1 经典配位化学的产生和发展配合物的记载在很早就有,国外文献[2]最早记录的配合物—普鲁士蓝(Prussian Blue)是在1704年,其化学结构是FeIII4[FeII(CN)6]3,距今已有300年历史了。
我国《诗经》记载“缟衣茹藘”,“茹藘在阪”,实际上是二羟基蒽醌和铝钙离子生成红色配合物(比普鲁士蓝发现早2000多年)。
最早关于配合物的研究是1798年法国塔索尔特(Tassert)关于黄色氯化钴([Co(NH3)6]Cl3)的研究,他在CoCl2溶液中加入NH3•H2O 后没有得到Co(OH)3,而是得到了桔黄色结晶,起初认为是一种复合物(CoCl3•6NH3),但他在该桔黄色结晶的溶液中加碱后得不到NH3,也检查不出Co3+离子的存在,可见Co3+与NH3是紧密结合在一起的,而加AgNO3后却得到了AgCl沉淀,证明Cl-是游离的。
塔索尔特的报道使一些化学家开始研究这类化合物,因为当时的原子价理论不能解释这类化合物,故称之为复杂化合物,即络合物。


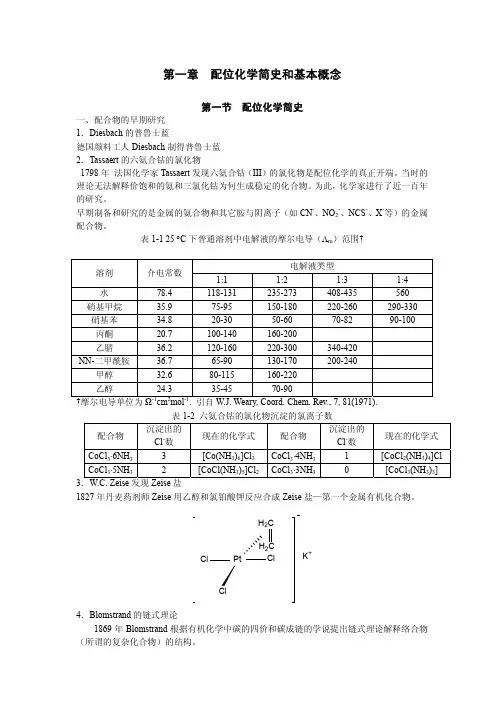
第一章配位化学的早期历史及Werner配位理论第一节早期研究及链式理论一、早期研究1、配合物的发现最早记录:1704年,德国Diesbach得到的普鲁士蓝KCN.Fe(CN)2.Fe(CN)3。
研究开始:1793年Tassaert发现CoCl3.6NH3当时无法解释稳定的CoCl3和NH3为何要进一步结合2、配合物性质研究1)Cl-沉淀实验(用AgNO3)配合物可沉淀Cl-数目现在化学式CoCl3.6NH3 3[Co(NH)6]Cl33CoCl3.5NH3 2 [Co(NH3)5Cl]Cl2CoCl3.4NH3 1 [Co(NH3)4Cl2]ClIrCl3.3NH3 0 [Ir(NH3)3Cl3]2)电导率测定配合物摩尔电导(Ω-1) 离子数目现在化学式PtCl4.6NH3 523 5[Pt(NH)6]Cl43PtCl4.4NH3 229 3 [Pt(NH3)4Cl2]Cl2PtCl4.2NH3 0 0 [Pt(NH3)2Cl4]二.链式理论(Chain theory)1869年瑞典Lund大学Blomstrand教授及其学生Jorgensen(后任丹麦Copenhagen大学教授)提出链式理论。
—第二节Werner配位理论一、Werner配位理论1891年,瑞士苏黎士(Zurich)大学的Werner教授,提出新的配位理论学说。
基本观点如下:1)大多数元素有两种类型的价:即主价(---)和副价(—)。
分别相当于现在的氧化态和配位数。
2)每种元素都倾向于既满足它的主价又要满足它的副价。
3)副价指向空间的确定位置。
*主要贡献:1)提出了副价的概念(现称配位数)。
2)奠定了配合物的立体化学基础。
二、对实验结果的解释副价结合更为稳定,不易解离。
2.影响配位数的因素1)空间因素(空间位阻):A、中心金属B、配体例:镧系元素的配合物2)中心原子的氧化态Pt(II), 4;Pt(IV), 6。
第四节配体类型依据与中心原子形成配位键的数目,可将其分为:1)单齿配体例:H2O、NH3、PMe32)双齿配体H2NCH2CH2NH2N NN1、配离子1)配体名称放在中心原子之前;2)不同配体之间以圆点(·)隔开;3)配体数目以二、三、四表示(一可省略);4)最后一个配体名称后缀以“合”字;5)如果中心原子不止一种氧化数,可在其后的圆括号中用罗马数字表示。



配位化合物结构理论发展简史1.配合物结构的早期理论配合物(coordination compound),早期也称为络合物(complex compound)。
配合物的早期发现与性质的研究,主要得益于17世纪末18世纪初欧洲染料工业发展的需求。
第一个金属配合物—普鲁士兰KFeFe(CN)6或KCN·Fe(CN)2·Fe(CN)3,即是由一个德国柏林的颜料工人Diesbach于1704年制得的。
但是配位化学的真正开端,是以1799年Tassert发现六氨合钴(Ⅱ)氯化物CoCl3·6NH3为标志的。
因为CoCl3和NH3都是价饱和的稳定化合物,它们又以何种形式而结合成另一种很稳定的化合物呢?这对当时的化学家来说是一道难题,因此引起了进一步研究的极大兴趣。
在科学实验中,化学家们制得了许多这类化合物,并且认真地研究了它们的性质。
如对三价钴盐与氨的化合物的性质研究表明,化合物不仅因氨分子的数目不同而有不同的颜色,而且钴络盐中氯的行为也有所不同,即化合物颜色酸性AgNO3实验CoCl3·6NH3橙黄色用AgNO3可沉淀出3C1—CoCl3·5NH3红紫色用AgNO3可沉淀出2C1—Co Cl3·5NH3·H2O 玫红色用AgNO3可沉淀出3C1—CoCl3·4NH3绿色用AgNO3可沉淀出lCl—为了解释这些实验事实,不少人都曾企图采用扩大原子价规则的办法。
但这方面的尝试均未成功。
2.Werner的配位理论1893年仅26岁化学家Werner(1913年获得诺贝尔化学奖),提出了他的配位学说,认为:(1)一些金属的原子价除主价外,还可以有副价,而且,元素倾向于既满足它的主价又要满足它的副价。
例如在CoCl 3 4NH 3中,钻的主价为三,副价为四,即三个氯离子满足了钻的主价,与氨分手的结合使用了副价。
(2)络合物分为“内界”和“外界”。



绪论导课:配位化学一般是指金属和金属离子同其他分子或离子相互反应的化学。
它是在无机化学的基础上发展起来的一门独立的、同时也与化学各分支学科以及物理学、生物学等相互渗透的具有综合性的学科。
配位化学所涉及的化合物类型及数量之多、应用之广,使之成为许多化学分支的汇合口。
现代配位化学几乎渗透到化学及相关学科的各个领域,例如分析化学、有机金属化学、生物无机化学、结构化学、催化活性、物质的分离与提取、原子能工业、医药、电镀、燃料等等。
因此,配位化学的学习和研究不但对发展化学基础理论有着重要的意义,同时也具有非常重要的实际意义。
一、配位化学的任务配位化学是研究各类配合物的合成、结构、性质和应用的一门新型学科。
配合物的合成是重点,结构与性质研究是难点,研究方法是关键。
应用是落脚点。
二、配位化学的学科基础配位化学的学科基础是无机化学,分析化学、有机化学、物理化学和结构化学。
配位化学已成为许多化学分支的汇合口。
配位化学是许多新兴化学学科的基础。
如:超分子化学,酶化学,蛋白质化学,生物无机化学,材料化学,化学生物学,药物化学,高分子化学等。
三、配位化学的研究方法1、合成方法:要求掌握有机和无机化学的合成技术,特别是现今发展起来的水热技术、微波技术、微乳技术、超临界技术等。
2、结构研究:元素分析、紫外光谱、红外光谱、质谱、核磁共振、荧光光谱、X-衍射等。
3、性质研究:电位滴定、循环伏安、磁天平、变温磁化率、交流磁化率、电子顺磁共振、光电子能谱、E-扫描、催化性质、凝胶电泳、园二色谱、核磁共振研究与细胞及DNA 的作用。
4、应用:催化反应用于有机合成、金属酶的模拟、分子识别、金属药物、非线性光学材料、分子磁体、介孔材料、分子机器等。
四、配位化学的学习方法1、课前预习:在上课以前,把下一次课的内容先粗略的看一次,把自己看不懂的内容做上记号,有时间再认真的看一次,如果仍看不懂,做好记录,等待课堂解决。
2、上课:根据课前预习的难度,对较难理解的部分认真听讲,理解教师的分析思路,学习思考问题和解决问题的方法。