核酮糖1,5-二磷酸羧化酶提取液
- 格式:doc
- 大小:48.50 KB
- 文档页数:2

核酮糖1,5-二磷酸羧化酶羧化活性的测定一、实验原理核酮糖-1,5-二磷酸核酮糖羧化/加氧酶是光合作用中一个关键酶,它在Calvin 循环中催化中催化CO2的固定,生成2分子的3-磷酸甘油酸(3-PGA),同时它是一个双功能酶,又能催化将O2加在核桐糖-1,5-二磷酸(RuBP)上生成1分子的磷酸乙醇酸和1分子的PGA ,这两个反应的速率由O2和CO2的浓度调节[1]。
分光光度酶偶联法是根据RuBP 羧化酶催化RuBP 与CO2反应产生的磷酸甘油酸与NADH 的氧化作用相偶联的原理设计的。
当加入ATP 及NADH 后,NADH 在PGK 和GAPDH 的催化下氧化为NAD+,每羧化l mol RuBP 有2 mo1 NADH 被氧化,根据在波长340 nm 处光密度的变化,可测知NADH 的数量,从而算出同化CO2的值。
Rubisco 羧化活性的测定可用酶偶联法将3-PGA 的变化转换为NADH 的变化来测定。
RuBP+CO2+H2O −−−−→−+2Mg RuBPC ,2(3-PGA)3-PGA+ATP −−−−−→−-磷酸甘油激酶31,3-二磷酸甘油酸+ADP 1,3-二磷酸甘油酸+NADH −−−−−−→−-磷酸脱氢酶甘油醛-33-磷酸甘油醛+NAD++PO43+ 二、实验仪器及材料 2.1实验仪器研钵、分光光度计、秒表、比色杯、冷冻离心机 2.2实验材料小麦叶片 三、实验步骤1.核酮糖-1,5-二磷酸核酮糖羧化/加氧酶活性额测定1.1称取0.1 g 新鲜叶片,放于已经预冷的研钵中。
1.2加入1 mL ,4℃提取缓冲液(50 mM Tricine-NaOH pH 7.9, 0.1% PVP-40, 5 mM MgCl2)冰上研磨,(缓冲液分3次加入,第一次0.5ml ,剩下两次分别0.25ml 将研钵冲洗干净),将研好的样品装入1.5ml 的离心管中,放于冰盒中。
12000 g ,4℃,离心10 min 。

《植物生理学》问答题1、试述植物光呼吸和暗呼吸的区别。
答:比较项目暗呼吸光呼吸底物葡萄糖乙醇酸代谢途径糖酵解、三羧酸循环等途径乙醇酸代谢途径发生部位胞质溶胶、线粒体叶绿体、过氧化物酶体、线粒体发生条件光、暗处都可以进行光照下进行对O2、CO2浓度的反应无反应高O2促进,高CO2抑制2、光呼吸有什么生理意义答:(1)光呼吸使叶片在强光、CO2不足的条件下,维持叶片内部一定的CO2水平,避免光合机构在无CO2时被光氧化破坏。
(2)光呼吸过程消耗大量O2,降低了叶绿体周围O2浓度和CO2浓度之间的比值,有利于提高RuBP氧化酶对CO2的亲和力,防止O2对光合碳同化的抑制作用。
综上,可以认为光呼吸是伴随光合作用进行的保护性反应。
3、试述植物细胞吸收溶质的方式和机制。
答:(1)扩散:①简单扩散:简单扩散是指溶质从高浓度区域跨膜移向临近低浓度区域的过程。
不需要细胞提供能量。
②易化扩散:又名协助扩散,是指在转运蛋白的协助下溶质顺浓度梯度或电化学梯度的跨膜转运过程。
不需要细胞提供能量。
(2)离子通道:离子通道是指在细胞膜上由通道蛋白构成的孔道,作用是控制离子通过细胞膜。
(3)载体:载体是跨膜转运的内在蛋白,在夸膜区域不形成明显的孔道结构。
①单向运输载体:单向运输载体能催化分子或离子顺电化学梯度单向跨膜转运。
②反向运输器:反向运输器与膜外的H+结合时,又与膜内的分子或离子结合,两者朝相反的方向运输。
③同向运输器:同向运输器与膜外的H+结合时,又与膜外的分子或离子结合,两两者朝相同的方向运输。
(4)离子泵:离子泵是膜上的ATP酶,作用是通过活化ATP推动离子逆化学势梯度进行跨膜转运。
(5)胞饮作用:胞饮作用是指细胞通过膜的内陷从外界直接摄取物质进入细胞的过程。
4、试述压力流动学说的基本内容。
答:1930年明希提出了用于解释韧皮部光合同化物运输机制的“压力流动学说”,其基本观点是:(1)光合同化物在筛管内随液流流动,液流的流动是由输导系统两端的膨压差引起的。

细胞生物学章节习题-第六章一、选择题1、线粒体的细胞色素c是一种(A )。
A. 内膜固有蛋白B. 内膜外周蛋白C. 基质可溶性蛋白D. 外膜固有蛋白2、核酮糖二磷酸羧化酶大亚基和小亚基分别由(D )DNA上的基因编码。
A. 细胞核B. 叶绿体C. 细胞核和叶绿体D. 叶绿体和细胞核3、下列4种色素中,哪个(或哪些)具有吸收聚焦光能的作用而无光化学活性?(D )A. 细胞色素B. 质体蓝素C. 质体醌D. 聚光色素4、线粒体各部位都有其特异的标志酶,其中内膜的标志酶是(A )。
A. 细胞色素氧化酶B.单胺氧化酶C. 腺苷酸激酶D. 柠檬酸合成酶5、在叶绿体中,与光合作用的光反应正常进行相适应的结构是(C )。
A. 叶绿体外膜B. 叶绿体内膜C. 基粒中囊状结构的薄膜D. 基质6、呼吸链主要位于(B )。
A. 线粒体外膜B. 线粒体内膜C. 线粒体基粒D. 线粒体基质E. 线粒体嵴7、线粒体外膜的标志酶是( B )。
A. 细胞色素氧化酶B.单胺氧化酶C. 腺苷酸激酶D. 柠檬酸合成酶8、线粒体膜间隙的标志酶是(C )。
A. 细胞色素氧化酶B.单胺氧化酶C. 腺苷酸激酶D. 柠檬酸合成酶9、氧化磷酸化发生的主要场所位于线粒体(B )。
A. 外膜B. 内膜C. 膜间隙D.基质10、下列哪种细胞中线粒体数量较多(A )。
A. 肌肉细胞B. 血小板C. 红细胞D. 上皮细胞11、下列关于线粒体和叶绿体的描述中,正确的是(C )。
A. 都通过出芽方式繁殖B. 所有线粒体蛋白质合成时都含有导肽C. 它们的外膜比内膜从性质上更接近于内膜系统D. 存在于一切真核细胞当中12、关于线粒体DNA,正确的描述是(B )A. 编码自身必需的部分蛋白质B. 编码自身必需的RNA和蛋白质C. 可以被核基因组取代D. 借助核编码的酶系统进行转录13、关于线粒体和叶绿体中的ATP合酶,下列描述错误的是(B )。
A. 都依靠质子流作为ATP合成的动力B. 合酶的各亚基均由核基因编码C. 都属于质子泵D. 都具有催化ADP和Pi合成ATP的作用二、填空题1、线粒体内膜上电子传递链中的复合物I是由34条以上多肽链或者FMN和至少6个铁硫蛋白;催化NADH的2个电子传给辅酶Q,组成,它的主要功能是催化NADH的2个电子传给辅酶Q,同时发生质子的跨膜输送或者电子传递体和质子位移体。
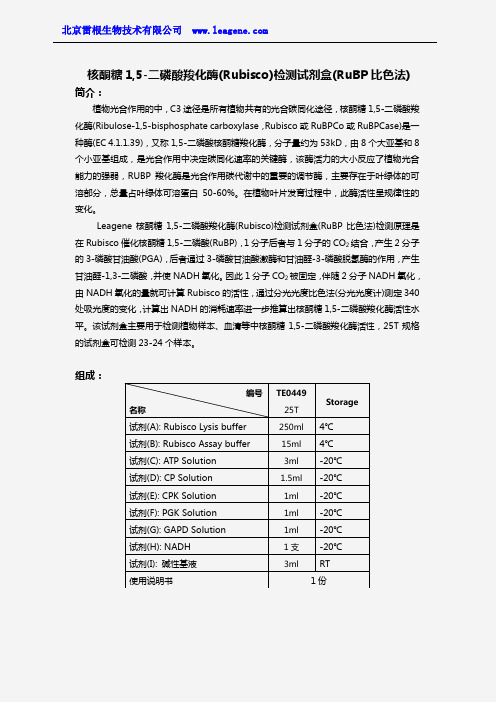
核酮糖1,5-二磷酸羧化酶(Rubisco)检测试剂盒(RuBP比色法)简介:植物光合作用的中,C3途径是所有植物共有的光合碳同化途径,核酮糖1,5-二磷酸羧化酶(Ribulose-1,5-bisphosphate carboxylase,Rubisco或RuBPCo或RuBPCase)是一种酶(EC 4.1.1.39),又称1,5-二磷酸核酮糖羧化酶,分子量约为53kD,由8个大亚基和8个小亚基组成,是光合作用中决定碳同化速率的关键酶,该酶活力的大小反应了植物光合能力的强弱,RUBP羧化酶是光合作用碳代谢中的重要的调节酶,主要存在于叶绿体的可溶部分,总量占叶绿体可溶蛋白50-60%。
在植物叶片发育过程中,此酶活性呈规律性的变化。
Leagene核酮糖1,5-二磷酸羧化酶(Rubisco)检测试剂盒(RuBP比色法)检测原理是在Rubisco催化核酮糖1,5-二磷酸(RuBP),1分子后者与1分子的CO2结合,产生2分子的3-磷酸甘油酸(PGA),后者通过3-磷酸甘油酸激酶和甘油醛-3-磷酸脱氢酶的作用,产生甘油醛-1,3-二磷酸,并使NADH氧化。
因此1分子CO2被固定,伴随2分子NADH氧化,由NADH氧化的量就可计算Rubisco的活性,通过分光光度比色法(分光光度计)测定340处吸光度的变化,计算出NADH的消耗速率进一步推算出核酮糖1,5-二磷酸羧化酶活性水平。
该试剂盒主要用于检测植物样本、血清等中核酮糖1,5-二磷酸羧化酶活性,25T规格的试剂盒可检测23-24个样本。
组成:编号名称TE044925TStorage试剂(A): Rubisco Lysis buffer 250ml 4℃试剂(B): Rubisco Assay buffer15ml 4℃试剂(C): ATP Solution 3ml -20℃试剂(D): CP Solution 1.5ml -20℃试剂(E): CPK Solution 1ml -20℃试剂(F): PGK Solution 1ml -20℃试剂(G): GAPD Solution 1ml -20℃试剂(H): NADH 1支-20℃试剂(I): 碱性基液3ml RT 使用说明书1份自备材料:1、研钵或匀浆器2、离心管3、低温离心机4、恒温箱或水浴锅5、比色杯6、分光光度计操作步骤(仅供参考):1、准备样品:①植物样品:取植物组织清洗干净,切碎,按植物组织:Rubisco Lysis buffer按一定比例,加入预冷的Rubisco Lysis buffer,冰浴情况下充分匀浆或研磨。

核酮糖1,5-二磷酸羧化酶(Rubisco)检测试剂盒(RuBP比色法)简介:植物光合作用的中,C3途径是所有植物共有的光合碳同化途径,核酮糖1,5-二磷酸羧化酶(Ribulose-1,5-bisphosphate carboxylase,Rubisco或RuBPCo或RuBPCase)是一种酶(EC4.1.1.39),又称1,5-二磷酸核酮糖羧化酶,分子量约为53kD,由8个大亚基和8个小亚基组成,是光合作用中决定碳同化速率的关键酶,该酶活力的大小反应了植物光合能力的强弱,RUBP羧化酶是光合作用碳代谢中的重要的调节酶,主要存在于叶绿体的可溶部分,总量占叶绿体可溶蛋白50-60%。
在植物叶片发育过程中,此酶活性呈规律性的变化。
Leagene核酮糖1,5-二磷酸羧化酶(Rubisco)检测试剂盒(RuBP比色法)检测原理是在Rubisco催化核酮糖1,5-二磷酸(RuBP),1分子后者与1分子的CO2结合,产生2分子的3-磷酸甘油酸(PGA),后者通过3-磷酸甘油酸激酶和甘油醛-3-磷酸脱氢酶的作用,产生甘油醛-1,3-二磷酸,并使NADH氧化。
因此1分子CO2被固定,伴随2分子NADH氧化,由NADH氧化的量就可计算Rubisco的活性,通过分光光度比色法(分光光度计)测定340处吸光度的变化,计算出NADH的消耗速率进一步推算出核酮糖1,5-二磷酸羧化酶活性水平。
该试剂盒主要用于检测植物样本、血清等中核酮糖1,5-二磷酸羧化酶活性,25T规格的试剂盒可检测23-24个样本。
组成:编号名称TE044925TStorage试剂(A):Rubisco Lysis buffer250ml4℃试剂(B):Rubisco Assay buffer15ml4℃试剂(C):ATP Solution3ml-20℃试剂(D):CP Solution 1.5ml-20℃试剂(E):CPK Solution1ml-20℃试剂(F):PGK Solution1ml-20℃试剂(G):GAPD Solution1ml-20℃试剂(H):NADH1支-20℃试剂(I):碱性基液3ml RT 使用说明书1份自备材料:1、研钵或匀浆器2、离心管3、低温离心机4、恒温箱或水浴锅5、比色杯6、分光光度计操作步骤(仅供参考):1、准备样品:①植物样品:取植物组织清洗干净,切碎,按植物组织:Rubisco Lysis buffer按一定比例,加入预冷的Rubisco Lysis buffer,冰浴情况下充分匀浆或研磨。

二氧化碳的固定摘要:随着全球经济的不断发展,化石燃料的需求也变得越来越旺盛,随着引发的二氧化碳的大量排放,导致了温室效应的产生。
本文主要介绍了微生物及酶固定二氧化碳的研究进展,以及对二氧化碳的综合利用。
关键词:温室效应;微生物固定;酶固定;综合利用前言C02在大气和水中广泛存在,其含碳量是石油、煤炭和天然气三大能源含碳量的10倍。
而且自从人类社会进入工业化生产以来,地球大气中c02的浓度一直在以每年1.5 ppmv的速度不断地攀升。
C02是大气中主要的温室气体,它直接导致了地球气温的上升及气候异常。
因此CO2作为大气温室气体的主要来源,应当作为温室气体削减与控制的重点,CO2减排是可持续发展的必然要求。
根据气候变化国际控制委员会( IPCC) 的估计,全球气候变暖可能引起冰川融化、全球平均海平面上升,干旱蔓延、作物生产率下降、动植物行为发生变异等自然灾害,热带雨林原田化、牧场化等。
一方面,如何降低二氧化碳排放量,变废为宝,实现其分离回收与综合利用是摆在广大环境科技工作者面前的重要课题。
另一方面,二氧化碳作为地球上最丰富的碳资源,可转化为巨大的可再生资源。
现阶段,二氧化碳的资源化研究已引起人们的密切关注,且其开发前景非常广阔。
一.温室效应的产生以及危害温室效应(英文:Greenhouse gases),又称“花房效应”,是大气保温效应的俗称。
大气能使太阳短波辐射到达地面,但地表受热后向外放出的大量长波热辐射线却被大气吸收,这样就使地表与低层大气温度增高,因其作用类似于栽培农作物的温室,故名温室效应。
自工业革命以来,人类向大气中排入的CO2等吸热性强的温室气体逐年增加,大气的温室效应也随之增强,已引起全球气候变暖等一系列极其严重问题,引起了全世界各国的关注。
温室效应主要带来了以下几种严重恶果:1.地球上的病虫害增加美国科学家曾经发出警告,由于全球气温上升令北极冰层融化,被冰封十几万年的史前致命病毒可能会重见天日,导致全球陷入疫症恐慌,人类生命受到严重威胁。
研究生考试考研植物生理学与生物化学(414)自测试题(答案在后面)一、选择题(植物生理学部分,10题,每题2分,总分20分)1、下列哪项不是植物激素的基本特征?A、生物合成途径独特B、作用微量高效C、具有明显的生理效应D、合成后迅速降解2、在植物光合作用中,光反应和暗反应之间的联系主要通过以下哪项物质进行?A、ATPB、NADPHC、CO2D、H2O3、以下哪项不是植物细胞壁的主要成分?A、纤维素B、果胶C、蛋白质D、脂质4、下列哪项不是植物光合作用中的光合产物?A. 葡萄糖B. 氧气C. 脂肪D. 蛋白质5、关于植物激素乙烯,以下哪项描述是错误的?A. 乙烯是一种气体植物激素B. 乙烯主要在植物成熟过程中发挥作用C. 乙烯能促进果实成熟D. 乙烯能抑制植物生长6、在植物生物化学中,以下哪项不是蛋白质合成的关键步骤?A. 转录B. 翻译C. 激活D. 沉淀7、下列哪个物质是光合作用中的电子受体?A. NADP+B. NADPHC. O2D. ADP8、下列哪个酶在生物体内具有催化蛋白质合成的功能?A. RNA聚合酶B. DNA聚合酶C. 转录酶D. 蛋白质合成酶9、在细胞呼吸过程中,哪个步骤释放的能量最多?A. 糖酵解B. 三羧酸循环C. 细胞色素氧化酶复合体D. 线粒体ATP合酶10、以下哪种物质是植物细胞中能量转换的关键分子?A. 脂肪酸B. 糖类C. 蛋白质D. 核酸二、实验题(植物生理学部分,总分13分)题目:探究植物叶片光合作用过程中光合产物积累的影响因素一、实验目的:1.研究不同光照强度对植物叶片光合作用的影响;2.探究不同CO2浓度对植物叶片光合作用的影响;3.了解植物叶片光合作用过程中光合产物的积累情况。
二、实验材料与仪器:1.实验材料:大豆幼苗、CO2气体发生器、NaHCO3溶液、蒸馏水、黑暗培养箱、光照培养箱、光合测定仪等。
2.实验仪器:显微镜、电子天平、酸碱滴定仪、PH计、电子分析天平等。
1,5-二磷酸羧化酶/加氧酶(Rubisco)植物生理学通讯第43卷第2期,2007年4月363核酮糖.1,5.二磷酸羧化酶/加氧酶(Rubisco)梅杨,李海蓝,谢晋,罗红艺华中师范大学生命科学学院,武汉430079Ribulose-I,5-bisphosphateCarboxylase/oxygenase(Rubisco)MEIY ang,LIHai—Lan,XIEJin,LUOHong—YiCollegeofLifeSciences,CentralChinaNormaliVPl魄Wuhan430079,China提要:文章就核酮糖一1,5.二磷酸羧化酶,加氧酶(Rubisco)的分布,结构,性质,分类与功能的研究进展作了介绍.关键词:核酮糖一1,5一二磷酸羧化酶/加氧酶(Rubisco);Rubisco类似蛋白(RLP);羧化/氧化值;热稳定性;分类核酮糖一1,5一二磷酸羧化酶/加氧酶(ribulose一1,5一bisphosphatecarboxylase/oxygenase,Rubisco)是植物光合作用过程中固定CO,的关键酶,同时也参与植物的光呼吸代谢途径,消耗植物光合作用合成的有机物,由此造成的净光合效率损失高达50%(Lundqvist和Schneider1991;熊晓然等2003;Ashida等2005).因此,研究Rubisco对提高植物的光合作用效率有重要意义.自从1953年Calvin等在研究光合碳循环过程中证实其存在至今,有关Rubisco的一系列问题不断得到阐明,人们对其性质,结构,类型和功能等诸多方面有了更深入的了解,这方面的研究己取得了较大进展,本文就此作介绍.1Rubisco的分布与定位Rubisco广泛分布于具光合功能的细胞器中.它是一个含量很丰富的酶,据估计全世界Rubisco 的量约有4×10吨.Rubisco在C植物中主要定位于叶肉细胞叶绿体问质中,在基粒片层上也有少量分布;在C植物中则定位于维管束鞘细胞中的叶绿体问质内.低等藻类的Rubisco主要定位在淀粉核上.许多化能自养细菌和蓝藻中存在多角形细胞内含物,其中含有大量的羧化酶,称之为羧基化小体.羧基化小体最初是从氧化硫细菌中分离出来的,并且含有大量的Rubisco.有研究表明,羧基化小体是原核生物体内储存Rubisco的重要场所,能够协助Rubisco在低浓度的CO,条件下完成羧化.那不勒斯硫杆菌(Thi0baci,,U neapolitanus)的Rubisco缺陷菌株无羧基化小体的形成,且必须在高浓度的CO,下才能生长(Baker等1998).海洋氢弧菌(Hydrogenovibriomarinus)MH一110在CO,浓度低于0.15%时就会形成羧基化小体(Y oshizawa等2004).2Rubisco的结构采用x射线晶体衍射技术,人们解析了不同来源的Rubisco的晶体结构,包括烟草(Nicotiana tabacum),菠菜(Spinaciaoleracea),深红红螺菌(Rhodospirillumrubrum),莱茵衣藻(Chlamydomonas reinhardtii),蓝藻聚球藻(y,zcDcDcc"PCC 6301),喜温红藻(Galdieriapartite),绿色硫细菌(chlorobiumtepidum),超耐热原始菌(菌, ThermococcuskodakaraensisKOD1)等(Kitano等2001;Parry等2003;Li等2005).Rubisco一般由多个大亚基(LSU)和小亚基(ssu)组成,其中大亚基的分子量为50~55kDa,小亚基为1218kDa(Ashida等2005).大亚基具有催化功能,小亚基仅具有调节作用.迄今的研究认为,Rubisco的大亚基由N,C两个结构域组成.N结构域从N末端开始,包括137个氨基酸,其中含有5股D折叠.C结构域中含有丰富的0c螺旋,其中以0c/D桶状结构域(al Dbarreldomain)最引人注目.它包括8个0c螺旋和8个D折叠,彼此连接成8个环.一个大亚基收稿2006.11—20修定2007—03一l2资助华中师范大学精品课程建设项目.通讯作者(E—mail:******************.ca:Tel:************).364植物生理学通讯第43卷第2期,2007年4月的羧基末端为另一个大亚基氨基末端部分覆盖,形成漏滴状的活性中心,Mg参与其中.Mg与亚基中的3个氨基酸残基所含有的氧原子发生作用,它们分别是氨甲酰化的Lys,侧链Asp3和Glulq4(Lundqvist和Schneider1991).C端结构域同时含有一个特征性的突环(Lo0p6).Loop6影响酶与气体分子(包括CO和O)的亲和性,一系列发生在环内的突变均能影响酶的羧化/氧化值(Q 值);在形成烯醇化中间产物的过程中,Loop6也起关键性的作用(Parry等2003).Loop6同时还影响酶活性状态的形成与维持.活性中心的模拟分析表明,Rubisco是否处于活性状态与活性中心(Lysl75,Lys201)和Loop6(Lys334)的3个Lys残基密切相关(熊晓然等2003).小亚基远离活性中心,其含有4个反向平行的p折叠和2个0c螺旋,p折叠和0c螺旋的核心含有疏水的氨基酸残基及与大小亚基相互作用有关的保守氨基酸残基.小亚基能促进CO,与Mg对酶的活化,维持和稳定酶的活化构象.Spreitzer (2003)认为,小亚基可能在进化过程中扮演聚集大亚基活性位点的角色,小亚基可能有更多特异性功能.3Rubisco的类型根据Rubisco大亚基氨基酸序列同源性及空间结构的相似性,可以将其分为4类,即I,II,III,IV型(表1).I型主宴存在于能够进行光合作用的有机体内,如高等植物,真核藻类,蓝藻,光能及化能自养细菌及其它一些原核生物,它由8个大亚基和8个小亚基组成,呈LS的结构.Tabita(1995)分析不同的I型Rubisco结构后,又将其分为"Green—like"和"Red—like"2类,并进一步将其划分为A,B,C及D4个亚类.II型Rubisco由2罐个大亚基组成,呈L的结构,其分子量为110-450kDa,主要存在于一些光能及化能合成细菌,海产甲藻如共生甲藻(SymbiodiniumSpp.),膝钩藻(Gonyaulaxpolyedra)等中(Rowan等1996;Nassoury等2001).尽管I型与II型Rubisco在活性位点上的氨基酸残基高度保守,但II型与I型的大亚基的同源性仍很低,仅为28%(Kitano等2001;Liao等2004).III型也仅由大亚基组成,呈L结构,存在于某些嗜热古生菌如菌,詹氏甲烷球菌等中(Klenk等1997;Watson和Tabita1999;Kitano等2001).有人研究Tk-Rubisco的结果表明,它是由大亚基组表1不同来源的Rubisco及其羧化/氧化值,结构和功能代表植物;一表示暂无相关数据.好热性硫磺细菌含有2类Rubisco:rbcL—l和rbcL.2(Karlin和Mrazek2000):超耐热原始菌先前报道称为PyrococcuskodakaraensisKODI(Kitano等2001).植物生理学通讯第43卷第2期,2007年4月365成的(L)的十聚体,与菠菜中的I型Rubisco有36%的同源性,与深红红螺菌中的Ⅱ型Rubisco有30%的同源性(Kitano等2001);分析詹氏甲烷球菌Rubisco的序列表明,它与蓝藻中的聚球藻I型Rubisco有41%的同源性,与深红红螺菌中的II型Rubisco有33%的同源性(Watson和Tabita1999).尽管以上三类Rubisco相互之间的同源性较低,但已知的Rubisco参与羧化或氧化核酮糖一1,5一二磷酸(ribulose一1,5一bisphosphate,RuBP)过程的所有保守氨基酸残基在I,II和III型中都存在,除了Ⅲ型中Phe.∞被其它氨基酸所取代(Ashida等2005).IV型又称为Rubisco类似蛋白(rubisco—like—protein,RLP),存在于非光合细菌,部分不依赖卡尔文循环的光合细菌和古生菌如绿色硫细菌,好热性硫磺细菌rbcL.,泥生绿菌,枯草芽孢杆菌等中(Klenk等1997;Watson和Tabita1999;Hanson和Tabita2001,2003Ashida等2003).它与I,II,III相比,许多活性位点保守氨基酸残基缺失,同源性甚低.如泥生绿菌,好热性硫磺细菌cL.,枯草芽孢杆菌中分别有11,5,9个活性位点的保守氨基酸残基被其它氨基酸所取代;枯草芽孢杆菌RLP与I,II,III型仅有23%,23%,30%的序列同源性(Ashida等2005).实际上,在许多细菌中同时存在编码I型和Ⅱ型Rubisco的结构基因,但在正常情况下两者并不同时表达(English等1992;Karlin和Mrazek 2000).那不勒斯硫杆菌在rbcL,突变的情况下, rbcL,,可表达生成II型Rubisco,但菌体必须在高浓度的CO,下才能生长良好(Baker等1998).海洋氢弧菌MH一110含有3个拷贝的Rubisco基因(CbbLS—和CbbLS-2属于I型,CbbM属于II型).Y oshizawa等(2004)研究证实海洋氢弧菌MH一110在不同浓度的CO,条件下,三者以不同的组合形式进行表达.脱氮硫杆菌在厌氧条件下以硝酸盐作为电子受体能同时表达生成I,II2种类型Rubisco.最近,Carr~一Mlouka等(2006)报道,在世界范围内广泛引起水华的铜绿微囊藻PCC7806 (MicrocystisaeruginosaPCC7806)细胞内同时存在I,IV型Rubisco.沼泽红假单胞菌(Rhodopseudo. monaspalustris)除了含有I,II型Rubisco,还同时存在2类不同的RLP(Larimer等2004).这些发现导致不同类型Rubisco的共存问题变得更加复杂,这对研究Rubisco的进化可能有意义.4Rubisco的性质与一般的酶相比,Rubisco具有2个显着的特征.一是非专一性,即Rubisco既能催化羧化反应,也能催化加氧反应,具有双功能性;二是低效性,即Rubisco的催化效率较一般酶低,是由于Rubisco酶转换数低(真核生物的Rubiscok约为3~5S~,来源于不同生长温度的植物Rubiscok略有不同),催化效率有限(Watson和Tabita1999;Sage2002~Ashida等2005).4.1热稳定性Rubisco有一定的热稳定性,但不同来源的Rubisco的热稳定性存在较大差异.水稻Rubisco在50℃保温7min达到最大活力,随后迅速下降,30min后酶活性下降至40%;烟草Rubisco在50℃保温20min达最大活力,30min后活力还维持在98%左右;菠菜Rubisco氨甲酰化后经60℃的10mmo1.LDTr处理1h活力还维持50%(陈为钧等1999).在嗜热古生菌如菌中,Rubisco的热稳定性极高.Tk.Rubisco在30—110℃范围内均能有效完成十聚体结构的组装(Maeda等2002);在40~100℃范围内能够保持有效的羧化酶活性,且活性随温度(40-90℃)的升高而上升;在80℃保温15h活力仍维持50%(Ezaki等1999).Maeda等(2002)采用定点突变(E63S,R66S,D69S)的方法,进一步研究证实Tk—RubiSCO耐热性依赖于特殊的五角形晶体结构(pentagonalstructure),此种结构的特点是二聚体相互接触紧密,接触面上的氨基酸残基之间存在离子间的相互作用,并形成8对离子键.同时,低聚状态对耐热性的维持也有影响.Tk.Rubisco的十聚体结构提高了蛋白质的变性温度,从而进一步提高了Tk菌适应高温的能力.4.2酶促反应动力学参数一般而言,C植物及景天科酸代谢植物Rubisco的Kin(CO)在12~26 ~tmol?L~,C4植物Rubisco的Kin(CO2)为28~63 ∞1.L-(Chen等2002).但不同类型植物Rubisco Kin(CO2)仍存在差异,如水稻RubiscoKin(CO2)一般为12lxmo1.L~,而喜温红藻(Galdieriapartita)的K(co2)仅为6.6~tmol?L一,这种喜温红藻366植物生理学通讯第43卷第2期,2007年4月RubiscoK~(CO)值在当时被认为是所有Rubisco中最小的(Uemura等1997).Ezaki等(1999)研究菌的结果表明,Tk—RubiSCO具有更强的羧化能力,在CO,饱和,90℃高温条件下,Tk.Rubisco同化CO,的速率可达19.8x10.nmo1.mg(酶蛋白)? min~.Rubisco羧化与氧化反应的活力比按/V o=()/(V oKc)([CO:】/【O2】)计算.其中,,分别表示羧化和氧化反应的最大反应速率;&,K. 分别代表羧化和氧化反应的米氏常数;【CO】和【O】为气体浓度;(c.)/(.c)称特性因子(specificityfactor),即羧化/氧化值(Q值)(Uemura等1997;Parry等2003).一定种类Rubisco的Q值为一常数,但不同来源的RubiscoQ值有较大差异(表1).绿色高等植物Rubisco的Q值一般在90~95之间;蓝藻的Q值也有35~40;细菌的Q值一般在9~45之间.从喜温红藻中发现的I型RubiscoQ值高达238(25℃),是高等植物Q值的2.5倍,说明其具有极强的固定CO:的能力(Uemura等1997).更为重要的是喜温红藻本身就属于植物,这对从亚基水平上改变Rubisco动力学性质及Q值,提高植物光合效率有重大意义. Tk—Rubisco存在更高的Q值且随温度的升高而上升,在50℃时为70,70℃时上升至250,90℃时则达到最大值310(Ezaki等1999).与此相反,喜温红藻的RubiscoQ值随着温度的升高反而降低(Uemura等1997).Watson和Tabita(1999)测定詹氏甲烷球菌Q值的结果表明,其羧化能力极差,Q值只有0.5,是所有Rubisco中Q值最低的.5Rubisco的功能已经证实,O是羧化酶反应的竞争性抑制剂;同样CO是加氧酶反应的竞争性抑制剂.因此,Rubisco处于光合碳还原(光合作用)和光合碳氧化(光呼吸)2个方向相反但又相互连锁的循环反应的交叉点上.当co#o:的浓度比值较高时,促进Rubisco催化的羧化反应.羧化反应一般分为烯醇化,羧化,水合,C—C键断裂,质子化5个阶段(Lundqvist和Schneider1991;Li等2005). Rubisco催化游离的CO,共价结合到底物RuBP上,进而生成两分子的3一磷酸甘油酸(3一phosphoglyc—ericacid,PGA),推动C3-PCR循环.当CO2/O2的浓度比值较低时,促进Rubisco催化的加氧反应,RuBP即裂解产生一分子的磷酸乙醇酸和一分子的PGA,前者进一步分解成乙醇酸和磷酸,参与绿色植物的光呼吸循环.研究初期,人们认为Rubisco的功能主要集中在光合碳同化及光呼吸过程中.然而随着各种不同类型RubiSCO的陆续发现和研究的深入, Rubisco的功能呈现出多样化(表1).詹氏甲烷球菌及其它产甲烷古生菌中的III型RubiSCO参与PRPP—RuBP—PGA途径(Ashida等称之为RuPP通路) (Finn和Tabita2004;Ashida等2005).在这一途径中RuBP的合成前体是1一焦磷酸.5一磷酸.核糖(5一phospho—D—ribose一1一pyrophosphate,PRPP),脱磷酸后经NAD氧化生成RuBP,接着在Rubisco的催化下与CO,结合生成PGA.RLP一般无羧化酶活性,但它能催化2,3一二酮基一5一甲硫戊基.1一磷酸(2,3一diketo一5一methythio—pentyl一1一phosphate,DK—MTP.1一P)的烯醇化反应,与硫代谢密切相关(Ashida等2003;Li等2005;Carr6一Mlouka等2006).枯草芽孢杆菌RLP在腺苷蛋氨酸补救合成途径中作为DK—MTP一1一P烯醇化酶发挥作用(Ashida等2003,2005).在其r/p突变株中导入深红红螺菌的II型Rubisco后,该菌株竟然可恢复生长,说明光合类型的Rubisco可能仍然保持着作为一腺苷蛋氨酸补救合成途径中DK—MTP.1一P烯醇化酶的功能.也有人认为是由于RubiSCO对底物存在一定范围的适应(Li等2005).绿色硫细菌RLP与硫代谢和氧化应激(oxidativestress)有关(Hanson和Tabita2001).铜绿微囊藻PCC7806RLP在硫代谢过程中也起一定作用.半定量RT—PCR的结果显示,在硫缺乏的情况下,吐Ⅳ的转录是正常状况(硫充足)下的22倍(Carte—Mlouka等2006).Rubisco作为植物叶中的主要含氮有机物之一,必然与植物对氮的吸收,利用及循环有关.研究不同种类C植物氮利用的情况表明,较高的Rubisco,是NADP苹果酸酶类型比NAD苹果酸酶类型具有更高的氮利用率的主要原因(Ghannoum等2005).Rubisco与植物雄性不育也有一定的联系.刘祚昌等(1983)研究玉米,高粱,水稻,小植物生理学通讯第43卷第2期,2007年4月367 麦和烟草等作物的细胞质雄性不育系Rubisco的结果表明,其活性均高于相应的保持系.水稻光周期敏感核不育农垦58S经长光照及红光间断暗周期处理表现为雄性不育,其Rubisco的活性明显低于可育状态(夏凯等1989).Schwender等(2004)最新发现甘蓝型油菜(Brassicanapus)中Rubisco参与植物中碳转化为油的代谢通道,此通道可导致碳作为油贮存的效率达到最大.6结语有人曾将红藻中高效率Rubisco酶的小亚基基因转入植物叶绿体中并得到表达,但表达出的小亚基却不能与植物本身的大亚基组装成全酶(Whitney和Andrews2001).这可能是由于小亚基存在特异性的修饰,或者协助组装的分子伴侣无法识别异源亚基.要解决上述问题尚待深入研究Rubisco的组装机制.众多的研究表明,低等藻类和古生菌体内存在不同类型Rubisco.Lonsdale等(1983)从玉米(Zeamays)线粒体中分离到一个与Rubisco大亚基同源的基因,此基因在大肠杆菌中表达合成的分子量为2lkDa的蛋白能与小麦的Rubisco抗体反应.如何科学地解释Rubisco的共存现象,共存现象与Rubisco的分子进化是否存在某种内在联系,植物体内是否也存在多拷贝的Rubisco基因,均待进一步研究.微生物Rubisco的研究大大扩展了人们对Rubisco类型及功能的认识.序列同源性比较分析的结果显示,III型和Ⅳ型Rubisco比I型及II型更原始;枯草芽孢杆菌及铜绿微囊藻PCC7806RLP功能及突变株的研究结果表明,m型与Ⅳ型Rubisco中可能存在Rubisco的原始形式,或者说它们与Rubisco的原始形式在结构及功能上有更多的相似性.根据研究枯草芽孢杆菌RLP的结果,Ashida等(2003,2005)提出一条Rubisco可能的进化路线,认为光合类型Rubisco正是由枯草芽孢杆菌RLP演变而来的.以上研究和发现并未完全解决Rubisco的分子进化问题,但却为人们指明了方向,即通过研究和分析微生物Rubisco的结构和功能有可能部分或完全揭示Rubisco的分子进化历程.参考文献陈为钧,赵贵文,顾月华(1999).RubisCO的研究进展.生物化学与生物物理进展,26(5):433-.-436刘祚昌,李继耕,罗会馨,陈福太(1983).二磷酸核酮糖羧化酶与细胞质雄性不育性的研究.遗传,10(1):362吕红,周集体,王竞,安利佳(2003).原核生物Rubisco的研究进展.微生物学通报,30(2):82—85夏凯,肖翊华,刘文芳(1989).湖北光敏感核不育水稻光敏感期叶片中ATP含量与RuBPcase活力的分析.杂交水稻,(4): 412.30熊晓然,陈蔚梅,冯胜彦,郭明雄,艾建宇,吴斌(2003).植物Rubisco 活性中心的模拟分析.中国生物化学与分子生物,19(4):493--498AshidaH,DanchinA,Y okotaA(2005).Wasphotosynthetic RuBisCOrecruitedbyacquisitiveevolutionfromRuBisCO—likeproteinsinvolvedinsulfurmetabolism?ResMicrobiol,l56:6lll8AshidaH,SaitoY,KojimaC,KobayashiK,OgasawaraN,Y okotaA(2003).AfunctionallinkbetweenRuBisCO—likeproton ofBacillusandphot0syntheticRuBisCo.Science,302:286~290BakerSH,JinS,AldrichHC,HowardGT,ShivelyJM(1998). InsertionmutationoftheformIcbbLgeneencodingribulose bisphosphatecarboxylase,oxygenase(RuBisCO)in ThiobacillusneapolitanusresultsinexpressionofformII RuBisCO,lossofcarboxysomes,andanincreasedCO2re—quirementforgrowth.JBacteriol,l80(16):4133—4l39Carr6一MloukaA,M6jeanA,QuillardetP,AshidaH,SaitoY, Y okotaA,CallebautI,SekowskaA,DittmannE,BouchierC etal(2006).AnewRubisco—likeproteincoexistswithaphot0syntheticRubiscointheplanktoniccyanobacteria Microcystis.JBiolChem,281:24462~24471ChenZH.WalkerRP,AchesonRM,LeegoodRC(2002). Phosphoenolpyruvatecarboxykinaseassayedatphysiologi—calconcentrationsofmetalionshasahighaffinityforCO2. PlantPhysio1.128:l60~164EnglishRS,WilliamsCA,LorbachSC.ShivelyJM(1992).Two formsofribulose—l.5-bisphosphatecarb0xylase,oxygenase fromthiobacillusdenitrificans.FEMSMicrobiolLett,94: lll—ll9EzakiS,MaedaN,KishimotoT,AtomiH.ImanakaT(1999). Presenceofastructurallynoveltyperibulose—bisphosphate carboxylase,0xygenaseinthehyperthermophilicarchaeon, Pyrococcus七Dd口七口r口P,lfK0D1.JBiolChem.274: 5078~5082FinnMW,TabitaFR(2004).ModifiedpathwaytOsynthesize ribulosel,5-bisphosphateinmethanogenicarchaea.J Bacteriol,186"6360,45366Ghannoum0,EvansJR,ChowWS,AndrewsTJ,ConroyJP.yon CaemmererS(2005).FasterRubiscoisthekeytosuperior nitrogen?-useefficiencyinNADP?-malicenzymerelativetO NAD—malicenzymeC4grasses.PlantPhysiol,l37:638,650 HansonTE,TabitaFR(2001).Adbulose—l,5-bisphosphatecar—368植物生理学通讯第43卷第2期,2007年4月boxylase,oxygenase(RubisCO)-likeproteinfromchlorobium tepidumthatisinvolvedwithsulfurmetabolismandthe responsetooxidativestress.ProcNatlAcadSciUSA,98:4397-4402HansonTE,TabitaFR(2003).Insightsintothestressresponseand sulfurmetabolismrevealedbyproteomeanalysisofa chlorobiumtepidummutantlackingtheRubisco-likeprotein. PhotosynthRes,78:23l-248KarlinS,MrazekJ(2000).Predictedhighlyexpressedgenesof diverseprokaryoticgenomes.JBacteriol,l82:5238-5250 KitanoK,MaedaN,FukuiT,AtomiH,ImanakaT,MildK(2001). Crystalstructureofanovel??typearchaealRubiscowithpen-- tagonalsymmetry.Structure.9:473,48lKlenkHP,ClaytonRA,TombJF,WhiteO,NelsonKE,Ketchum KA,DodsonRJ,GwinnM,HickeyEK,PetersonJDetal (1997).Thecompletegenomesequenceofthehyperthermop- hilic,sulphfate-reducingarchaeonArchaeoglobuslgidus. Nature.390:364—370LarimerFW,ChainP,HauserL,LamerdinJ,MalfhttiS,DoL,Land ML,PelletierDA,BeattyJT,LangASetal(2004).Corn—pletegenomesequenceofthemetabolicallyversatilephoto—syntheticbacteriumRhodopseudomonaspalustris.Nat Biotechno1.22:55lLiH,SawayaMR,TabitaFR,EisenbergD(2005).Crystalstructure ofaRuBisCO—likeproteinfromthegreensulfurbacterium Chlorobiumtepidum.Structure.13:779-789LiaoH,ZhouJY,DuLF,ZhangNH,WuL(2004).Ribulosel,5一bisphosphatecarboxylase,oxygenaseinArchaea.Natural ProductResDevelop,16:569-574LonsdaleDM,HodgeTP,HoweCJ,StemDB(1983).Maize mitochondrialDNAcontainsasequencehomologoustothe ribulose—l,5-bisphosphatecarboxylaselargesubunitgeneof chloroplastDNA.Cel1.34:l007-10l4LundqvistT,SchneiderG(1991).Crystalstructureofactivated ribulose—l,5-bisphosphatecarboxylasecomplexedwithits substrate,ribulose—l,5-bisphosphate.JBiolChem.266:l2604-l26llMaedaN,KanaiT,AtomiH,ImanakaT(2002).Theunique pentagonalstructureofanarchaealRubiscoisessentialfor itshighthermostability.JBiolChem.277:3l656-3l662 NassouryN,FritzL,MorseD(2001).Circadianchangesin ribulose-l,5-bisphosphatecarboxylase,oxygenasedistribu—tioninsideindividualchloroplastscanaccountfortherhythm indinoflagellatecarbonfixation.PlantCell,13:923-934ParryMAJ,AndralojcPJ,MitchellRAC,MadgwickPJ,KeysAJ (2003).ManipulationofRubisco:theamount,activity,func—tionandregulation.JExpBut,54:1321-1333RowanR,WhitneySM,FowlerA,Y ellowleesD(1996).Rubisco inmarinesymbioticdinonagellates:formIIenzymesineu- karyoticoxygenicphototrophsencodedbyanuclear multigenefamily.PlantCell,8:539-553SageRF(2002).V ariationinthetofRubiscoinC3andC4plantsandsomeimplicationsforphotosyntheticperformanceat highandlowtemperature.JExpBut,53:609-620 SchwenderJ,GoffmanF,OhlroggeJB,Shachar-HillY(2004). RubiscowithouttheCalvincycleimprovesthecarboneffi- ciencyofdevelopinggreenseeds.Nature,432:779-782 SpreitzerRJ(2003).Roleofthesmallsubunitofribulose—l,5- bisphosphatecarboxylaseloxygenase.ArchBiochemBiophys, 4l4:l4l~l49TabitaFR(1995).Thebiochemistryandmetabolicregulationof carbonmetabolismandCO2fixationinpurplebacteria.In: BlankenshipRE,MadiganMT,BauerCE(eds).Anoxygenic PhotosyntheticBacteria.Amsterdam:KluwerAcademic Publishers,885--914UemuraK,Anwaruzzaman,MiyachiS,Y okotaA(1997).Ribu—lose一1,5-bisphosphatecarboxylase/oxygenasefromthermo- philicredalgaewithastrongspecificityforCO2fixation. BiochemBiophysResCommun,232:568-571 WatsonGMF,YuJP,TabitaFR(1999).Unusualribulose1.5一bisphosphatecarboxylase,oxygenaseofanoxicArchaea.J Bacterio1.18l:l569-l575WhitneySM,AndrewsTJ(2001).Thegenefortheribulose一1,5. bisphosphatecarboxylaseloxygenase(Rubisco)smallsubunit relocatedtotheplastidgenomeoftobaccodirectsthesyn—thesisofsmallsubunitsthatassembleintoRubisco.PlantCell,13:193-205Y oshizawaY,ToyodaK,AraiH,IshiiM,IgarashiY(2004).CO2一responsiveexpressionandgeneorganizationofthreeribu-lose-1,5-bisphosphatecarboxylase,oxygenaseenzymesand carboxysomesinhydrogenovibriomarinusstrainMH—ll0.JBacterio1.186:5685—,569l。
---------------------------------------------------------------最新资料推荐------------------------------------------------------ 生物化学第八章糖代谢习题含答案第八章糖代谢习题一、是非题 1.判断下列关于戊糖磷酸途径的论述对或错:① 在这一代谢途径中可生成 5-磷酸核糖。
② 转醛酶的辅酶是 TPP,催化 -酮糖上的二碳单位转移到另一个醛糖上去。
③ 葡萄糖通过这一代谢途径可直接生成 ATP。
④ 这一代谢途径的中间物 4-磷酸赤藓糖,是合成芳香族氨基酸的起始物之一。
2.判断下列关于柠檬酸循环的论述对或错:① 此循环的第一个反应是乙酰 CoA 和草酰乙酸缩合生成柠檬酸② 此循环在细胞质中进行。
③ 琥珀酸脱氢酶的辅酶是 NAD+。
④ 该循环中有 GTP 生成。
3.判断下列关于光合作用的叙述对或错:① 光反应为暗反应提供 NADPH 和 ATP。
② 暗反应只能在无光的条件下进行。
③ 循环式光合磷酸化需要两个光反应系统参加。
④ 在三碳(Calvin)循环过程中, CO2 最初受体是 5-磷酸核酮糖。
4.判断下列关于己糖激酶和葡萄糖激酶的叙述对或错:1 / 16① 己糖激酶对葡萄糖的亲和力比葡萄糖激酶高 100 倍。
② 己糖激酶对底物的专一性比葡萄糖激酶差。
③ 6-磷酸葡萄糖对己糖激酶和葡萄糖激酶都有抑制作用。
④ 在肝和脑组织中既有己糖激酶也有葡萄糖激酶。
5.判断下列关于糖异生的叙述对或错:① 糖异生是酵解的逆转。
② 糖异生只在动物组织中发生。
③ 丙酮酸羧化酶激酶是糖异生的关键酶之一。
④ 凡能转变为丙酮酸的物质都是糖异生的前体。
6.判断下列关于乙醛酸循环的叙述对或错:① 异柠檬酸裂解酶和苹果酸合成酶是乙醛酸循环中的两个关键酶。
② 许多植物和微生物能在乙酸环境中生活是因为它们细胞中有乙醛酸循环。
解惑练2光呼吸和光抑制1.光呼吸光呼吸是进行光合作用的细胞在光照和高氧低二氧化碳情况下发生的一个生化过程。
该过程以光合作用的中间产物为底物,吸收氧、释放二氧化碳。
其生化途径和在细胞中的发生部位也与一般呼吸(也称暗呼吸)不同。
(1)光呼吸的起因Ⅰ.植物体为什么会发生光呼吸呢?主要原因是在生物体的进化过程中产生了一种具有双功能的酶,这个酶的名字叫作RuBP羧化/加氧酶,就是核酮糖-1,5-二磷酸羧化/加氧酶,这个酶可以缩写为Rubisco。
核酮糖-1,5-二磷酸(RuBP)就是卡尔文循环中的C5。
Ⅱ.二氧化碳和氧气竞争性与Rubisco结合,当二氧化碳浓度高时,Rubisco催化RuBP与二氧化碳形成两分子3-磷酸甘油酸(PGA),就是卡尔文循环中的C3,进行卡尔文循环;当氧气浓度高时,Rubisco催化RuBP与氧气形成1分子PGA(C3)和1分子磷酸乙醇酸(C2),其中PGA 进入卡尔文循环,而磷酸乙醇酸脱去磷酸基团形成乙醇酸,乙醇酸就离开叶绿体,走上了光呼吸的征途,这条路艰难而曲折,有害也有利。
基本过程见下图。
(2)光呼吸的过程Ⅰ.发生光呼吸的细胞需要三个细胞器的协同作用才能将光呼吸起始阶段产生的“次品”修复,耗时耗能。
这也是早期光呼吸被人们称作“卡尔文循环中的漏逸”,“Rubisco的构造缺陷”的原因。
Ⅱ.下图展示了卡尔文循环和光呼吸的详细过程。
(3)光呼吸的危害如果在较强光下,光呼吸加强,使得C5氧化分解加强,一部分碳以CO2的形式散失,从而减少了光合产物的形成和积累。
其次,光呼吸过程中消耗了ATP和NADPH,即造成了能量的损耗。
(4)光呼吸的意义其实光呼吸和卡尔文循环是一种动态平衡,适当的光呼吸对植物体有一定积极意义,这也许是进化过程中形成光呼吸的原因。
光呼吸的主要生理意义如下:Ⅰ.回收碳元素。
就是2分子的C2形成1分子的C3和CO2,那1分子C3通过光呼吸过程又返回到卡尔文循环中,不至于全部流失掉。
核酮糖1,5-二磷酸羧化酶(RuBPCase)提取液 简介:
植物光合作用的中,C3途径是所有植物共有的光合碳同化途径,核酮糖1,5-二磷酸羧化酶(Ribulose-1,5-bisphosphate carboxylase ,RuBPCase 或RuBPCo)是一种酶(EC
4.1.1.39),又称1,5-二磷酸核酮糖羧化酶,分子量约为53kD ,由8个大亚基和8个小亚基组成,是光合作用中决定碳同化速率的关键酶,该酶活力的大小反应了植物光合能力的强弱,RUBP 羧化酶是光合作用碳代谢中的重要的调节酶,主要存在于叶绿体的可溶部分,总量占叶绿体可溶蛋白50-60%。
在植物叶片发育过程中,此酶活性呈规律性的变化,在植物衰老或遭受环境胁迫时,酶活性呈下降趋势。
Leagene 核酮糖1,5-二磷酸羧化酶(RuBPCase)提取液主要用于裂解植物组织,提取样品中的核酮糖1,5-二磷酸羧化酶。
该试剂仅用于科研领域,不宜用于临床诊断或其他用途。
组成:
自备材料:
1、 蒸馏水
2、 离心管或试管
3、 匀浆器或研钵
4、 低温离心机
操作步骤(仅供参考):
1、取植物组织清洗干净,切碎。
2、加入预冷的核酮糖1,5-二磷酸羧化酶提取液,冰浴情况下充分匀浆或研磨。
3、经纱布或滤纸过滤,留取滤液待用。
3、离心,留取上清液。
4、冻存,用于核酮糖1,5-二磷酸羧化酶的检测或其他用途。
计算:
组织或植物粗酶液获得率(ml)=上清液体积(ml)/组织或植物质量×100% 编号 名称 CS0421 Storage 核酮糖1,5-二磷酸羧化酶提取液 500ml 4℃ 使用说明书 1份
注意事项:
1、待测样品中不能含有磷酸酶抑制剂,同时需避免反复冻融。
2、所测样本的值高于标准曲线的上限,应用核酮糖1,5-二磷酸羧化酶提取液稀释样品后
重新测定。
3、为了您的安全和健康,请穿实验服并戴一次性手套操作。
有效期:6个月有效。
相关:
编号名称
CC0007 磷酸缓冲盐溶液(10×PBS,无钙镁)
CS0001 ACK红细胞裂解液(ACK Lysis Buffer)
DC0032 Masson三色染色液
DF0135 多聚甲醛溶液(4% PFA)
NR0001 DEPC处理水(0.1%)
PS0013 RIPA裂解液(强)
TC1167 尿素(Urea)检测试剂盒(脲酶波氏比色法)。