高中化学选修4 常见的弱电解质
- 格式:pptx
- 大小:442.88 KB
- 文档页数:26

《弱电解质的电离》说课稿一、教学分析1、说教材《弱电解质的电离》是人教版高中化学选修4《化学反应原理》中的第三章第一节的内容,从教材的体系看,它在中学化学反应原理的学习中起到了承前启后的作用。
承前是指本节内容既是初中所学有关酸、碱、盐的概念及电离知识的深化,同时又是本书第二章化学平衡理论知识的应用、延伸和拓展。
启后是指弱电解质的电离是研究物质在水溶液中行为的重要环节,是学生后面学习水的电离和盐类水解、电解等知识的基础和铺垫,体现了化学理论的重要指导作用。
2. 说学情(1)知识基础:在初中和必修1教材中,学生已学过有关酸、碱、盐及电离知识,同时通过对本教材第二章化学平衡理论知识的学习,学生也普遍具备用平衡思想思考问题的能力。
(2)实验能力:学生初步具备简单化学实验方案的操作能力,能够独立完成简单的实验探究;具备一定的观察、分析、质疑和表达能力(3)认知能力:已经习惯了新教材的学习思路和学习方法,已具备一定的化学思维基础和基础实验技能。
3、教学目标知识与技能:①掌握强弱电解质的概念和弱电解质的电离平衡。
②培养学生的观察能力,分析比较能力,推理归纳能力,实验动手能力。
过程与方法:①运用实验探究法学习弱电解质概念及电离平衡知识,了解概念规律形成的一般方法。
②运用自主式学习法由已有知识迁移到新知识,体会螺旋上升的学习方法。
情感态度与价值观:①通过实验探究活动及结果分析获得正确认识,体验科学认知过程。
②通过对物质进行多角度分类方法的辨析,体会“横看成岭侧成峰”的美感。
3、教学重点、难点教学重点:弱电解质的概念和弱电解质的电离平衡,教学难点:强弱电解质的判断方法二、教法,学法分析考虑到我们学校学生基础较差,知识能力参差不齐的特点,所以在教学中我注意从以下几方面去启发学生积极主动地参与学习。
1、温故知新法:板书多种具体物质,让学生按电解质,非电解质进行分类,吸引学生注意力,为引入新课做知识准备和心理铺垫。
2、实验促学法:充分发挥学生主体作用,让学生做演示实验并与其他学生互动观察现象,从而调动学生的积极性,促使学生主动学习。


弱电解质电离方程式书写
弱电解质是在水溶液中部分电离的化合物,它们形成氢离子(或羟基离子)和共轭碱(或共轭酸)离子。
弱电解质的电离方程式可以表示如下:
1. 弱酸的电离方程式:
HA + H2O ⇌ H3O+ + A-
其中,HA 代表弱酸,A- 代表共轭碱离子。
常见的弱酸如乙酸(CH3COOH)、碳酸氢根离子(HCO3-)等。
2. 弱碱的电离方程式:
B + H2O ⇌ BH+ + OH-
其中,B 代表弱碱,BH+ 代表共轭酸离子。
常见的弱碱如氨(NH3)、氢氧化铵(NH4OH)等。
3. 多质子弱酸的电离方程式:
多质子弱酸在水溶液中可分步电离,每步电离都有相应的电离方程式。
以磷酸(H3PO4)为例:
第一步:H3PO4 + H2O ⇌ H3O+ + H2PO4-
第二步:H2PO4- + H2O ⇌ H3O+ + HPO4^(2-)
第三步:HPO4^(2-) + H2O ⇌ H3O+ + PO4^(3-)
通过书写弱电解质的电离方程式,可以更好地理解它们在水溶液中的行为,并预测电离平衡的方向。
电离方程式也是计算溶液中各种离子
浓度的基础。



人教版高中化学选修4第三章第一节弱电解质的电离(解析版)第三章第一节弱电解质的电离课后巩固一、单选题(本大题共12小题,共48分)1.下列属于强电解质的是()A. 硫酸钡B. 食盐水C. 二氧化硅D. 醋酸【答案】A【解析】【分析】本题考查强电解质的判断,为高考常见题型,把握物质类别、电离程度为解答的关键,侧重分析与应用能力的考查,题目难度不大。
【解答】A.硫酸钡熔融状态下能完全电离,且溶于水的部分也能完全电离,为强电解质,故A 选;B.食盐水为混合物,既不是电解质也不是非电解质,故B不选;C.二氧化硅不能电离是非电解质,故C不选;D.醋酸在水溶液中部分电离属于弱电解质,故D不选;故选A。
2.下列关于电解质、非电解质的说法正确的是()A. 氯气溶于水得氯水,该溶液能导电,因此氯气是电解质B. CaCO3饱和溶液导电能力很弱,故C aCO3是弱电解质C. HF的水溶液中既有H+、F−,又有大量的HF分子,因此HF是弱电解质D. 导电能力弱的溶液肯定是弱电解质的溶液【答案】C【解析】A.氯气是单质,不是化合物,所以既不是电解质也不是非电解质,故A错误;B.碳酸钙在熔融状态下能够完全电离,属于强电解质,故B错误;C.HF的水溶液中既有H+、F−,又有大量的HF分子,说明HF只能部分电离,因此HF 是弱电解质,故C正确;D.导电能力与溶液中离子浓度大小以及离子所带电荷数有关,与电解质强弱没有必然关系,如硫酸钡形成的溶液导电性较弱,但是硫酸钡是强电解质,故D错误。
故选C。
3.下列电离方程式中,正确的是()A. Ca(OH)2=Ca2++2(OH)−B. FeCl2=Fe2++3Cl−C. H2SO4=H2++SO42−D. Al2(SO4)3=2Al3++3SO42−【答案】D【解析】A.氢氧化钙属于强电解质,完全电离:Ca(OH)2=Ca2++2OH−,故A错误;B.氯化亚铁属于强电解质,完全电离:FeCl2=Fe2++2Cl−,故B错误;C.硫酸属于强电解质,完全电离:H2SO4=2H++SO42−,故C错误;D.硫酸铝完全电离,该电离方程式书写正确,故D正确。


第2课时常见的弱电解质目标与素养:1.理解水的离子积常数,能够运用水的离子积常数进行有关计算。
(宏观辨识与微观探析)2.能够从化学平衡的角度,理解外界条件对弱电解质电离平衡的影响。
(变化观念与平衡思想)一、水的电离1.水的电离水是一种极弱的电解质,电离方程式为:2H 2O H3O++OH-,简写为H2O H++OH-,水的电离常数K电离=错误!.2.水的离子积常数(1)表达式K w=c(H+)·c(OH-)。
25 ℃时,水中的c(H+)=c(OH-)=1×10-7mol·L-1,K w=1×10-14。
(2)影响因素水的离子积K w,只受温度的影响,温度升高,K w增大。
(3)适用范围K不仅适用于纯水,还可适用于稀的电解质溶液.w二、弱酸(或弱碱)的强弱与电离常数的关系1.弱电解质的电离是一个吸热过程,升高温度会促进电离平衡向电离的方向移动,电离平衡常数增大.2.常见弱电解质(1)常见的弱酸:HF、CH3COOH、HClO、HCN、H2CO3、H2SO3等。
(2)常见的弱碱:NH3·H2O等。
(3)常用电离常数表示弱酸、弱碱的相对强弱,电离常数越大,弱酸、弱碱的酸性或碱性越强。
3.多元酸的分步电离对于二元弱酸来说,第一步电离程度远远大于第二步电离.例如,H2CO3的电离:第一步:H 2CO3H++HCO错误!_,K a=错误!=4。
3×10-7。
1第二步:HCO错误!错误!H++CO错误!_,K a=错误!=5.6×10-11。
21.判断正误(正确的打“√”,错误的打“×”)。
(1)水是一种弱电解质,其电离方程式为H 2O H++OH-。
( )(2)向水溶液中滴加少量稀盐酸,c(H+)增大,K w增大。
( )(3)H 2S在水溶液中的电离方程式为H2S2H++S2-. ()(4)0。
1 mol·L-1的醋酸溶液加水稀释时,醋酸的电离程度增大,c(H+)增大。


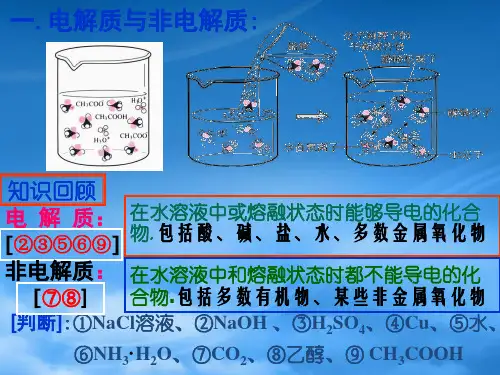
第一节弱电解质的电离1.了解强弱电解质的概念。
2.能描述弱电解质在水溶液中的电离平衡,正确书写电离方程式。
3.理解一定条件下弱电解质的电离平衡移动。
4.了解电离常数的概念、表达式和意义。
强弱电解质1.实验探究按图所示,将体积相同、浓度相同的盐酸和醋酸与等量镁条反应,并测量溶液的pH。
完成下面的表格:1 mol/L HCl 1 mol/L CH3COOH实验操作与镁反应现象产生无色气泡较快产生无色气泡较慢结论Mg与盐酸反应速率快,表明盐酸中c(H+)较大,说明在水中盐酸的电离程度大于醋酸的电离程度测量溶液的pH数值不相同(填“相同”或“不相同”,下同)结论相同物质的量浓度的盐酸和醋酸中c(H+)不相同实验结论不同的电解质在水中的电离程度不相同2.概念和物质类别3.电离方程式的书写(1)强电解质:电离过程是不可逆的,其电离方程式用“===”表示。
如Na2SO4:Na2SO4===SO2-4+2Na+。
(2)弱电解质:电离过程是可逆的,其电离方程式用“”表示。
①一元弱酸、弱碱一步电离。
如CH3COOH:CH3COOH CH3COO-+H+;NH3·H2O:NH3·H2O NH+4+OH -。
②多元弱酸分步电离,必须分步写出,不可合并(其中以第一步电离为主)。
如H2CO3:H2CO3H++HCO-3_(主),HCO-3H++CO2-3_(次)。
③多元弱碱分步电离(较复杂),在中学阶段要求一步写出。
如Fe(OH)3:Fe(OH)3Fe3++3OH-。
(3)酸式盐①强酸的酸式盐如NaHSO4:NaHSO4===Na++H++SO2-4_。
②弱酸的酸式盐如NaHCO3:NaHCO3===Na++HCO-3_,HCO-3H++CO2-3_。
1.正误判断:正确的打“√”,错误的打“×”,并阐释错因或列举反例。
语句描述正误阐释错因或列举反例(1)金属铜、稀硫酸都能导电,所以它们都是电解质(2)强电解质都是可溶性化合物,弱电解质都是难溶性化合物(3)强电解质的水溶液中无溶质分子,弱电解质的水溶液中有溶质分子(4)H2CO3的电离方程式为H2CO32H++CO2-3(5)强电解质溶液的导电能力一定比弱电解质溶液的导电能力强(2)×BaSO4难溶于水,是强电解质;CH3COOH易溶于水,是弱电解质(3)√(4)×H2CO3的电离方程式应分步书写(5)×导电能力的强弱取决于溶液中离子浓度的大小及离子所带的电荷数,与电解质强弱无必然联系2.NH3的水溶液能够导电,但它并不是电解质,为什么?答案:NH3溶于水生成NH3·H2O,NH3·H2O电离产生NH+4和OH-而使溶液导电,实际导电的是NH3·H2O,而不是NH3,故NH3·H2O是电解质,NH3不是电解质。
始驾州参艰市线练学校常见的弱电解质同步精练 41.水的电离过程为H2O H++OH-,在不同温度下其离子积为K w(25 ℃)=1.0×10-14,K w(35 ℃)=2.1×10-14。
则下列叙述正确的是( )A.c(H+)随着温度的升高而降低B.在35 ℃时,c(H+)>c(OH-)C.溶液:pH(35 ℃)>pH(25 ℃)D.水的电离是吸热的过程解析:升高温度,可使水的电离平衡右移,c(H+)·c(OH-)增大,K w增大,故水的电离是吸热过程。
答案:D2.下列各物质的分类组合完全正确的一组是( )强电解质弱电解质非电解质A H3PO4Al(OH)3C2H5OHB Ba(OH)2HClO Cl2C NaHCO3H2O CH4D H2SO4BaSO4NH33442答案:C3.向纯水中加入少量NaHSO4,在温度不变时,溶液中( )A.pH升高B.酸性增强C.水中c(H+)与c(OH-)的乘积增大D.c(OH-)减小解析:NaHSO4在纯水中完全电离:NaHSO4===Na++H++SO2-4,c(H+)增大,抑制水的电离,c(OH-)减小,酸性增强,pH减小,由于温度未变,c(H+)·c(OH-)不变,答案为B、D。
答案:BD4.能影的电离平衡,并使溶液中的c(H+)>c(OH-)的操作是( )A.向水中投入一小块金属钠B.将水加热煮沸C.向水中通入二氧化碳气体D.向水中加食盐晶体解析:改变温度或改变c(H+)或c(OH-)的措施均可影的电离平衡,但若是c(H+)>c(OH-)则需增大c(H+)或减小c(OH-),而A是使c(H+)下降,B中c(H+)、c(OH-)都增大,但仍相,D不影的电离平衡,C通入CO2,生成H2CO3抑制水的电离,但c(H+)增大。
答案:C5.将纯水加热至较高温度,下列叙述正确的是( )A.水的离子积变大,pH变大,呈酸性B.水的离子积不变,pH不变,呈中性C.水的离子积变小,pH变大,呈碱性D.水的离子积变大,pH变小,呈中性解析:水的电离是一个吸热过程,加热能促进水的电离,K w值将增大,c(H+)增大,pH将减小,但溶液中c(H+)=c(OH-),呈中性。
人教版高三化学选修4《弱电解质的电离》评课稿引言本文以人教版高三化学选修4中的《弱电解质的电离》一章为基础,从教材内容、教学目标、教学方法及评价等方面,对这一单元进行评课,旨在探讨教材的优势与不足,为进一步的教学改进提供参考。
一、教学内容1.1 教材内容概述《弱电解质的电离》是高三化学选修4教材中的一章,主要介绍了弱电解质的特点、离解度及其影响因素、离子平衡常数以及常见的弱酸、弱碱等内容。
1.2 内容分析该章节内容属于高中化学中的重点内容,对于学生进一步理解电解质的性质和化学平衡有重要意义。
通过学习该章节,学生可以加深对离解度和离子平衡常数等概念的理解,并能够运用所学知识解答相应的问题。
二、教学目标2.1 知识目标•理解电解质的定义和弱电解质的特点;•掌握离解度及其影响因素的内容;•熟练掌握离子平衡常数的计算方法;•了解弱酸、弱碱的性质和常见实例。
2.2 能力目标•能够分析和解决离解度和离子平衡常数相关的问题;•具备使用化学实验方法观察和验证的能力;•培养学生观察、分析和解释实验现象的能力。
2.3 情感态度目标•培养学生对化学知识的兴趣和好奇心;•培养学生合作学习、积极思考和探索的精神;•培养学生对实验现象的敏感性和严谨态度。
三、教学方法3.1 模块化教学法对于本章节内容的教学,可以采用模块化教学法,将知识内容分为多个模块,便于学生理解与掌握,并通过模块化的教学设计,激发学生的学习兴趣,提高学习效果。
3.2 实验引导法在教学中,结合相关的实验,引导学生通过观察和实验验证,加深他们对于弱电解质的电离过程的理解。
通过实验,学生可以直观地感受实验现象,提升他们的学习兴趣和实践能力。
3.3 探究式学习法在引导学生理解和掌握相关概念的同时,注重培养学生的自主学习和独立思考的能力。
通过提出问题,让学生进行讨论和思考,引导学生从实践中发现问题并解决问题,培养学生的探究精神和综合运用知识的能力。
3.4 多媒体辅助教学法在教学过程中,充分利用多媒体技术,结合图片和视频等形式,直观地展示相关实验现象和示意图,加深学生对于知识点的认识和理解,提高学习的效果和趣味性。
根据电解质在水溶液中是否全部电离,把电解质分为强电解质和弱电解质。
强电解质在水溶液中能够全部电离,而弱电解质在水溶液中只有部分电离。
和化学平衡一样,在弱电解质溶液里,也存在着电离平衡,水溶液中的离子平衡内容实际上是应用化学平衡理论,探讨水溶液中离子间的相互作用,内容比较丰富。
一定条件(温度、浓度)下,分子电离成离子的速率和离子结合成分子的速率相等,溶液中各分子和离子的浓度都保持不变的状态叫电离平衡状态,简称电离平衡。
强弱电解质理论,特别是弱电解质的电离平衡是学习电解质溶液的重要基础,也是中学化学基本理论中的重要组成部分。
电离平衡除了具备化学平衡的特点外,还具有“电离过程是吸热的;分子、离子共存,这完全不同于强电解质;弱电解质在溶液中的电离都是微弱的”的特点。
一般来说,分子已电离的极少,绝大多数以分子形式存在,如0.1 mol·L-1的CH3COOH溶液中,c(H+)大约在1×10-3mol·L-1左右;多元弱酸分步电离,电离程度逐步减弱,如H2CO3的电离常数:K1=4.4×10-7,K2=4.7×10-11。
电离平衡状态时,溶液里离子的浓度和分子的浓度保持不变,但当影响电离平衡状态的条件如温度、浓度等改变时,电离平衡就会从原来的平衡状态变化为新条件下新的电离平衡状态。
电离平衡的移动符合勒夏特列原理,离子浓度相当于生成物的平衡浓度,分子浓度相当于反应物的平衡浓度,外界条件对其影响可归纳为:(1)浓度:对于同一弱电解质,浓度越大,电离平衡越向右移动,但是电离程度减小;浓度越小,电离程度越大,即溶液加水稀释时,电离平衡向着电离的方向移动。
(2)温度:由于弱电解质的电离过程一般是吸热的,升高温度,电离平衡向着电离的方向移动。
(3)同离子效应:在弱电解质溶液中加入同弱电解质电离产生相同离子的强电解质时,电离平衡将逆向移动。
(4)化学反应:在弱电解质溶液中加入能与弱电解质电离产生的某种离子反应的物质,电离平衡将向电离的方向移动。