高中化学选修四弱电解质的电离.pdf
- 格式:pdf
- 大小:1.78 MB
- 文档页数:11

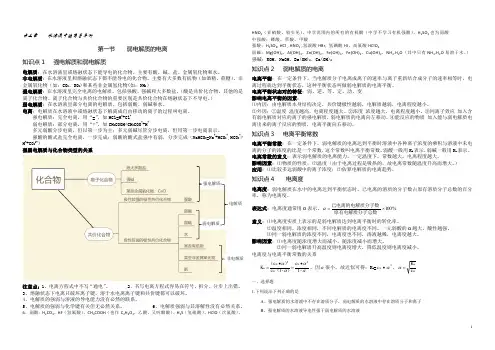
第三章水溶液中的离子平衡第一节弱电解质的电离知识点1 强电解质和弱电解质电解质:在水溶液里或熔融状态下能导电的化合物。
主要有酸、碱、盐、金属氧化物和水。
非电解质:在水溶液里和熔融状态下都不能导电的化合物。
主要有大多数有机物(如酒精、蔗糖)、非金属氧化物(如:CO2、SO2)和某些非金属氢化物(如:NH3)强电解质:在水溶液里完全电离的电解质。
包括强酸、强碱和大多数盐。
(酸是共价化合物,其他的是离子化合物。
离子化合物与共价化合物的重要区别是共价化合物在熔融状态下不导电。
)弱电解质:在水溶液里部分电离的电解质。
包括弱酸、弱碱和水。
电离:电解质在水溶液中或熔融状态下解离成自由移动的离子的过程叫电离。
强电解质:完全电离,用“=”,如HCl=H++Cl-弱电解质:部分电离,用“⇌”,如CH3COOH⇌CH3COO-+H+多元弱酸分步电离,但以第一步为主;多元弱碱尽管分步电离,但用第一步电离表示。
强酸的酸式盐完全电离,一步完成;弱酸的酸式盐强中有弱,分步完成(NaHCO3=Na++HCO3-,HCO3-⇌H++CO32-)强弱电解质与化合物类型的关系注意点:1、电离方程式中不写“通电”。
2、书写电离方程式容易在符号、拆分、分步上出错。
3、熔融状态下电离只破坏离子键,溶于水电离离子键和共价键都可以破坏。
4、电解质的强弱与溶液的导电能力没有必然的联系。
5、电解质的强弱与化学键有关但无必然关系。
6、电解质强弱与其溶解性没有必然关系。
6、弱酸:H2CO3、HF(氢氟酸)、CH3COOH(也作C2H4O2,乙酸,又叫醋酸)、H2S(氢硫酸)、HClO(次氯酸)、HNO2(亚硝酸,较少见)、中学范围内的所有的有机酸(中学不学习有机强酸)、H2SO3也为弱酸中强酸:磷酸,草酸,甲酸强酸:H2SO4, HCl , HNO3 ,氢溴酸HBr, 氢碘酸HI,高氯酸HClO4弱碱:Mg(OH)2、Al(OH)3、Zn(OH)2、Fe(OH)3、Fe(OH)2、Cu(OH)2、NH3.H2O(其中只有NH3.H2O易溶于水。

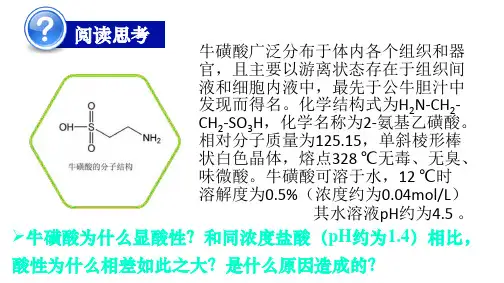


第三章第一节弱电解质的电离教案第一课时强电解质和弱电解质一、教材分析“弱电解质的电离平衡”是高一教材第7 章第一节第三课时的内容,属于化学基本概念和基础理论范畴。
从教材的体系看,起承上启下的作用,在第二课时已辨析过强弱电解质,它是前两课时学习溶液导电性实验、强弱电解质知识的延续和深化,也是第六章《揭示化学反应速率和平衡之谜》化学平衡理论知识的应用,同时又是学习电解质溶液理论知识的基础,是研究物质在水溶液中行为和认识溶液中离子反应的起始课。
从研究方法看,它是通过宏观实验现象从微观角度认识在溶液中电离情况,透过现象从微粒的角度认识电离平衡的本质。
二、化学新课程标准认识电解质的强弱和能用化学平衡理论描述电解质在水溶液中的电离平衡三、学生情况分析根据以往的教学经验,学生已经学习了强、弱电解质和弱电解质的电离,对化学平衡知识也有了系统地学习,已能初步解决化学平衡问题,高一第二学期的学生在初中、高一也积累了些许元素化合物的知识。
在高一学习过原子结构、化学键、氧化还原反应、化学平衡等理论知识,有了一定的研究理论知识的经验和能力,具备一定的联想和逻辑推理能力。
但学生对于离子的概念一直比较薄弱,设计并动手实验方面还较为欠缺,同时还对化学平衡移动的影响因素应用还不够熟练,有待在实践中继续加强。
四、教学目标1.知识与技能了解强、弱电解质的概念,复习物质分类的重要意义。
2.过程与方法能够从组成和结构上加以理解强电解质、弱电解质和非电解质的概念。
3.情感态度与价值观通过本课时的学习,巩固物质分类法的应用和分类的意义。
五、教学重点、难点强弱电解质的概念及其与结构的关系。
六、课时安排:2课时八、教学过程【投影】电解质的导电性实验录像【思考】为什么物质在水溶液里或熔化状态下能够导电?【现象分析】灯光亮→导电→有自由移动的离子→电解质发生电离→电离:化合物在溶于水或受热熔化时,离解成自由移动的离子的过程。
【复习】电解质与非电解质影响电解质溶液导电能力的因素:①离子的浓度;②离子的电荷数;③温度。




