单质、氧化物、酸碱盐的相互转化关系复习课程
- 格式:doc
- 大小:483.00 KB
- 文档页数:5
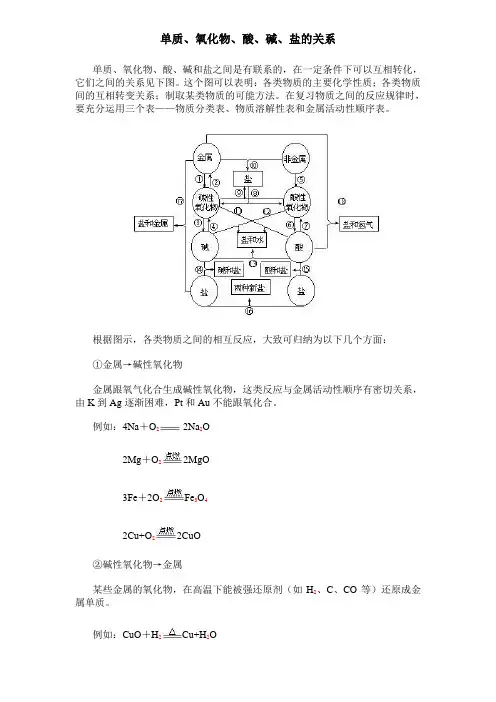
单质、氧化物、酸、碱、盐的关系单质、氧化物、酸、碱和盐之间是有联系的,在一定条件下可以互相转化,它们之间的关系见下图。
这个图可以表明:各类物质的主要化学性质;各类物质间的互相转变关系;制取某类物质的可能方法。
在复习物质之间的反应规律时,要充分运用三个表——物质分类表、物质溶解性表和金属活动性顺序表。
根据图示,各类物质之间的相互反应,大致可归纳为以下几个方面:①金属→碱性氧化物金属跟氧气化合生成碱性氧化物,这类反应与金属活动性顺序有密切关系,由K到Ag逐渐困难,Pt和Au不能跟氧化合。
例如:4Na+O22Na2O2Mg+O22MgO3Fe+2O2Fe3O42Cu+O22CuO②碱性氧化物→金属某些金属的氧化物,在高温下能被强还原剂(如H2、C、CO等)还原成金属单质。
例如:CuO+H2Cu+H2OWO3+3H2W十3H2OFe3O4+4H23Fe+4H2OPbO+H2Pb+H2O2CuO+C2Cu+CO2↑2Fe2O3+3C4Fe十3CO2↑CuO+CO Cu+CO2Fe2O3+3CO2Fe+3CO2PbO+CO Pb+CO2Ag2O+CO2Ag+CO2Fe3O4+4CO3Fe+4CO2③碱性氧化物→碱K2O、Na2O、CaO、BaO能与水反应生成碱。
例如:K2O+H2O2KOHNa2O+H2O2NaOHCaO+H2O Ca(OH)2BaO+H2O Ba(OH)2其它碱性氧化物(如CuO、Fe2O3)不能直接跟水反应,可用间接方法制得它们的碱[如Cu(OH)2,Fe(OH)3]。
④碱→碱性氧化物发生这类反应的,一般是不溶性碱。
例如:Cu(OH)2CuO+H2O2Fe(OH)3Fe2O3+3H2O2Al(OH)3Al2O3+3H2O⑤非金属→酸性氧化物非金属跟氧发生反应生成酸性氧化物,这类反应在初中只介绍了碳、硫、磷直接和氧气反应。
例如:C+O2CO2S+O2SO24P+5O22P2O5硫还有一种重要的氧化物,在这种氧化物中,硫表现出+6价,化学式为SO3。

单质、氧化物、酸、碱、盐的相互反应基本关系以下各类别物质间可发生反应:1、金属+酸2、金属+盐3、酸性氧化物+碱4、碱性氧化物+酸5、酸+碱6、酸+盐7、碱+盐8、盐+盐具体情况是:1、金属单质 + 酸→盐 + 氢气(置换反应)规律:在金属活动性顺序中排在氢之前的金属,才能置换酸中的氢;注意:常见的盐酸和稀硫酸可以与氢前面的金属反应生成氢气。
因浓硫酸、硝酸具有氧化性,与金属反应,但一般不能生成氢气;如Zn与稀硝酸反应生成Zn(NO3)2、H2O和NO如:锌+稀硫酸:Zn + H2SO4 =ZnSO4 + H2↑铁+稀硫酸:Fe + H2SO4 = FeSO4 + H2↑铝+稀硫酸:2Al + 3H2SO4 =Al2(SO4)3 + 3H2↑铁+稀盐酸:Fe + 2HCl = FeCl2 + H2↑镁+稀盐酸:Mg+ 2HCl = MgCl2 + H2↑铝+稀盐酸:2Al + 6HCl = 2AlCl3 + 3H2↑铜+稀盐酸:不反应银+稀硫酸:不反应特别提示:铁与盐酸、稀硫酸反应生成的盐中铁元素显+2价。
2、金属单质 + 盐溶液→另一种金属 + 另一种盐反应条件:①盐可溶;②在金属活动性顺序中,排在前面的金属才能置换后面的金属。
注意:钾、钙、钠很活泼,在盐溶液中不能置换出金属。
(因先与水反应)如:铁+硫酸铜溶液:Fe + CuSO4 =FeSO4 + Cu锌+硫酸铜溶液:Zn + CuSO4 = ZnSO4 + Cu铜+硝酸汞溶液:Cu + Hg(NO3)2= Cu(NO3)2 + HgMg+NaCl溶液:不反应Cu+AgCl:不反应特别提示:铁与盐溶液发生置换反应时,生成物中铁显+2价。
3、碱性氧化物 +酸→盐 + 水规律:酸为HCl、H2SO4、HNO3时,它们与任何碱性氧化物都可反应。
其它酸目前暂时不要求掌握。
如:氧化铁+稀盐酸:Fe2O3 + 6HCl =2FeCl3 + 3H2O氧化铁+稀硫酸:Fe2O3 + 3H2SO4 =Fe2(SO4)3 + 3H2O氧化铜+稀盐酸:CuO + 2HCl = CuCl2 + H2O氧化铜+稀硝酸:CuO + 2HNO3 =Cu(NO3)2 + H2O氧化镁+稀硫酸:MgO + H2SO4 =MgSO4 + H2O氧化钙+稀盐酸:CaO + 2HCl= CaCl2 + H2O4、酸性氧化物 +碱→盐 + 水规律:碱为NaOH、KOH、Ca(OH)2、Ba(OH)2时,它们与任何酸性氧化物都可反应。

复习课教案《单质、化合物》一、确定复习内容:单质:氧气、氢气、氮气、碳、铁、铜化合物:①水、双氧水、一氧化碳、二氧化碳、氧化铜、氧化铁、二氧化锰、四氧化三铁②盐酸、硫酸、碳酸③氢氧化钠、氢氧化钙、氢氧化镁、氢氧化铁、氢氧化铜④氯化钠、氯化银、硝酸银、碳酸钠、碳酸钙、硫酸铜、硫酸钡⑤甲烷二、确定复习时间:3课时三、确定复习形式:(一)课前准备:将所复习的物质写在自制的卡片上,每一张卡片写一种物质,并给该物质编号,一般按单质、氧化物、酸、碱、盐、有机物的顺序,然后由学生每人任意抽取一张,根据班内学生数和学生水平适当调整,可以多人一张,也可以一人多张。
给学生一天的准备时间,让学生尽情地去搜集自己手上物质的知识,以备课上交流。
(二)课上展示:展示的形式多种多样,一般从小号开始,可以由拿卡片的同学先说,其它同学补充的方式,也可以由拿卡片的同学先任意挑选一位同学,然后他不说物质的名称,只说物质的相关知识,被挑的同学猜他说的是什么物质,其它同学再补充等等。
(三)课后练习:我一般是把这些重要的物质的知识编成谜语印发出来,让学生填写对应的物质化学式。
四、课后反思:经过几年的使用,从课堂、学生、考试、价值观的培养等方面看,卓有成效。
①从课堂学生参与的热情度看,效果相当好,因为其它课没有这样做的。
②从学生掌握的情况看,三节课回顾了几乎整个初中化学教材的重要单质、化合物,学生脑子里面有了实实在在的东西。
③从学生的情感、态度、价值观看,学生学会了反思自己的不足,学会了敢于展示自己,敢于与人交流。
④从学困生的表现看,原来几近放弃的学生,上课睡觉的学生,不来上课的学生,动起来了,原来记不住的东西记住了,原来只蒙选择题,现在敢看非选择题了,敢挑一些非选择题做了。
⑤从考试成绩看,历次考试我所教的班在全校总评都是第一,有时甚至平均分、优秀率、及格率、低分率全是第一,这是实实在在的成绩,一点不虚。
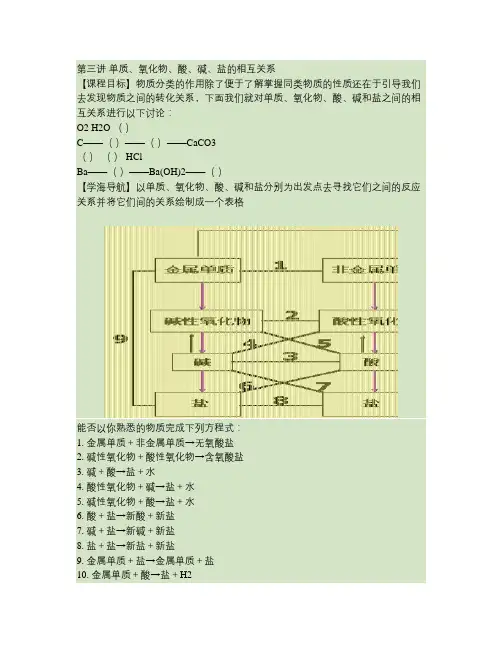
第三讲单质、氧化物、酸、碱、盐的相互关系【课程目标】物质分类的作用除了便于了解掌握同类物质的性质还在于引导我们去发现物质之间的转化关系,下面我们就对单质、氧化物、酸、碱和盐之间的相互关系进行以下讨论:O2 H2O ()C——()——()——CaCO3()() HClBa——()——Ba(OH)2——()【学海导航】以单质、氧化物、酸、碱和盐分别为出发点去寻找它们之间的反应关系并将它们间的关系绘制成一个表格能否以你熟悉的物质完成下列方程式:1. 金属单质+非金属单质→无氧酸盐2. 碱性氧化物+酸性氧化物→含氧酸盐3. 碱+酸→盐+水4. 酸性氧化物+碱→盐+水5. 碱性氧化物+酸→盐+水6. 酸+盐→新酸+新盐7. 碱+盐→新碱+新盐8. 盐+盐→新盐+新盐9. 金属单质+盐→金属单质+盐10. 金属单质+酸→盐+H2我们应该怎样运用这些关系,在用的过程中要注意些什么呢?一. 找规律:我们都很熟悉碱+酸→盐+水,通过对3、4、5的观察你会发现酸性氧化物广义上来讲就是酸,碱性氧化物在广义上就是碱,这样在今后的学习中我们就可以用这个规律去书写化学方程式。
例如: CO2+Ca(OH)2=CaCO3↓+H2OSO2+Ca(OH)2=CaSO3↓+H2O二. 反应条件限制:1. 酸+金属→盐+H2金属为活泼金属;酸一般用稀硫酸、稀盐酸;不用稀HNO3;制备氢气时,不用K、Ca、Na特别活泼的金属;2. 碱+盐→碱+盐反应时要求两者都必须可溶,生成物之一为不溶即可;3. 碱+指示剂,碱必须可溶。
三. 酸和盐反应的规律:1. 强酸制备弱酸 2HCl+CaCO3=CaCl2+CO2↑+H2O 2HCl+Na2SO3=2NaCl+SO2↑+H2O2. 高沸点、难挥发性酸制备低沸点、易挥发性酸2NaCl+H2SO4(浓)=Na2SO4+2HCl↑ NaNO3+H2SO4(浓)=NaHSO4+HNO3↑当然我们本节课的活动不是想把所有的知识局限在“八点图”上,而是以它为例说明如何寻找各类物质之间的关系,同学们也可以从不同的角度进行总结归纳。

单质、氧化物、酸碱盐之间的相互关系马鞍山市当涂县太白一中俞金德一.教材的地位与作用本课题是第十单元和第十一单元之后单元复习中的一部分,是对单质、氧化物、酸、碱、盐五类物质化学性质的归纳、整理和运用,是对置换反应和复分解反应条件的进一步认识。
通过复习,可以训练学生分析问题整理归纳的能力,培养科学的解题方法,认识到各类物质间的关系和基本规律是相对的、有条件的,从而使零散的知识条理化、系统化,有利于形成知识和能力的飞跃。
二.教学目标根据新课标和学生实际,我确定了如下三维教学目标:⑴知识与技能:①.熟悉常见单质、氧化物和酸、碱、盐的化学性质。
②. 根据单质、氧化物、酸、碱、盐的典型特征和相互关系做简单的推断题。
⑵过程与方法:通过单质、氧化物、酸碱盐的网络关系图,培养学生对知识的整理归纳能力,并从中提取有价值信息的能力;通过演练,培养学生的观察能力和解题能力;通过讨论,培养学生的的交流与合作能力。
⑶情感态度与价值观:让学生在观察、演练、归纳、合作与交流的过程中,不断应对挑战,培养科学的思维方法。
三.教学重难点新课标中明确指出:让学生在知识的形成、相互联系和应用过程中养成科学的思维方法,培养学生的创新精神和实践能力。
所以我确定:本节课的重点是:通过归纳整理和适当的推断题练习,理清单质、氧化物、酸碱盐的的相互关系。
本节课的难点是:在解答典型的推断题的过程中,如何去寻找突破口,并形成科学的思维方法。
四、教学方法一是从学习的需求性出发,展示历年相关中考题来激发学生的求知欲望。
二是采用分析归纳法,使学生作好本节课的知识储备。
三是采用小组合作学习和多媒体辅助教学法,让学生学会寻找解题的突破口,形成科学的思维方法。
突出重点。
四是遵循学生的认知规律,采用层层递进,一题多变的学习方式,减少难度,让学生逐级上台阶。
帮助学生突破难点,使课堂教学更为优化。
七、教学效果预测在教学目标的制定过程中,对本课题的特点、重、难点、学生的情况等进行了比较全面的分析,教法与学法的选择遵循了循序渐进的教学原则和学生的认知规律,同时采用一个“变”字:即一题多变,题题生变,既落实化学基础知识,又灵活体验解题方法;体现一个“探”字,以小组合作学习的方式探索解题思路,渗透科学方法;突出一个“动”字,以多种活动来引导学生动手、动口、动脑;落实一个“用”字,通过归纳整理、方法提炼,让学生养成依法解题的习惯;最终实现一个“主”字,以学生的主体地位实现学生的主体参与和主体发展。
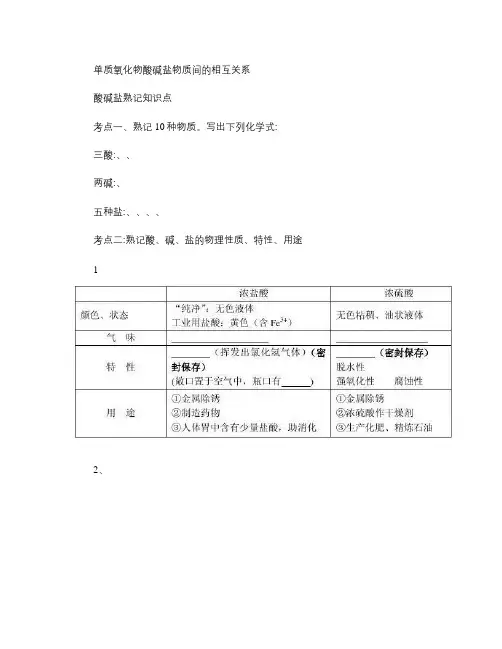
单质氧化物酸碱盐物质间的相互关系酸碱盐熟记知识点考点一、熟记10种物质。
写出下列化学式:三酸:、、两碱:、五种盐:、、、、考点二:熟记酸、碱、盐的物理性质、特性、用途12、注意:①氢氧化钠的潮解属于。
②氢氧化钠密封保存的原因:氢氧化钠易吸收空气中的水蒸汽而潮解,同时又能与空气中的二氧化碳反应而变质。
③氢氧化钠敞口放置在空气中会变质(属于,因为它会与空气中的二氧化碳反应生成碳酸钠。
④如果不慎将碱液沾到皮肤上,要用较多的水冲洗,再涂上硼酸溶液。
3、常见的盐考点三:熟记物质的俗称和主要成分:23 CaCO 3两类反应:一、碱性氧化物 +酸 -------- 盐 + 水7. 氧化铁和稀盐酸反应: (注意生成+3价Fe8. 氧化铁和稀硫酸反应: (注意生成+3价Fe 注:FeCl 3溶液、Fe 2(SO 43溶液:黄色 9. 氧化铜和稀盐酸反应:CuO + 2HCl =CuCl 2 + H 2O10. 氧化铜和稀硫酸反应:CuO + H 2SO 4 =CuSO 4 + H 2O 注:CuCl 2溶液、CuSO 4溶液:蓝色二、酸 + 碱 -------- 盐 + 水(中和反应11.盐酸和烧碱起反应:HCl + NaOH = NaCl +H 2O12. 盐酸和氢氧化钙反应:13. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH3 = AlCl3 + 3H2O14. 硫酸和烧碱反应:H2SO4 + 2NaOH =Na2SO4 + 2H2O三、酸 + 盐 -------- 另一种酸 + 另一种盐15.大理石与稀盐酸反应:(注:实验室制取CO216.碳酸钠与稀盐酸反应: (注:检验烧碱是否变质;检验是否含有碳酸根离子17.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl= NaCl + H2O + CO2↑18. 硫酸和氯化钡溶液反应:(注BaSO4沉淀:白色,不溶于稀硝酸;四、碱 + 盐 -------- 另一种碱 + 另一种盐19. 氢氧化钙与碳酸钠:(注:制取烧碱22.氢氧化钠与氯化镁:2NaOH + MgCl₂= Mg(OH₂↓ + 2NaCl五、盐 + 盐 ----- 两种新盐23.氯化钠溶液和硝酸银溶液:(注AgCl沉淀:白色,不溶于稀硝酸;24.硫酸钠和氯化钡:(注BaSO4沉淀:白色,不溶于稀硝酸;其他反应:碱 + 非金属氧化物 -------- 盐 + 水(不是复分解反应25.苛性钠暴露在空气中变质:(注:吸收出去CO226.消石灰放在空气中变质:(注:检验CO227.苛性钠吸收二氧化硫气体:2NaOH + SO2 =Na2SO3 + H2O28.苛性钠吸收三氧化硫气体:2NaOH + SO3 = Na2SO4 + H2O29. 消石灰吸收二氧化硫:Ca(OH2 + SO2 = CaSO3↓+ H2O考点五:熟记五种特殊离子的检验:酸碱盐基础知识练习一.酸、碱、盐的认识:1、写出下列酸、碱、盐的化学式:盐酸硫酸硝酸碳酸氢氧化钠氢氧化铁氢氧化铜石灰水氨水苛性钠石灰石硫酸钡硫酸铜纯碱。

单质,酸,碱,盐,氧化物之间的转化关系
稿子一:
嘿,朋友!今天咱们来聊聊单质、酸、碱、盐还有氧化物它们之间那神奇的转化关系。
先说单质吧,像氧气、氢气、铁这些,它们可是很有个性的。
比如说铁,碰到氧气和水,一不小心就生锈啦,这锈就是氧化物哟。
再来说说酸,像盐酸、硫酸,它们可厉害了。
酸能和很多单质反应呢,比如锌和盐酸一相遇,就会产生氢气,这氢气就是单质哟。
碱呢,像氢氧化钠、氢氧化钾,它们和酸碰到一起,就会发生中和反应,盐和水。
盐也很有趣,通过各种反应能变来变去。
比如碳酸钙加热会变成氧化钙和二氧化碳,氧化钙就是氧化物啦。
氧化物也不简单,有的氧化物能和水反应酸或碱。
像二氧化碳溶到水里,就会变成碳酸。
呀,这单质、酸、碱、盐、氧化物之间就像在玩一场神奇的魔法游戏,不停地变来变去,是不是很有意思?
稿子二:
亲,咱们来唠唠单质、酸、碱、盐、氧化物之间的那些事儿。
单质,像活泼的金属单质钠,扔水里就会剧烈反应,氢氧化钠,这可就变成碱啦。
酸啊,比如说硝酸,它能和金属单质铜反应,硝酸铜,这就是盐啦。
碱也不示弱哦,氢氧化钙碰到二氧化碳,就会变成碳酸钙,这就是盐嘛。
盐也有好多变化,像氯化钠电解能得到钠单质和氯气。
氧化物呢,氧化铜和稀硫酸反应,就硫酸铜,还是盐哟。
还有啊,二氧化硫这种氧化物,溶到水里就是亚硫酸。
你看,它们之间的关系多奇妙,就像一群小伙伴在互相玩耍、互相转化,给我们带来好多惊喜。
是不是感觉化学世界超级有趣呀?。

单质、氧化物、酸、碱、盐的相互转化关系一、金属1、金属+氧气→金属氧化物:例如:2Mg + O2===2MgO 2Cu + O2===2CuO2、金属+酸→盐+H2 :酸一般指盐酸、稀硫酸,金属指金属活动顺序中H以前的金属例:Fe + H2SO4 == Fe SO4 + H2 Zn + 2HCl ===ZnCl2 + H23、金属+盐→另一种金属+另一种盐盐必须是可溶于水的,金属要求①不能是K、Ca、Na ②反应的金属比生成金属活泼例如:Fe + Cu SO4 ==== Cu + Fe SO4Cu + 2AgNO3 ==== 2Ag + Cu二、非金属1、非金属单质+O2→非金属氧化物例如:2H2 + O2 ===2H2O2、非金属单质+金属氧化物→金属+非金属氧化物非金属单质指:碳和氢气,金属氧化物一般指CuO 、Fe2O3例如C + 2CuO===2Cu + CO2三、金属氧化物1、金属氧化物+水→碱金属氧化物指Na2O、K2O、CaO、BaO例如:CaO + H2O===Ca( OH)2 Na2O+ H2O==2NaOH2、金属氧化物+酸→盐+水例如:Fe2O3 + 6HCl===2FeCl3 + 3 H2O3、金属氧化物(Fe2O3、CuO)和CO、H2、C的反应例如:3CO + Fe2O3===2Fe + 3CO2四、非金属氧化物:1、非金属氧化物+水→酸非金属氧化物指CO2、SO2、SO3例:CO2+ H2O == H2 CO3SO2 + H2O=== H2 SO32、非金属氧化物+可溶性碱→盐+水非金属氧化物指CO2、SO2、SO3例如:CO2 + Ca( OH)2 ===CaCO3 + H2O SO2 +2NaOH=== Na2SO3 + H2O五、酸1、酸+金属→盐+H2酸一般指盐酸、稀硫酸,金属指金属活动性顺序中H以前的金属例如:Mg + H2SO4 == MgSO4 + H22Al + 6HCl===2AlCl3 + 3 H22、酸+金属氧化物→盐+水例如:CuO + H2SO4 == CuSO4 + H2O 3、酸+碱→盐+水例如:NaOH + HCl ===NaCl + H2O4、酸+盐→另一种酸+另一种盐生成物中要有沉淀或气体和水例如:CaCO3 + 2HCl===CaCl2 +H2O + CO2HCl+AgNO3====AgCl + HNO3 H2SO4 + BaCl2 ===BaSO4 + 2HCl六、碱可溶性碱有NaOH、KOH、Ca(OH)2 、Ba(OH)2、不溶性碱Cu(OH)2蓝色固体Fe(OH)3红褐色固体1、可溶性碱+非金属氧化物→盐+水非金属氧化物指CO2、SO2、SO3例如:CO2 + 2NaOH====Na2CO3 + H2O2、碱+酸→盐+水例如:Cu(OH)2 + H2SO4 == CuSO4 + 2H2O3、可溶性碱+可溶性盐→另一种碱+另一种盐要求:反应的碱和盐都须溶于水,生成物中至少一种是沉淀例如:Ca(OH)2 + Na2CO3 == CaCO3 + 2 Na OH七、盐1、盐+金属→另一种盐+另一种金属盐须是可溶于水,金属要求①不能是K、Ca、Na ②反应的金属比生成金属活泼2Al + 3CuSO4 ==3Cu + Al2 (SO4)32、盐+酸→另一种盐+另一种酸生成物中要有沉淀或气体和水例如:Na2CO3 + 2HCl===2NaCl + CO2 + H2O3、可溶性碱+可溶性盐→另一种碱+另一种盐要求:反应的碱和盐都须溶于水,生成物中至少一种是沉淀例如:CuSO4 +2 Na OH==== Na2 SO4 + Cu(OH)24、盐+盐→新盐1+新盐2、要求:反应的盐都必须溶于水,生成物中至少一种是沉淀例如:Na2CO3 + CaCl2 ==== CaCO3 + 2NaCl练习:用六种不同的方法制取MgCl2Mg + HCl===MgO + HCl===Mg(OH)2 + HCl===Mg CO3+ HCl===MgSO4 + BaCl2===Mg + CuCl2===。
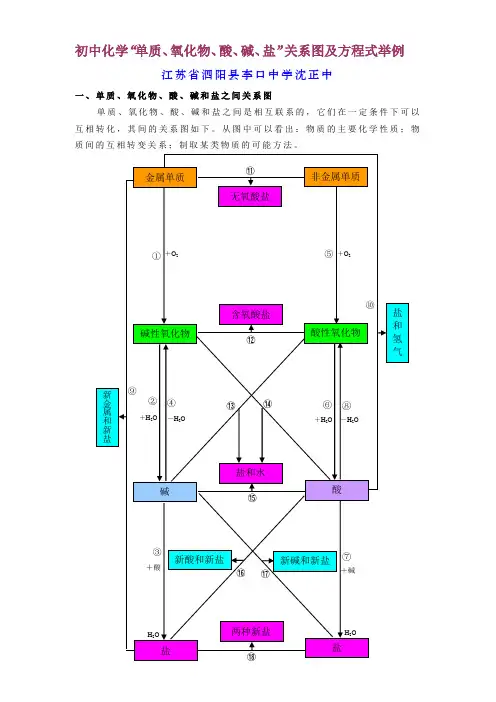
初中化学“单质、氧化物、酸、碱、盐”关系图及方程式举例江苏省泗阳县李口中学沈正中一、单质、氧化物、酸、碱和盐之间关系图单质、氧化物、酸、碱和盐之间是相互联系的,它们在一定条件下可以互相转化,其间的关系图如下。
从图中可以看出:物质的主要化学性质;物质间的互相转变关系;制取某类物质的可能方法。
二、单质、氧化物、酸、碱和盐之间关系方程式举例①金属单质+ O2→碱性氧化物2Mg + O2 点燃2MgO3Fe + 2O2 点燃Fe3O42Cu + O2△2CuO4Al + 3O2 点燃2Al2O3②碱性氧化物+ H2O →碱MgO+H2O Mg(OH)2CaO + H2Ca(OH)2Na2O + H22NaOHK2O + H22KOHBaO + H2Ba(OH)2④碱加热→碱性氧化物+ H2O2Fe(OH)加热Fe2O3+3H2OCu(OH)加热CuO+H2OMg(OH)加热MgO+H2O2Al(OH)加热Al2O3+3H2O⑤非金属单质+ O2→酸性氧化物2H2 + O2 点燃2H2O4P + 502 点燃2P2O5S + O2 点燃SO2C + O2 点燃CO22C + O2 点燃2COC + CO2高温2CO⑥酸性氧化物+ H2O →酸CO2 + H2H2CO3SO2 + H2H2SO3SO3 + H2H2SO4P2O5+H22HPO3P2O5+3H22H3PO43NO2+H22HNO3+NOH2SO4(浓度大于98%)加热H2O + SO3⑨金属单质+ 盐→ 新金属+ 新盐Fe + CuSO4Cu + FeSO4CuSO4ZnSO4 + Cu⑩金属单质+ 酸→ 盐+ 氢气Zn + H2SO4(稀) ZnSO4 + H2↑Mg + H2SO4(稀MgSO4 + H2↑2Al + 3H2SO4(稀) Al2(SO4)3 + 3H2↑Fe + H2SO4(稀) FeSO4 + H2↑Zn + 2HCl(稀ZnCl2 + H2↑Mg + 2HCl(稀) (稀MgCl2 + H2↑2Al + 6HCl(稀2AlCl3 + 3H2↑Fe + 2HCl(稀FeCl2 + H2↑⑪非金属单质(氧气除外)+ 金属单质→ 无氧酸盐2Na+ Cl2点燃2NaCl2Na + S 点燃Na2SCu + Cl2点燃CuCl2⑫酸性氧化物+ 碱性氧化物→ 含氧酸盐Na2O + CO2Na2CO3(缓慢吸收)CaO + SO2CaSO3Na2O + SO2Na2SO3Na2O + SO3Na2SO4(较快)CaO + SO3CaSO4(微溶,较慢)CaO + CO2CaCO3(非常缓慢)Na2O + SiO2 Na2SiO3(熔融时)CaO + SiO2CaSiO3(熔融时)⑬酸性氧化物+ 碱→ 盐+ 水CO2+2NaOH NaCO3+H2OCa(OH)2+CO2CaCO3+H2OCa(OH)2+SO3CaSO4↓+H2OCa(OH)2+SO2CaSO3↓+H2O⑭碱性氧化物+ 酸→ 盐+ 水③⑦⑮酸+ 碱→ 盐+ 水Cu(OH)2 + H2SO4CuSO4 + 2H2ONaCl + H2O2NaOH + H2SO4Na2SO4 + 2H2ONaOH + HNO3NaNO3 + H2OMg(OH)2 + 2HNO3Mg(NO3)2 + 2H2OBaSO4↓+2H2O⑰碱+ 盐→ 新碱+ 新盐CuSO4Cu(OH)2↓ + Na2SO4 FeCl3Fe(OH)3↓ + 3NaClCa(OH)2 + Na2CO3CaCO3↓ + 2NaOH NaOH + NH4NaCl+NH3↑ + H2OCuSO4 + Ba(OH)2 = BaSO4↓+ Cu(OH)2↓⑱盐+ 盐→ 新盐+ 另一新盐KCl + AgNO3AgCl↓ + KNO3NaCl + AgNO3AgCl↓ + NaNO3Na2SO4 + BaCl2BaSO4↓ + 2NaClBaCl2 + 2AgNO32AgCl↓ + Ba(NO3)2。
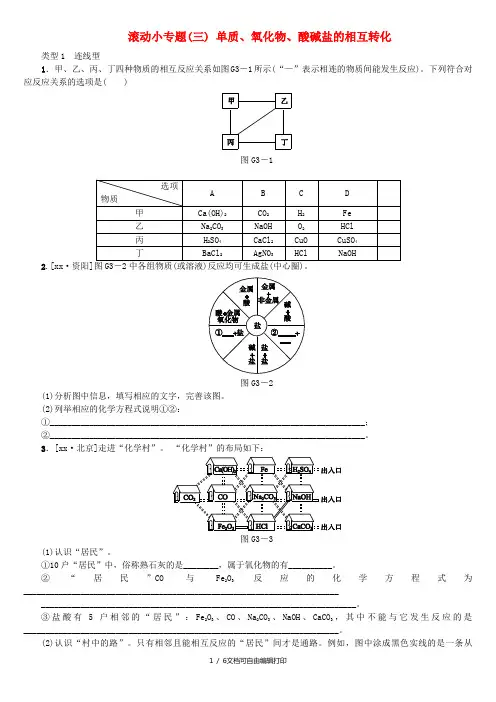
滚动小专题(三) 单质、氧化物、酸碱盐的相互转化类型1 连线型1.甲、乙、丙、丁四种物质的相互反应关系如图G3-1所示(“—”表示相连的物质间能发生反应)。
下列符合对应反应关系的选项是( )图G3-12.[xx·资阳]图G3-2中各组物质(或溶液)反应均可生成盐(中心圈)。
图G3-2(1)分析图中信息,填写相应的文字,完善该图。
(2)列举相应的化学方程式说明①②:①________________________________________________________________________;②________________________________________________________________________。
3.[xx·北京]走进“化学村”。
“化学村”的布局如下:图G3-3(1)认识“居民”。
①10户“居民”中,俗称熟石灰的是________,属于氧化物的有__________。
②“居民”CO与Fe2O3反应的化学方程式为________________________________________________________________________________________________________________________________________________。
③盐酸有5户相邻的“居民”:Fe2O3、CO、Na2CO3、NaOH、CaCO3,其中不能与它发生反应的是________________________________________________________________________。
(2)认识“村中的路”。
只有相邻且能相互反应的“居民”间才是通路。
例如,图中涂成黑色实线的是一条从“Fe2O3家”到达出入口的路。
请你在图中涂出一条从“CO2家”到达任一出入口的路。

人教版九年级化学说课稿单质、氧化物、酸碱盐的
相互关系
《单质、氧化物、酸碱盐的相互关系》说课稿
尊敬的各位领导、专家、同仁:
今天我说课的内容是人教版九年级化学第十、十一单元中的复习课题——《单质、氧化物、酸碱盐的相互关系》,我将从以下七个方面来展开我的说课:教材、学情、教法、学法、教学程序设计、板书设计、教学效果预测。
一、说教材
1.教材的地位与作用
本课题是第十单元和第十一单元之后单元复习中的一部分,是对单质、氧化物、酸、碱、盐五类物质化学性质的归纳、整理和运用,是对置换反应和复分解反应条件的进一步认识。
通过复习,可以训练学生分析问题整理归纳的能力,培养科学的解题方法,认识到各类物质间的关系和基本规律是相对的、有条件的,从而使零散的知识条理化、系统化,有利于形成知识和能力的飞跃。
2.教学目标
根据新课标和学生实际,我确定了如下三维教学目标:
⑴知识与技能:①.熟悉常见单质、氧化物和酸、碱、盐的化学性质。
②.根据单质、氧化物、酸、碱、盐的典型特征和相互关系做简单的推断题。
⑵过程与方法:通过单质、氧化物、酸碱盐的网络关系图,培养学生对知识的整理归纳能力,并从中提取有价值信息的能力;通过演练,培养学生的观察能力和解题能力;通过讨论,培养学生的的交流与合作能力。
⑶情感态度与价值观:让学生在观察、演练、归纳、合作与交流的过程。
教学过程一、复习学生回答:酸碱盐金属的化学性质分别有哪些?二、知识讲解考点/易错点1 各类物质间的转化我们已经学习了金属酸碱盐等物质的化学性质,它们在中考中占有很大比例,如何快速记住这些物质的性质并学会这些知识的应用呢?我们通过下面这个图表来弄清单质氧化物酸碱盐之间的相互转化,并通过这个图表来快速记住这些物质的化学性质。
(一) 根据右图可以看出: 1.纵的转化:如:Ca →CaO →Ca(OH)2→CaCL 2C →CO 2 →H 2CO 3 →CaCO 32.横的转化:① 金属+酸→盐+H 2(①H 前面的金属;②不能是浓硫酸和硝酸) ② 金属+盐→金属+盐(①排在前面的金属;②可溶性盐) ③ 碱性氧化物+酸→盐+水 ④ 酸性氧化物+碱→盐+水⑤ 酸+碱→盐+水 ⑥ 酸+盐→酸+盐 ⑦ 碱+盐→碱+盐 ⑧ 盐+盐→盐+盐其中①②属于置换反应,要根据金属活动性顺序来判断反应是否能进行;⑤⑥⑦⑧属于复分解反应,要根据复分解反应发生的条件和酸碱盐的溶解性来判断反应是否能进行,只有知道了各类反应的限制条件才能正确理解物质的化学性质,写出正确的化学方程式。
考点/易错点2 各类物质的化学性质 (二)根据图表预测各类物质的化学性质讲解:如图表中有四条线与酸相连则可以知道酸能与这四类物质发生反应,再加上酸与指示剂反应,因此酸的通性有五条。
其他物质的化学性质都可以推出,还可以判断哪些物质间不能反应。
学生练习:通过图表说出金属、碱性氧化物、酸性氧化物、碱、盐的化学性质。
考点/易错点3各类物质的制法 (三)根据图表预测各类物质的制法讲解:若要制取可溶性碱氢氧化钠,则理论上可以找到二种方法:① 碱 + 盐→碱 + 盐,②碱性氧化物 +水→碱 ;若要制取难溶性碱氢氧化铜,则只能找到一种方法:碱 + 盐→碱 + 盐 。
因为,氧化铜不能跟水发生反应。
学生练习:(1)用多种方法制取硫酸锌,写出化学方程式。
(2)以石灰水、纯碱、水为原料制取烧碱,写出化学方程式。
单质、氧化物、酸碱盐的相互转化关系
【知识回顾】
1.单质 氧化物 酸 碱 盐的转化关系图
学习完《酸、碱、盐》一章后,同学们常常会有一种内容太多、没有头绪的感觉。
其实,只要稍加整理,就会发现物质之间的关系是有规律可循的。
一、 首先将物质进行简单分类(只分到如下的七类物质即可)
二、将上述七类物质之间的转化和相互反应的关系列表如下:
竖的关系:
1. 金属+氧气→碱性氧化物; MgO O Mg 222点燃
==+
2.碱性氧化物+水→碱;(一般仅:K,Na,Ba,Ca 的氧化物可以。
)
*只有四种可溶性碱KOH,NaOH,Ca(OH)2,Ba(OH)2对应的碱性氧化物K 2O,Na 2O,CaO,BaO 可直接与水化合生成相应碱,其余不能 如:Na 2O+H 2O==2NaOH CaO+H 2O==Ca(OH)2
故:上述四种氧化物溶于水时得到的都是相应碱的溶液,除Ca(OH)2是微溶碱外,其余都易溶。
22Ca(OH)O H CaO ==+
2. 碱−→−∆
碱性氧化物+水;(除K,Na,Ba,Ca 的氢氧化物外一般都可以。
) ()O H CuO OH Cu 22+==∆
a 、不溶性碱....
受热才能发生分解反应 b 、反应前后元素的化合价不变(特别注意金属元素的化合价)
如:2Fe(OH)3Fe 2O 3+ H 2O Cu(OH)22CuO+H 2O 3. 碱――→盐(有三种方法);(即: 酸性氧化物+碱→盐+水; 碱+酸→盐+水; 碱+盐→新碱+新盐.)
4. 非金属+氧气→酸性氧化物; 522254O P O P 点燃
==+
5. 酸性氧化物+水→酸;(一般都可以,但SiO 2不行。
) 3222CO H O H CO ==+
* a 除SiO 2外,其余酸性氧化物一般都能直接与水化合生成相应酸
b 、反应前后元素的化合价一定不变(特别注意除氢、氧外的非金属元素的化合价)
如:CO 2+ H 2O== H 2CO 3 SO 3+ H 2O== H 2SO 4
故:酸性氧化物溶于水时得到的都是相应酸的溶液。
6. 酸−→−∆酸性氧化物+水;(一般都可以,但硫酸不行。
) O H CO CO H 2232+↑== * a 、仅有含氧酸才能分解
b 、反应前后元素的化合价一定不变(特别注意除氢、氧外的非金属元素的化合价)
c 、酸性氧化物又叫酸酐(原因是:酸性氧化物可看作是含氧酸脱水的产物)
如:H 2SO 3 H 2O+ SO 2↑ H 2CO 3 H 2O+ CO 2↑ 例1。
根据下表列出的氯的含氧酸跟它对应的氧化物(叫酸酐)的化合价关系.判断HN03的酸酐是
( )
A.NO B N 2O 5 C.N 2O 3 D.NO 2
例2. 写出下列几种含氧酸的酸酐:
H 2SO 4______ HNO 3_____ H 3PO 4_____ H 2SO 3____
7. 酸――→盐(有三种方法);
横的关系:
1. 金属+非金属→盐(无氧酸盐); NaCl Cl Na 222点燃
==+
2. 碱性氧化物+酸性氧化物→盐(含氧酸盐); 32CaCO CO CaO ==+
3. 碱+酸→盐+水(中和反应); ()O H CuCl HCl OH Cu 22222+==+
4. 盐+盐→新盐+新盐(△) (
)白色↓+==+AgCl NaNO NaCl AgNO 33 斜的关系:
1. 碱性氧化物+酸→盐+水; O H FeCl HCl O Fe 2332326+==+
2. 酸性氧化物+碱→盐+水; O H SO Na NaOH SO 23222+==+
3. 碱+盐→新碱+新盐;(△) ()(
)白色↓+==+33222CaCO NaOH CO Na OH Ca * a 、参加反应的碱和盐必须都是可溶的
b 、必须符合复分解反应发生的条件
c 、可溶性碱跟铵盐一定能反应(原因是该反应一定有水和氨气生成)
如:2NaOH+CuSO 4==Na 2SO 4+Cu(OH)2↓ 3NaOH+FeCl 3==3NaCl+Fe(OH)3↓
Ca(OH)2+2NH 4Cl==CaCl 2+H 2O+NH 3↑
4. 酸+盐→新酸+新盐;(△) O H CO CaCl HCl CaCO 22232+↑+==+
*a 、只要符合复分解反应发生的条件即可
b 、碳酸盐跟酸一定能反应(原因是该反应一定有水和二氧化碳生成)
如:HCl+AgNO 3==AgCl ↓+HNO 3 H 2SO 4+BaCl 2== BaSO 4↓+2 HCl
2 HCl+CaCO 3==CaCl 2+H 2O+CO 2↑
5. 金属+酸→盐+氢气;(★) ↑+==+2442H ZnSO SO H Zn
* a 、这里的酸通常是指盐酸和稀硫酸(硝酸、浓硫酸跟金属反应一般不产生氢气)
b 、只有排在(氢)前面的金属才能置换出酸中的氢
c 、铁跟盐酸和稀盐酸反应生成亚铁盐...
如:Mg+2HCl==MgCl 2 +H 2↑ Fe+H 2SO 4== Fe SO 4+ H 2↑
6. 金属+盐→新金属+新盐。
(★) Cu Cu 44+==+FeSO SO Fe
*a 、盐必须是可溶的 b 、参加反应的金属必须排在盐中金属的前面
c 、K.Ca.Na 等活泼金属放入盐溶液时,发生的反应有两个,但不能置换..
出盐中的金属。
如:把钠放入溶液中发生的反应为:
2Na+2H 2O==2NaOH+H 2 ↑ 2NaOH+CuSO 4==Cu(OH)2↓+Na 2SO 4
d 、铁跟盐反应生成的是亚铁盐...。
如Fe+CuSO 4==
FeSO 4 +Cu Cu+Hg(NO 3)2==Cu(NO 3 ) 2+ Hg
△ 生成物要有沉淀或气体或水。
反应物一般要能溶于水;但在4中,若酸是强酸,盐是碳酸盐,则盐能否溶于水,不做要求。
★ 按金属元素活动顺序,进行反应。
酸碱盐化学方程式(归纳总结)试题:
一.两个置换反应规律
1.酸+金属==盐+氢气
反应条件:①酸不能用强氧化性酸,如硝酸、浓硫酸,(常用稀硫酸、盐酸)
②金属必须位于氢以前(常用Mg、Al、Zn、Fe)
Mg+ HCl== Mg+ H2SO4==
Al+ HCl== Al+ H2SO4==
Zn+ HCl== Zn+ H2SO4==
Fe+ HCl== Fe+ H2SO4===
2.盐+金属==新盐+新金属
反应条件:①盐(反应物)必须溶于水
②金属单质(反应物)比盐中金属活泼,不用钾、钙、钠
Fe+CuSO4== Al+ CuSO4==
Zn+CuSO4== Cu+ AgNO3==
Cu+Hg(NO3)2==
二.三个分解反应规律
1.酸(含氧酸)==非金属氧化物+水
=== H2O+CO2↑
2.碱(难溶性)== 金属氧化物+水
Cu(OH)2Fe(OH)3
3.碳酸盐(难溶性)==金属氧化物+二氧化碳
CaCO3
三.四个化合反应规律
1.金属+氧气== 金属氧化物
Mg+O2Fe+ O2Cu+ O2
2.金属氧化物+水== 碱(可溶性)
CaO+H2O== Na2O+H2O==
3.非金属+氧气==非金属氧化物
S+O2P+O2C+O2(碳充分燃烧)
C+O2(碳不充分燃烧) H2+O2
4.非金属氧化物+水==酸
CO2+H2O== SO3+H2O== SO2+H2O==
四.五个复分解反应规律(亚硫酸)
1.酸+碱==盐+水
Cu(OH)2+ HCl== Al(OH)3+ HCl==
Cu(OH)2+H2SO4== Mg(OH)2+ HNO3==
2.酸+盐==新酸+新盐反应条件:符合复分解反应发生的条件(实际反应条件很复杂)
CaCO3+ HCl== Na2CO3+ HCl==
AgNO3+ HCl==
Na2CO3+H2SO4== H2SO4+BaCl2==
H2SO4+Ba(NO3)2==
3.盐+碱==新盐+新碱
反应条件:反应物都溶于水,生成物至少有一种不溶(前溶后沉)
CuSO4+ NaOH== FeCl3+ NaOH==
Na2CO3+Ca(OH)2== CuSO4+Ba(OH)2==
4.盐+盐==新盐+新盐反应条件:反应物都溶于水,生成物至少有一种不溶(前溶后沉)
NaCl+AgNO3== Na2SO4+BaCl2==
Na2SO4+Ba(NO3)2==
5.酸+金属氧化物==盐+水
Fe2O3+ HCl== Fe2O3+H2SO4==
CuO+ HCl== CuO+ H2SO4==
MgO+ HNO3==
五.其它反应
1.碱+非金属氧化物==盐+水(不属于四种化学反应基本类型)
NaOH+CO2== NaOH+SO2==
NaOH+SO3== Ca(OH)2+CO2==
2.三种还原剂(H2 、、C 、O2 )跟氧化物反应
H2+CuO (置换反应)CO+CuO
CO+Fe2O3C+CuO (置换反应)C+CO2(化合反应)
3.实验室制取三种气体(常用方法)
KMnO4KClO3
Zn+ HCl== Zn+ H2SO4==
CaCO3+HCl==
4.盐分解
Cu2(OH)2CO3CaCO3
KMnO4KClO3
5.三种有机物燃烧
CH4+ O2 C2H5OH+O2
CH3OH+O2。