单质氧化物酸碱盐的转化关系图
- 格式:doc
- 大小:100.50 KB
- 文档页数:1
单质、氧化物、酸、碱、盐之间的关系简析学习完《酸、碱、盐》一章后,同学们常常会有一种内容太多、没有头绪的感觉。
其实,只要稍加整理,就会发现物质之间的关系是有规律可循的。
一、首先将物质进行简单分类(只分到如下的七类物质即可)二、将上述七类物质之间的转化和相互反应的关系列表如下:三、上述七类物质之间相互转化和相互反应的规律及注意问题(一)、六种相互转化关系1、金属+O2→碱性氧化物(化合反应)如:2Mg+O 22MgO 2Cu+ O 22CuO2、碱性氧化物+ H2O→碱(化合反应)*只有四种可溶性碱KOH,NaOH,Ca(OH)2,Ba(OH)2对应的碱性氧化物K2O,Na2O,CaO,BaO可直接与水化合生成相应碱,其余不能如:Na2O+H2O==2NaOH CaO+H2O==Ca(OH)2故:上述四种氧化物溶于水时得到的都是相应碱的溶液,除Ca(OH)2是微溶碱外,其余都易溶。
练习:将6.2克Na2O溶于93.8克水中,所得溶液中溶质的化学式为_____,所得溶液的溶质质量分数为________。
3、碱→碱性氧化物+水(分解反应)a、不溶性碱....受热才能发生分解反应b、反应前后元素的化合价不变(特别注意金属元素的化合价)如:2Fe(OH)3Fe2O3+ H2O Cu(OH)22CuO+H2O4、非金属+O2→酸性氧化物(化合反应)如:C+ O 2CO2 S+O 2SO25、酸性氧化物+H2O→酸(含氧酸)(化合反应)* a除SiO2外,其余酸性氧化物一般都能直接与水化合生成相应酸b、反应前后元素的化合价一定不变(特别注意除氢、氧外的非金属元素的化合价)如:CO2+ H2O==H2CO3SO3+ H2O== H2SO4故:酸性氧化物溶于水时得到的都是相应酸的溶液。
练习:将8克SO3完全溶于92克水中,所得溶液中溶质的名称为该溶液的溶质质量分数为________。
6、酸→酸性氧化物+水(分解反应)* a、仅有含氧酸才能分解b、反应前后元素的化合价一定不变(特别注意除氢、氧外的非金属元素的化合价)c、酸性氧化物又叫酸酐(原因是:酸性氧化物可看作是含氧酸脱水的产物)如:H2SO 4H2O+ SO3 ↑H2CO 3H2O+ CO2↑练习:向滴有紫色石蕊试液的水中通入CO2气体,溶液由____色变为___色;再将此溶液加热,溶液又由____色变为____色,原因是(用化学方程式表示)____________________________。



单质、氧化物、酸、碱、盐的相互转化关系一、金属1、金属+氧气→金属氧化物:例如:2Mg + O2===2MgO 2Cu + O2===2CuO2、金属+酸→盐+H2 :酸一般指盐酸、稀硫酸,金属指金属活动顺序中H以前的金属例:Fe + H2SO4 == Fe SO4 + H2 Zn + 2HCl ===ZnCl2 + H23、金属+盐→另一种金属+另一种盐盐必须是可溶于水的,金属要求①不能是K、Ca、Na ②反应的金属比生成金属活泼例如:Fe + Cu SO4 ==== Cu + Fe SO4Cu + 2AgNO3 ==== 2Ag + Cu二、非金属1、非金属单质+O2→非金属氧化物例如:2H2 + O2 ===2H2O2、非金属单质+金属氧化物→金属+非金属氧化物非金属单质指:碳和氢气,金属氧化物一般指CuO 、Fe2O3例如C + 2CuO===2Cu + CO2三、金属氧化物1、金属氧化物+水→碱金属氧化物指Na2O、K2O、CaO、BaO例如:CaO + H2O===Ca( OH)2 Na2O+ H2O==2NaOH2、金属氧化物+酸→盐+水例如:Fe2O3 + 6HCl===2FeCl3 + 3 H2O3、金属氧化物(Fe2O3、CuO)和CO、H2、C的反应例如:3CO + Fe2O3===2Fe + 3CO2四、非金属氧化物:1、非金属氧化物+水→酸非金属氧化物指CO2、SO2、SO3例:CO2+ H2O == H2 CO3SO2 + H2O=== H2 SO32、非金属氧化物+可溶性碱→盐+水非金属氧化物指CO2、SO2、SO3例如:CO2 + Ca( OH)2 ===CaCO3 + H2O SO2 +2NaOH=== Na2SO3 + H2O五、酸1、酸+金属→盐+H2酸一般指盐酸、稀硫酸,金属指金属活动性顺序中H以前的金属例如:Mg + H2SO4 == MgSO4 + H22Al + 6HCl===2AlCl3 + 3 H22、酸+金属氧化物→盐+水例如:CuO + H2SO4 == CuSO4 + H2O 3、酸+碱→盐+水例如:NaOH + HCl ===NaCl + H2O4、酸+盐→另一种酸+另一种盐生成物中要有沉淀或气体和水例如:CaCO3 + 2HCl===CaCl2 +H2O + CO2HCl+AgNO3====AgCl + HNO3 H2SO4 + BaCl2 ===BaSO4 + 2HCl六、碱可溶性碱有NaOH、KOH、Ca(OH)2 、Ba(OH)2、不溶性碱Cu(OH)2蓝色固体Fe(OH)3红褐色固体1、可溶性碱+非金属氧化物→盐+水非金属氧化物指CO2、SO2、SO3例如:CO2 + 2NaOH====Na2CO3 + H2O2、碱+酸→盐+水例如:Cu(OH)2 + H2SO4 == CuSO4 + 2H2O3、可溶性碱+可溶性盐→另一种碱+另一种盐要求:反应的碱和盐都须溶于水,生成物中至少一种是沉淀例如:Ca(OH)2 + Na2CO3 == CaCO3 + 2 Na OH七、盐1、盐+金属→另一种盐+另一种金属盐须是可溶于水,金属要求①不能是K、Ca、Na ②反应的金属比生成金属活泼2Al + 3CuSO4 ==3Cu + Al2 (SO4)32、盐+酸→另一种盐+另一种酸生成物中要有沉淀或气体和水例如:Na2CO3 + 2HCl===2NaCl + CO2 + H2O3、可溶性碱+可溶性盐→另一种碱+另一种盐要求:反应的碱和盐都须溶于水,生成物中至少一种是沉淀例如:CuSO4 +2 Na OH==== Na2 SO4 + Cu(OH)24、盐+盐→新盐1+新盐2、要求:反应的盐都必须溶于水,生成物中至少一种是沉淀例如:Na2CO3 + CaCl2 ==== CaCO3 + 2NaCl练习:用六种不同的方法制取MgCl2Mg + HCl===MgO + HCl===Mg(OH)2 + HCl===Mg CO3+ HCl===MgSO4 + BaCl2===Mg + CuCl2===。


单质氧化物酸碱盐相互反应的规律性和特例1. 金属+金属→不反应,但可形成合金。
2. 非金属+非.金属→共价化合物如:P+Cl2、C+S、Xe+F2等反应。
特例:金刚石与石墨、红磷和白磷在一定条件下相互转化,生成物仍为单质,不是化合物。
3. 金属+非金属→无氧酸盐如:Fe + Cl2、Cu + Cl2、Na + S、Cu + S、Fe + S 等反应。
特例:2Na + H2=2NaH、3Mg + N2=== Mg3N2,NaH属氢化物,Mg3N2属氮化物,均不属盐类。
4. 金属+氧气→碱性氧化物如:Na、Mg、Cu 和 O2反应生成 Na2O、MgO、CuO。
特例:Na、Al、Fe在O2中燃烧,其产物 Na2O2属过氧化物,Al2O3属两性氧化物,Fe3O4是特殊的氧化物,确切讲是一种盐。
5. 非金属+氧气→酸性氧化物如:C、S、P 和 O2反应生成 CO2、SO2、P2O5。
特例:N2、C与O2反应生成的NO 、CO均不属于酸性氧化物,为中性氧化物。
6. 碱性氧化物+酸性氧化物→含氧酸盐如:CaO + CO2;CaO+SiO2(高温下);Na2O+P2O5等反应。
7. 碱性氧化物+水→碱如:Na2O、K2O、CaO、BaO、MgO(需热水)均可和水直接化合成碱。
特例:CuO、Fe2O3等不可直接和水反应。
8. 酸性氧化物+水→含氧酸如:SO2、SO3、P2O5等和水反应。
特例:SiO2不溶于水,NO2溶于水生成 HNO3和 NO等反应。
特例:3FeO+ 10HNO3(稀)=3Fe(NO3)3+NO +5H2OFe2O3+ 6HI= 2FeI2+I2 + 3H2O10.酸性氧化物+碱→盐+水如:CO2、SO2和NaOH反应生成Na2CO3和水及Na2SO3和水。
特例:CO2+ NaOH = NaHCO3、SO2.+ NaOH = NaHSO311.酸+碱→盐十水如:HCl + NaOH、H2SO4+Ba (OH)2、HNO3+ Ca(OH)2等。



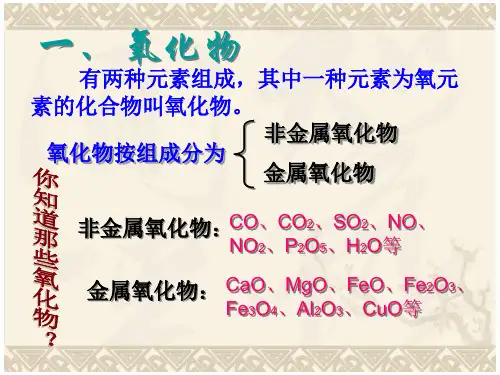
专题复习:酸碱盐、氧化物一、单质、氧化物、酸、碱和盐的概念单质:同种元素组成的纯净物化合物:由两种或两种以上元素组成的纯净物氧化物:由两种元素组成的化合物,其中有一种元素是氧(非金属氧化物大多数为酸性氧化物,能与碱反应生成盐和水;金属氧化物大多数为碱性氧化物,能与酸反应生成盐和水。
)酸性溶液:能使紫色石蕊试液变红的溶液 碱性溶液:能使紫色石蕊试液变蓝的溶液酸:电离时生成的阳离子全部是氢离子(H +)的化合物 碱:电离时生成的阴离子全部是氢氧根离子(OH —)的化合物 盐:电离时生成金属离子(或铵根)和酸根离子的化合物 二、常见金属活动性顺序:很活泼 较活泼 不活泼在金属活动性顺序中:①金属的位置越前,金属在水溶液中(酸或盐的水溶液)就越易失去电子,变成阳离子,其活动性就越强。
②只有排在氢前面的金属,才能置换酸中的氢。
较活泼的金属能置换出较不活泼的金属1.浓盐酸--有挥发性、有刺激性气味、在空气中能形成酸雾.2.浓硫酸——无挥发性.粘稠的油状液体.有很强的吸水性(和脱水性),溶水时能放出大量的热。
3.浓硝酸——(略) 4.醋酸-—(略)浓H 2SO 4的稀释:“酸入水,沿器壁,慢慢倒、边搅拌”。
由于浓H 2SO 4溶于水后会释放出大量的热量,为了及时散热,可用上述操作。
如果水倒入酸中,由于水的密度较小,浮在表面,导致热量不能及时散发而沸腾,溅出造成危险。
四、碱的命名及常见的碱根据碱组成中的氢氧根离子和金属离子的名称,叫做“氢氧化某” 例如,Cu(OH)2叫氢氧化铜,Al(OH)3叫氢氧化铝.当金属有两种价态,把低价的金属形成碱命名为“氢氧化亚某”.例如:Fe(OH)2叫氢氧化亚铁1.NaOH俗名火碱、烧碱、苛性钠. 白色固体,极易溶于水,溶解时放热,有吸水性,易潮解(作干燥剂)有强腐蚀性。
2.Ca(OH)2俗名熟石灰、消石灰.白色固体,微溶于水,溶解度随温度升高而减小,有强腐蚀性。
五、盐的命名及常见的盐其中无氧酸盐的命名是在非金属元素和金属元素名称中间加一“化”字,叫做“某化某”,如NaCl叫做氯化钠,K2S叫做硫化钾等等。

单质、氧化物、酸碱盐的相互转化关系单质、氧化物、酸碱盐的相互转化关系【知识回顾】1.单质 氧化物 酸 碱 盐的转化关系图学习完《酸、碱、盐》一章后,同学们常常会有一种内容太多、没有头绪的感觉。
其实,只要稍加整理,就会发现物质之间的关系是有规律可循的。
一、 首先将物质进行简单分类(只分到如下的七类物质即可)二、将上述七类物质之间的转化和相互反应的关系列表如下:竖的关系:1. 金属+氧气→碱性氧化物; MgO O Mg 222点燃==+2.碱性氧化物+水→碱;(一般仅:K,Na,Ba,Ca 的氧化物可以。
)*只有四种可溶性碱KOH,NaOH,Ca(OH)2,Ba(OH)2对应的碱性氧化物K 2O,Na 2O,CaO,BaO 可直接与水化合生成相应碱,其余不能 如:Na 2O+H 2O==2NaOH CaO+H 2O==Ca(OH)2故:上述四种氧化物溶于水时得到的都是相应碱的溶液,除Ca(OH)2是微溶碱外,其余都易溶。
22Ca(OH)O H CaO ==+2. 碱−→−∆碱性氧化物+水;(除K,Na,Ba,Ca 的氢氧化物外一般都可以。
)()OH CuO OH Cu 22+==∆a 、不溶性碱....受热才能发生分解反应 b 、反应前后元素的化合价不变(特别注意金属元素的化合价)如:2Fe(OH)3Fe 2O 3+ H 2O Cu(OH)22CuO+H 2O3. 碱――→盐(有三种方法);(即: 酸性氧化物+碱→盐+水; 碱+酸→盐+水; 碱+盐→新碱+新盐.)4. 非金属+氧气→酸性氧化物; 522254O P O P 点燃==+5. 酸性氧化物+水→酸;(一般都可以,但SiO 2不行。
)3222CO H O H CO ==+* a 除SiO 2外,其余酸性氧化物一般都能直接与水化合生成相应酸b 、反应前后元素的化合价一定不变(特别注意除氢、氧外的非金属元素的化合价)如:CO 2+ H 2O== H 2CO 3 SO 3+ H 2O== H 2SO 4 故:酸性氧化物溶于水时得到的都是相应酸的溶液。
单质、氧化物、酸碱盐的相互转化关系(导图版)为4⽉6⽇晚8:30,在uc聊天室[化学教与学]房间的讲座准备的PPT,还在不断的修改中!本次开始实践思维导图在复习课中的运⽤,很多功能还不是很熟悉,希望各位同⼈多提宝贵建议!很多试题的答案是⽤的强调变⾊显⽰,还有很多ppt动画不能显⽰,待最终版完成会给⼤家直接提供下载地址!可以尝试将本⽂稿放到google共享⽂档中,与各位同仁协作修改!期待你的建议ing……幻灯⽚1幻灯⽚2涛声依旧 1 年, 11 ⽉前说: 主要内容⼀⽬了然,看起来也很美,给学⽣美感,愉悦有助提⾼兴趣。
幻灯⽚3潇潇⾬ 1 年, 11 ⽉前说: ⼀⽬了然,学⽣⽬前记忆这个总是有问题涛声依旧: CaSO4 AgSO4 微溶保存取消删除幻灯⽚4幻灯⽚5涛声依旧 1 年, 11 ⽉前说: 是不是增加Cl-zhangyanxia 1 年, 11 ⽉前说: 都从阴离⼦⾓度总结,可以避免重复。
幻灯⽚6涛声依旧: 此处为什么不分别画出⾦属氧化物和⾮⾦属氧化物保存取消删除幻灯⽚7涛声依旧 1 年, 11 ⽉前增加标注: 此处为什么不分别画出⾦属氧化物和⾮⾦属氧化物潇潇⾬ 1 年, 11 ⽉前说: ⾦属氧化物与酸反应属于复分解反应,碱性氧化物与碱反应不属于,此处没有表⽰出来⽹络飞翔 1 年, 11 ⽉前说: @涛声依旧: 这是按照物质分类的基础上划分的,没有进⾏再区分!⽹络飞翔 1 年, 11 ⽉前说: @潇潇⾬: ⾦属氧化物与酸的反应是不是复分解反应,⽼教材认为是,现在存在争议,考试是不会考的,⼲脆不把这些模糊地概念给学⽣!幻灯⽚8涛声依旧 1 年, 11 ⽉前增加标注: 此处为什么不明确⾦属单质?冲浪者 1 年, 11 ⽉前增加标注: 应该是活泼⾦属单质。
幻灯⽚11幻灯⽚12涛声依旧 1 年, 11 ⽉前增加标注: 是否该增加SO3与NaOH的反应,教材中有,学⽣也易写错。
涛声依旧 1 年, 11 ⽉前增加标注: 应为氨⽓+⽔幻灯⽚13幻灯⽚14幻灯⽚15zhangyanxia 1 年, 11 ⽉前说: 是不是应该说上盐不能⽤钡盐、三价铁盐、钾盐、钠盐、钙盐呢?幻灯⽚18幻灯⽚19涛声依旧: 丢掉了BaCl2,NaCO3误写保存取消删除幻灯⽚20。
专题09 单质、氧化物、酸碱盐的相互转化关系【知识回顾】1.单质氧化物酸碱盐的转化关系图(1)酸的通性:①与酸碱指示剂作用②氢前金属+酸→③碱性氧化物+酸→④碱+酸→⑤某些盐+酸→(2)碱的通性:①与酸碱指示剂作用②碱+酸性氧化物→③碱+酸→④碱+某些盐→(3)盐的通性:①前面的金属+后边金属的盐溶液→②盐+酸→③碱+某些盐→④盐+盐→【练一练】1.中国丝绸有五千年的历史和文化.古代染坊常用某种“碱剂”来精炼丝绸,该“碱剂”的主要成分是一种盐,能促进蚕丝表层的丝胶蛋白杂质水解而除去,使丝绸颜色洁白、质感柔软、色泽光亮.这种“碱剂”可能是( )A.食盐 B.火碱 C.草木灰D.胆矾2.分类是化学学习中经常用到的方法,下列对一些物质或化学反应的分类以及依据正确的是( )A.H2SO4是酸,因为H2SO4中含有氢元素B.豆浆是胶体,因为豆浆中的分散质粒子直径在1nm~100nm之间C.Na和H2O的反应不是离子反应,因为反应中没有离子参加D.燃烧必须有氧气参与,因而没有氧气参与的反应一定没有燃烧现象3.下列说法正确的是( )A.由反应SiO2+4HF═SiF4+2H2O,可知SiO2是碱性氧化物B.由酸性溶液中MnO4﹣可以氧化Cl﹣,可知酸性溶液中MnO4﹣也能氧化Br﹣C.由反应CuSO4+H2S═CuS+H2SO4,可知酸性H2S>H2S04D.由常温下金属钠、铝可溶于NaOH溶液,可知金属镁也能溶于NaOH溶液4.化学是一门实用性强的自然科学,在社会、生产、生活中起着重要的作用,下列说法不正确的是( )A.油条的制作口诀是“一碱、二矾、三钱盐”,其中的“碱”是烧碱B.黑火药的最优化配方是“一硫二硝三木炭”,其中的“硝”是硝酸钾C.过滤操作要领是“一贴二低三靠”,其中“贴”是指滤纸紧贴漏斗的内壁D.“固体需匙或纸槽,一送二竖三弹弹;块固还是镊子好,一横二放三慢竖“.前一个固体一般指粉末状固体5.我国清代《本草纲目拾遗》中记载药物“鼻冲水”,写道:“贮以玻璃瓶,紧塞其口,勿使泄气,则药力不减,气甚辛烈,触人脑,非有病不可嗅.….虚弱者忌之.宜外用,勿服.….”这里的“鼻冲水”是指( )A.氨水 B.硝酸 C.醋D.卤水6.KAl(SO4)2、KFe(SO4)2、(NH4)Fe(SO4)2都属于复盐,通过类比判断,下列属于复盐的是( ) A.NaAlO2B.KMgCl3C.CaOCl2D.Na3AlF67.分类是学习和研究化学的一种重要方法,下列分类合理的是( )A.Na2CO3和Na2O2都属于盐B.KOH和KHCO3都属于碱C.H2SO4和H3PO4都属于酸D.Na2O和Na2SiO3都属于氧化物8.下列物质分类正确的是( )A.SO2、SiO2、CO均为酸性氧化物B.稀豆浆、硅酸、氯化铁溶液均为胶体C.烧碱、冰醋酸、四氯化碳均为电解质D.福尔马林、水玻璃、氨水均为混合物9.下列正确的叙述有( )①CO2、SiO2、P2O5均为酸性氧化物;②Ca(HCO3)2、Fe(OH)3、FeCl2均可通过化合反应制得;③红外光谱仪可用于测定化合物的官能团;④金属元素和非金属元素形成的化合物一定是离子化合物;⑤需要通电才可进行的有:电离、电解、电泳、电镀、电化学腐蚀;⑥氯化铁溶液与氢氧化铁胶体具有的共同性质是:能透过滤纸,如加热蒸干、灼烧后都有氧化铁生成;⑦按照纯净物、混合物、强电解质、弱电解质和非电解质顺序排列的是油脂、碘化银胶体、苛性钾、碳酸钙、氯气.A.4个B.5个 C.6个 D.7个10.下列关于氧化物的叙述正确的是( )A.金属氧化物一定是碱性氧化物B.非金属氧化物一定是酸性氧化物C.酸性氧化物均可以跟碱反应D.不能跟酸反应的氧化物一定能跟碱反应11.图中的“金属”为Na,“非金属”为S.仔细阅读两种元素在图示中经历的反应变化,回答下列问题.(1)反应①中的反应类型是;(2)反应②中“碱”的电子式是;(3)反应③产生的盐为NaHCO3,则该化学反应的离子方程式是;(4)反应④的“酸性氧化物”能在大气中被氧化形成酸雨,用化学方程式表示其形成酸雨的过程:;(5)反应⑤为非氧化还原反应,该“酸”属于;A 强电解质B 弱电解质C 二元酸D 离子化合物(6)反应⑥产生的盐,能发生反应(12).写出一种该盐的化学式;(7)反应(14)中若“酸”、“碱”未完全中和,产生的盐是。
高中化学酸碱盐氧化物知识小结—八圈图学法指导盐和金属金属非金属碱性氧化物酸性氧化物碱酸盐盐盐(无氧酸盐)盐(含氧酸盐)盐和水碱和盐酸和盐两种新盐盐和氢气+酸+碱(16)(1)+O2(7)(17)+O2(4)(17)(8)(2)+H2O-H2O(3)(11)(12)(5)+H2O-H2O(6)(15)(9)(14)(13)(10)记忆口诀:两条纵线通到底(6条规律)四条横线相联系(5条规律)六条交叉成网络(6条规律)17条规律要牢记(横、纵各有1条重复6+5+6=17)规律:化合可溶碱水可溶金属氧化物碱氧金属氧化物金属点⎭⎬⎫→+−−→−+∆)()()2()()1(/2O))9(()()()3(/同水盐酸碱分解水难溶碱氧难溶碱高温+→++−−→−∆化合难溶酸氧除外大多数酸水酸氧酸氧非金属氧化物非金属含氧酸点⎪⎭⎪⎬⎫→+−→−+),()5()()4()(2O))9(()6(同水盐碱酸分解水酸氧酸+→++→复分解水盐碱氧酸两种新盐盐盐水盐碱酸⎪⎭⎪⎬⎫+→+→++→+)11()10()9(水盐酸氧碱+→+)12(复分解新盐新碱盐碱新盐新酸盐酸⎭⎬⎫+→++→+)14()13(置换反应新金属新盐盐金属盐酸金属⎭⎬⎫+→+↑+→+)16()15(2H碱氧酸氧含氧酸盐+→)17(高温====3CaCO ↑+2CO CaO高温====3BaCO ↑+2CO BaO以上规律的应用:① 可知某物质性质 ② 某物质制法(箭尾) (箭头指向) ③ 各类物质间相互关系从上述规律中可以总结出制盐的十种方法,包括:(2)~(16) 【典型例题】[例1] 现有石灰石、水、碳酸钠,怎样制取烧碱(不能引入其他物质),写出化学方程式。
解析:此题是物质的制备题。
在具备单质、氧化物、酸、碱、盐的相互关系,各种物质的制备规律和条件时,还要掌握酸、碱、盐的溶解性,就可以考虑解题方法了。
本题应采用倒推法,即从产品烧碱出发向原料推。
在考虑过程中应注意烧碱是一种可溶性碱,制备时应用盐+碱—新盐+新碱这一规律,此规律的条件是反应物都是可溶于水的物质且生成物必有一种物质是难溶于水时,此复分解反应才能发生,而且能把烧碱分离出来。