第一组阳离子分析
- 格式:doc
- 大小:1.05 MB
- 文档页数:8



阳离子的分离与鉴定一. 实验目的1. 掌握用两酸三碱系统分析法对常见阳离子进行分组分离的原理和方法。
2. 掌握分离、鉴定的基本操作与实验技能。
二. 实验原理阳离子的种类较多,常见的有二十多种,个别检出时,容易发生相互干扰,所以一般阳离子分析都是利用阳离子某些共同特性,先分成几组,然后再根据阳离子的个别特性加以检出。
凡能使一组阳离子在适当的反应条件下生成沉淀而与其它组阳离子分离的试剂称为组试剂,利用不同的组试剂把阳离子逐组分离再进行检出的方法叫做阳离子的系统分析。
在阳离子系统分离中利用不同的组试剂,有很多不同的分组方案。
如硫化氢分组法,两酸、两碱系统分组法。
下面介绍一种以氢氧化物酸碱性与形成配合物性质不同为基础,以HCl、H2SO4、NH3 H2O、NaOH、(NH4)2S为组试剂的两酸三碱分组方法。
本方法将常见的二十多种阳离子分为六组。
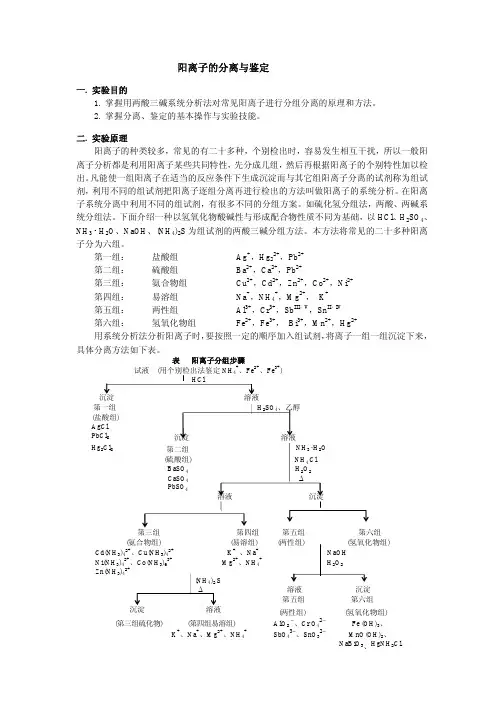
第一组:盐酸组Ag+,Hg22+,Pb2+第二组:硫酸组Ba2+,Ca2+,Pb2+第三组:氨合物组Cu2+,Cd2+,Zn2+,Co2+,Ni2+第四组:易溶组Na+,NH4+,Mg2+,K+第五组:两性组Al3+,Cr3+,Sb III、V,Sn II、IV第六组:氢氧化物组Fe2+,Fe3+, Bi3+,Mn2+,Hg2+用系统分析法分析阳离子时,要按照一定的顺序加入组试剂,将离子一组一组沉淀下来,具体分离方法如下表。
表阳离子分组步骤试液(用个别检出法鉴定NH4+、Fe2+、Fe3+)(Hg)(两性组) (氢氧化物组) (第三组硫化物) (第四组易溶组)AlO2−、Cr O42−Fe(OH)3、K+、Na+、Mg2+、NH4+SbO43−、SnO32−MnO(OH)2、NaBiO3、HgNH2Cl每组分出后,继续再进行组内分离,直至鉴定时相互不发生干扰为止。
在实际分析中,如发现某组离子整组不存在(无沉淀产生)、这组离子的分析就可省去。
从而大大简化了分析的手续。

阳离子系统分析:常见阳离子:Ag +、Hg 2+、Hg 22+、Pb 2*、Bi 3+、Cu 2+、Cd 2+、As (3 价和 5 价卜 Sb (3 价和 5 价)、Sn (2 价和 4 价)、Al 3+、Cr 3+、Fe (2 价和 3 价)、Mn 2+、Zn 2+、Co 2+、Ni 2+、Ba 2+、Ca 2+、 Mg 2+、 K +、 Na +、 NH 4+系统分析步骤: 第一组、检验铅离子、亚汞离子、银离子。
1. 加入盐酸至有 0.6mol/L -1 的氯离子剩余,补加稀硝酸至氢离子约 2.0mol/L -1,如有白色沉淀,则为氯化铅(溶解度较大,下组仍要除去铅离子)、氯化亚汞、氯化银,剩余 滤液A 用 于下组分析。
2. 验铅离子: 沉淀加水加热并趁热过滤, 加入醋酸酸化, 加入铬酸钾产生黄色沉淀铬酸铅则 有铅离子; 3. 验银离子:以上剩余沉淀用热水洗净,加入氨水,分离滤液并用硝酸酸化,滤液产生白色沉淀氯化银则有银离子; 4. 验亚汞离子:以上第 3步剩余残渣如变黑则有 Hg 22+(HgNH 2Cl+Hg )。
第二组、检验铅离子、铋离子、铜离子、镉离子、三价砷、汞离子、三价锑、四价锡。
1.往滤液A 中加入0.3mol/L -1的盐酸,通入硫化氢,加热,产生沉淀:PbS CuS HgS 均为 黑色,黑褐色Bi 2$、黄色的CdS 和SnS 、淡黄色AS 2S 3、橙红色S6S 3,剩余滤液B 用于下组 分析。
2 (铅、铋、铜、镉离子的检验)•过滤以上沉淀,加入过量硫化钠,得 沉淀A (组成有硫化 2- 3- 3-2- 铅、三硫化二铋、硫化铜、硫化镉 )和滤液C (组成有HgS -、AsS s -、SbS -、Sn S -)。
3 (铅、铋、铜、镉离子的检验)•往沉淀A 中加入6摩尔每升硝酸,沉淀溶解,在加入 1:1的甘油和过量的浓氢氧化钠,如有黄色沉淀为氢氧化镉,分离出 滤液 D 待检验,沉淀用 3 摩尔每升盐酸溶解,再稀释3倍,加入硫代乙酰胺(CHCSNH )加热,生成黄色沉淀硫化镉则有镉离子。




分析化学实验课后习题答案(第四版)篇一:分析化学实验课后习题答案(第四版)实验四铵盐中氮含量的测定(甲醛法)思考题:1.铵盐中氮的测定为何不采用NaOH直接滴定法?答:因NH4+的Ka=×10-10,其Cka0(2)V1>0 V2=0(3)V1>V2(4)V10时,组成为:HCO3- V1>0 V2=0时,组成为:OH- V1>V2时,组成为:CO32-+ OH- V113时测Ca2+对结果有何影响?答:因为滴定Ca2+、Mg2+总量时要用铬黑T作指示剂,铬黑T 在pH为8~11之间为蓝色,与金属离子形成的配合物为紫红色,终点时溶液为蓝色。
所以溶液的pH值要控制为10。
测定Ca2+时,要将溶液的pH控制至12~13,主要是让Mg2+完全生成Mg(OH)2沉淀。
以保证准确测定Ca2+的含量。
在pH为12~13间钙指示剂与Ca2+形成酒红色配合物,指示剂本身呈纯蓝色,当滴至终点时溶液为纯蓝色。
但pH>13时,指示剂本身为酒红色,而无法确定终点。
3.如果只有铬黑T指示剂,能否测定Ca2+的含量?如何测定?答:如果只有铬黑T指示剂,首先用NaOH调pH>12,使Mg2+生成沉淀与Ca2+分离,分离Mg2+后的溶液用HCl调pH=10,在加入氨性缓冲溶液。
以铬黑T为指示剂,用Mg—EDTA标准溶液滴定Ca2+的含量。
实验八铅、铋混合液中铅、铋含量的连续测定思考题:1.按本实验操作,滴定Bi3+的起始酸度是否超过滴定Bi3+的最高酸度?滴定至Bi3+的终点时,溶液中酸度为多少?此时在加入10mL200g·L-1六亚四基四胺后,溶液pH约为多少?答:按本实验操作,滴定Bi3+的起始酸度没有超过滴定Bi3+的最高酸度。
随着滴定的进行溶液pH≈1。
加入10mL200g·L-1六亚四基四胺后,溶液的pH=5~6。
2.能否取等量混合试液凉粉,一份控制pH≈滴定Bi3+,另一份控制pH为5~6滴定Bi3+、Pb2+总量?为什么?答:不能在pH为5~6时滴定Bi3+、Pb2+总量,因为当溶液的pH为5~6时,Bi3+水解,不能准确滴定。
常见阳离子的检验实验报告篇一:常见离子检验1.常见阳离子的检验检验操作1.检验溶液中含有Fe3+的实验操作:取少量溶液置于试管中,滴加几滴KSCN溶液,若溶液变红,则证明溶液中含有Fe。
2.检验溶液中含有Fe的实验操作是:取少量溶液置于试管中,滴加几滴KSCN溶液,溶液不变色,在加入几滴氯水后溶液变红,则证明溶液中含有Fe。
3.验证溶液中有铁元素的实验操作是:取少量溶液置于试管中,滴加几滴KSCN溶液,溶液不变色,在加入几滴氯水后溶液不变红,则证明溶液中不含+铁元素。
4.检验溶液中含有NH4的实验操作是:+2+2+3+取少量溶液置于试管中,加入氢氧化钠后加热,将湿润的红色石蕊试纸放在试管口,若试纸变蓝则证明溶液中含有NH4+。
5.如何检验SO42-取少量溶液置于试管中,加入盐酸无现象,在加入BaCl2溶液产生白色沉淀则证明溶液中有SO42-。
(补充:加入盐酸的作用防止Agcl 干扰) 6.如何检验Cl-取少量溶液置于试管中,加入AgNO3溶液有白色沉淀产生,再加入H NO3后沉淀不溶解则证明溶液中含有Cl-。
二、实验室常见操作1.气密性检验(1)装置形成封闭体系→操作(微热、手捂、热毛巾捂、加水等) →描述现象→得出结论; (2)微热法检查的关键词是封闭、微热、气泡、水柱; (3)液差法的关键词是封闭、形成液差。
甲①实验开始前,某同学对甲实验装置进行了气密性检查,方法是:关闭活塞,从长颈漏斗加水至浸没长颈漏斗的下端,继续加水形成一段水柱,一段时间水柱无变化则证明装置气密性良好。
①实验开始前,某同学对乙实验装置进行了气密性检查,方法是:关闭分液漏斗活塞,将导管插入水中用酒精灯微热烧瓶,导管口有气泡冒出,停止加热导管内出现一段水柱,证明气密性良好。
2.气体的收集依据:根据气体的溶解性或密度①②③④⑤⑥3.气体的净化、干燥4、尾气处理直接吸收燃烧处理袋装防倒吸吸收 ? 防倒吸装置4.溶液中晶体析出的方法:如何从NaCl溶液中得到NaCl晶体 ----------蒸发结晶如何从KNO3溶液中得到KNO3晶体 ------蒸发浓缩→冷却结晶蒸发结晶(溶解度随温度变化很小,如:NaCl)、蒸发浓缩、冷却结晶(溶解度随温度变化比较大,如:KNO3)5.沉淀的洗涤向漏斗内加蒸馏水至浸没沉淀,使水自然流出,重复操作2—3次6.中学化学常见的试纸:PH试纸、KI淀粉试纸、红色石蕊试纸、蓝色石蕊试纸①红色石蕊试纸:定性检验碱性。
实验一阳离子第一组(银组)的分析思考题:1.沉淀第一组阳离子为什么要在酸性溶液中进行?若在碱性条件下进行,将会发生什么后果?答:在系统分析中,为了防止易水解离子的水解生成沉淀而进入第一组,所以沉淀第一组阳离子时要在酸性溶液中进行。
若在碱性条件下进行,第一组以后的大部分阳离子将生成沉淀,这样就不到分离的目的。
2.向未知溶液中加入第一组组试剂HCl时,未生成沉淀,是否表示第一组阳离子都不存在?答:向未知试液中加入第一组组试剂时,未生成沉淀,只能说明Ag+,Hg22+不存在,而不能说明Pb2+不存在,因为当试液中Pb2+的浓度小于1mg•ml-1,或温度较高时,Pb2+将不在第一组沉淀,而进入第二组。
3.如果以KI代替HCl作为第一组组试剂,将产生哪些后果?答:如果以KI代替HCl作为第一组组试剂时,酸度太小,第二组易水解的阳离子将水解进入第一组,达不到分离的目的。
另外具有氧化性阳离子将与I-发生氧化还原反应,使这些离子的浓度降低不能鉴出。
实验二阳离子第二组(铜锡组)的分析思考题:1.沉淀本组硫化物时,在调节酸度上发生了偏高或偏低现象,将会引起哪些后果?答:沉淀本组硫化物,若酸度偏低时,第三组阳离子Zn2+将生成ZnS 沉淀进入第二组。
若酸度偏高时,本组的Cd2+不生成硫化物沉淀而进入第三组。
2.在本实验中为沉淀硫化物而调节酸度时,为什么先调至0.6mol·L-1HCl酸度,然后再稀释一倍,使最后的酸度为0.2 mol·L-1?答:因As(III)的硫化物完全沉淀需在0.6 mol·L-1HCl酸度下,Cd2+的硫化物完全沉淀需在0.2 mol·L-1HCl 酸度下。
因此为了使本组离子完全生成硫化物沉淀而与第三组阳离子分离,所以在调节酸度时,先调至0.6 mol·L-1HCl酸度,然后再稀释一倍,使最后的酸度为0.2 mol·L-1。
3.以TAA代替H2S作为第二组组试剂时,为什么可以不加H2O2和NH4I?答:以TAA代替H2S作为第二组组试剂时,因TAA在90℃及酸性溶液中,可在沉淀时间内将As(V)还原为As(III),故不需另加NH4I。
阳离子标准成分阳离子标准成分是用于表示水溶液中阳离子浓度的指标。
它通常以每升水溶液中离子的毫克数或每升水溶液中离子所带电荷的毫摩尔数来表示。
在环保领域,阳离子标准成分的测定对于监测水质、评估水体的污染程度以及制定相应的治理措施具有重要意义。
例如,当水体中含有过量的阳离子时,可能会引起水体的硬水问题,影响人类和生态系统的健康。
因此,了解阳离子标准成分的测定方法和意义,对于保护水环境和维护人类健康具有重要意义。
为了准确地测定阳离子标准成分,可以采用不同的分析方法,如原子吸收光谱法、离子色谱法、原子荧光法等。
这些方法各有优缺点,需要根据具体情况选择适合的方法。
例如,原子吸收光谱法具有较高的灵敏度和精度,但需要使用昂贵的仪器和专业的操作人员;离子色谱法适用于多种离子的同时测定,但需要耗费较长时间进行分析。
在实际应用中,需要根据水质的具体情况选择合适的分析方法,并注意控制实验条件,保证数据的准确性和可靠性。
除了分析方法的选择,阳离子标准成分的测定还受到多种因素的影响。
例如,水样的采集和保存方式、试剂的纯度、实验操作条件等都可能影响测定结果的准确性。
因此,在测定阳离子标准成分时,需要严格按照相关标准操作规范进行操作,并注意控制实验条件,确保数据的准确性和可靠性。
此外,阳离子标准成分的测定结果还需要进行合理的解释和应用。
根据测定结果,可以评估水体的污染程度和潜在的环境风险,为制定相应的治理措施提供科学依据。
同时,还可以结合其他水质指标进行综合分析,全面了解水体的质量和变化趋势,为水环境保护和可持续发展提供有力支持。
总之,阳离子标准成分的测定是水环境监测中的重要组成部分。
通过选择合适的分析方法、控制实验条件和合理解释应用测定结果,可以更好地了解水质状况,为水环境保护和可持续发展做出贡献。
同时,还需要加强相关研究工作,不断完善阳离子标准成分的测定技术和方法,提高监测数据的准确性和可靠性,为水环境的保护和治理提供更加科学和有力的支持。
阳离子价态表阳离子价态表是化学中用于描述元素或化合物的阳离子价态的一种工具。
通过该表可以清晰地了解元素的化学性质和反应能力。
下面将以人类的视角,逐个元素地进行描述。
我们来看一下氢元素。
氢是最简单的元素之一,它的阳离子价态为+1。
氢是宇宙中最常见的元素之一,它在自然界中主要以气体的形式存在。
氢的主要化学性质是与氧、氮等元素形成化合物,如水和氨气。
接下来,我们来看一下氧元素。
氧的阳离子价态为-2。
氧是地球上最常见的元素之一,也是气体、液体和固体中最常见的元素之一。
氧在自然界中主要以气体的形式存在,它是维持生命的必需气体之一。
氧的主要化学性质是与氢、碳等元素形成化合物,如水和二氧化碳。
再来看一下碳元素。
碳的阳离子价态为+4。
碳是地球上最常见的元素之一,也是生命的基础。
碳在自然界中主要以固体的形式存在,它可以形成很多不同的化合物,如有机化合物和无机化合物。
碳的主要化学性质是与氧、氢等元素形成化合物,如二氧化碳和甲烷。
接下来,我们来看一下铁元素。
铁的阳离子价态可以是+2或+3。
铁是地球上最常见的金属之一,它在自然界中主要以固体的形式存在。
铁的主要化学性质是与氧、硫等元素形成化合物,如氧化铁和硫化铁。
铁还可以形成很多重要的合金,如钢。
我们来看一下氯元素。
氯的阳离子价态为-1。
氯是地球上最常见的卤素之一,它在自然界中主要以气体的形式存在。
氯的主要化学性质是与钠、钾等金属形成化合物,如氯化钠和氯化钾。
氯还是一种常用的消毒剂,可以杀灭细菌和病毒。
通过以上的描述,我们可以清晰地了解各个元素的阳离子价态和一些基本的化学性质。
阳离子价态表对于理解元素的化学性质和反应能力非常重要,它为化学研究提供了重要的参考依据。
希望通过这份创作,读者们能够更加深入地了解阳离子价态表的作用和意义。
第三章阳离子分析
教学要求:1、常见阳离子有哪些?分析特性如何?
2、了解两酸两碱系统分析方案
3、掌握硫化氢系统分析方案(第一组是基础,第二组是重点)
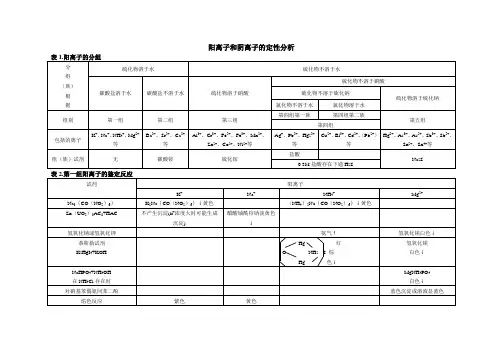
第一节常见阳离子的分组
在湿法分析中,直接检出的是溶液中的离子。
常见阳离子有23种元素、25种离子。
它2+、Pb2+、Pb2+、Bi3+、Cu2+、Cd2+、Hg2+、As(Ⅲ、Ⅴ)、Sb(Ⅲ、Ⅴ)、Sn(Ⅱ、Ⅳ)、们是:Ag+、Hg
2
Al3+、Cr3+、Fe3+、Fe2+、Mn2+、Zn2+、Co2+、Ni2+、Ba2+、Sr2+、Ca2+、Mg2+、K+、Na+、和NH4+。
分组是按一定的顺序加入若干种试剂,将离子一组组沉淀出来。
用于将各组离子分离开的试剂被称为组试剂。
(组试剂的条件与作用)
这些阳离子的盐酸盐、硫酸盐、硫酸盐、硫化物、氢氧化物的溶解性是不同;硫化物的酸碱性也不相同;氢氧化物两性也不相同;与氨的络合性也不相同;部分离子氧化性也不相同。
这些相似与不同,为常见阳离子的分组和分离提供了基础。
对这些离子的分组,目前比较常见的有两种方案。
一、两酸两碱系统分组方案
分别利用盐酸、硫酸、氨水和氢氧化钠(故称为两酸两碱)为组试剂,将前述常见阳离子分为五组,如表所示。
表两酸两碱系统分组方案
4
条件不好掌握,易受污染等缺点。
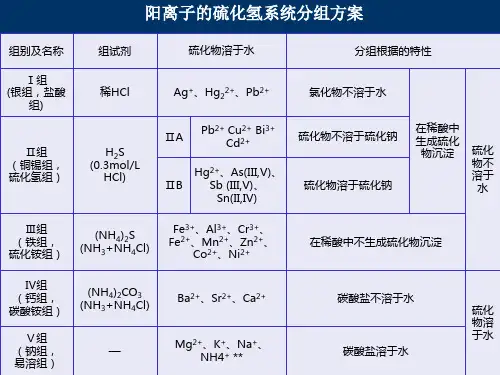
二、硫化氢系统分组方案
硫化氢系统分组方案所依据的主要事实,就是各离子硫化物溶解度有明显的不同,以及根据离子的其它性质,将常见阳离子分成五组,现简化为四组(将钙、钠组合并)。
表2-1 简化的硫化氢系统分组方案
硫化氢系统的好处是分组均匀,合理。
该方案从提出到现在已有二百多年的历史,经过不
断的改进,目前已成为最完善、应用最为广泛的一种分析方案,是阳离子定性分析中的首选方案,也是我们今后要学习的内容。
但该方案也存在控制麻烦,毒性较大的缺点。
Sr 2+
碳酸盐不溶于水
碳酸盐溶于水 IV 组 碳酸铵组 V 组 钠组 NH 3+NH 4Cl
(NH 4)2CO 3
组
第二节 第一组阳离子的分析
一、本组离子的分析特性
本组包括Ag +、Hg 22+和Pb 2+三种离子,称为银组。
它们的共同特点是氯化物不溶于水,都能与盐酸作用生成氯化物沉淀,在系统分析中首先从试液中被分离出来,所以按顺序称为第一组,所用组试剂为盐酸,称为盐酸组。
1.离子的存在形式
本组三种离子都无色。
其中银和铅主要以简单的Ag +
、Pb 2+
形式存在,亚汞离子是以共价键结合的双聚离子Hg +:Hg +存在,记为Hg 22+,写的时候不能写做Hg +。
两个汞离子间的键并不牢固,在水溶液中存在这样的平衡:
+
Hg
22+
Hg
2+
Hg
平衡常数
K =[Hg 2+][Hg 22+]1
166= 当在水溶液中加入能与Hg 2+生成难溶化合物或络合物的试剂时,则平衡向右移动,生成二价汞的化合物和黑色的金属汞。
(歧化反应:同一个元素中,一部分氧化,另一部分还原)
如:+
Hg 2
2+
Hg
H 2S
HgS
+2H ++
另一方面,亚汞化合物自身也不稳定,易发生歧化反应
NaOH
Hg
2(OH)
2O
HgO
+
Hg 22+Hg +-H 2O
2.难溶化合物
能生成卤化物、氰化物、碳酸盐、硫酸盐、磷酸盐、铬酸盐等难溶化合物。
Ag 2S 、PbS 黑色,不溶于盐酸,溶于硝酸;Hg 2CrO 4红褐色,相对稳定,不溶于NaOH 和稀HNO 3;AgI 黄色,不溶于氨水,用于Ag +鉴定;Ag 2CrO 4砖红色,PbCrO 4黄色;PbI 2溶于热水,冷却后析出非常漂亮的金黄色结晶,也可以用于Pb 2+鉴定
3.络合物
本组中Ag +具有较强的络合能力。
常见的有:Ag(NH 3)2+、Ag(CN)2-、Ag(S 2O 3)23-;Pb 2+络合能力较差,常见的是醋酸络合物Pb(Ac)42-,可用于PbSO 4与BaSO 4沉淀的分离(浓NaOH 亦可);Hg 22+在络合剂作用下,往往发生歧化反应而生成Hg 2+的配位化合物,因此,本身没有什么络合物。
二、组试剂的作用与分离条件
本组离子的组试剂为HCl,它在沉淀过程中起到三个作用:1.沉淀剂
本组离子与组试剂盐酸的反应为:
Ag++Cl-=AgCl↓(白色凝乳状,遇光变紫、变黑)
Hg
22++2Cl-=Hg
2
Cl
2
↓(白色粉末状)
Pb2++2Cl-=PbCl
2
↓(白色针状或片状结晶)
与其它组离子分离。
对这三种沉淀来说,AgCl和Hg
2Cl
2
溶解度都很小,但PbCl
2
的溶解度
就大得多,并随着温度的升高而显著增大,为了减少沉淀的溶解度,在沉淀过程中,根据同离子效应,加入过量的盐酸对减小沉淀的溶解度是有利的。
但沉淀剂也不可过量太多,以免
高浓度的Cl-与沉淀物发生络合反应,生成AgCl
2-和HgCl
4
2-等,此外还有盐效应的影响,致使
沉淀的溶解度增大。
实验结果表明沉淀本组离子时,Cl-的浓度以0.5mol·L-1为宜。
在这个条件下,Ag+、Hg
2
2+都能沉淀完全,但Pb2+还不能沉淀完全,部分进到第二组中去。
因此,向未知
试液中加入第一组组试剂时,未生成沉淀,只能说明Ag+,Hg
2
2+不存在,而不能说明Pb2+不存在,因为当试液中Pb2+的浓度小于1mg•ml-1,或温度较高时,Pb2+将不在第一组沉淀,而进入第二组。
只有在第二组鉴定中,进一步确定Pb2+是否存在。
2.提供H+,保持溶液的酸度足够大,防止Bi3+、Sb3+的水解在第二组离子中,Bi3+、Sb3+有较强的水解倾向,当溶液酸度不够高(小于1.2-1.5mol·L-1)时,它们会生成白色的碱式盐沉淀(BiOCl↓、SbOCl↓)而混入第一组中。
为了避免发生此种情况,应使溶液中H+的浓度达到2.0-2.4mol·L-1,有时,Cl-浓度已达到0.5mol·L-1,但酸度不够时,
可补加适量HNO
3
达到目的。
3.防止生成胶体沉淀
氯化银容易生成胶体沉淀,使沉淀难以分离,加入适当过量的HCl,起到电解质的作用,促使胶体凝聚。
综上所述,使本组离子的沉淀条件是:在室温下的酸性溶液中(补充适量HNO
3
)加入适当过量的6mol·L-1HCl溶液,使沉淀完全后,Cl-的浓度为0.5mol·L-1,溶液的酸度为2.0-2.4mol·L-1。
此时如有白色沉淀生成,表明有本组离子存在。
离心管以流水冷却后离心沉降,沉淀经1mol·L-1HCl溶液洗涤后作本组离子的分析;离心液在系统分析中留作后面几组阳离子的定性分析用。
三、本组离子的系统分析
1.Pb2+的分离和鉴定
在本组离子的氯化物沉淀中加水并用水浴加热,使PbCl
2
溶解于热水之中。
趁热分离,以
HAc酸化离心液,加入K
2CrO
4
试剂鉴定,如析出黄色沉淀(PbCrO
4
),表示有Pb2+存在。
M=0.25μg时ρ
B
=5μg·ml-1
2.Ag+与Hg22+的分离及Hg22+的鉴定
分出PbCl
2后的沉淀以热水洗涤干净,然后加入氨水搅拌。
此时AgCl溶解生成Ag(NH
3
)
2
+,
Hg
2Cl
2
与氨水作用将生成HgNH
2
Cl+Hg,残渣变灰黑表示有Hg
2
2+存在。
M=10μg ρB =200μg·mL-1
3.Ag+的鉴定
将步骤2中分出的氨性溶液用HNO
3
酸化,如重新得到白色沉淀,说明有Ag+存在。
M=0.5μg ρ
B
=10μg·mL-1
也可以在银氨溶液中加KI溶液,如出现AgI↓(黄),说明有Ag+存在。