阳离子分析方法
- 格式:ppt
- 大小:1.38 MB
- 文档页数:68



阴阳离子的鉴定
阴离子和阳离子是化学中离子的两种基本类型。
阴离子带有负电荷,而阳离子带有正电荷。
在化学分析中,可以通过不同的实验方法来鉴定阴离子和阳离子。
阳离子的鉴定方法:
1.火焰试验:将待鉴定物质放入火焰中,观察火焰的颜色。
不同的阳离子会产生不同颜色的火焰。
例如,钠离子会产生黄色火焰,钾离子会产生紫色火焰。
2.沉淀反应:使用适当的反应剂,观察是否生成可沉淀的产物。
例如,钡离子通常通过加入硫酸钡溶液来鉴定,生成白色沉淀(硫酸钡)。
阴离子的鉴定方法:
1.沉淀反应:使用适当的反应剂,观察是否生成可沉淀的产物。
例如,氯离子可以通过加入银离子(硝酸银溶液)来鉴定,生成白色沉淀(氯化银)。
2.气体的鉴定:一些气体可以用来鉴定特定的阴离子。
例如,二氧化硫气体可以用于检测硫离子。
3.酸碱中性化反应:使用适当的酸或碱与待鉴定物质反应,观察是否发生中性化反应。
例如,用氢氧化钠溶液可以鉴定酸性溶液中的氢离子。
在实验室中,这些方法通常结合使用,以确保对离子的准确鉴定。
通过观察沉淀、颜色变化和气体产生等现象,可以得出关于阳离子和阴离子的信息。

阳离子系统分析:常见阳离子:Ag +、Hg 2+、Hg 22+、Pb 2*、Bi 3+、Cu 2+、Cd 2+、As (3 价和 5 价卜 Sb (3 价和 5 价)、Sn (2 价和 4 价)、Al 3+、Cr 3+、Fe (2 价和 3 价)、Mn 2+、Zn 2+、Co 2+、Ni 2+、Ba 2+、Ca 2+、 Mg 2+、 K +、 Na +、 NH 4+系统分析步骤: 第一组、检验铅离子、亚汞离子、银离子。
1. 加入盐酸至有 0.6mol/L -1 的氯离子剩余,补加稀硝酸至氢离子约 2.0mol/L -1,如有白色沉淀,则为氯化铅(溶解度较大,下组仍要除去铅离子)、氯化亚汞、氯化银,剩余 滤液A 用 于下组分析。
2. 验铅离子: 沉淀加水加热并趁热过滤, 加入醋酸酸化, 加入铬酸钾产生黄色沉淀铬酸铅则 有铅离子; 3. 验银离子:以上剩余沉淀用热水洗净,加入氨水,分离滤液并用硝酸酸化,滤液产生白色沉淀氯化银则有银离子; 4. 验亚汞离子:以上第 3步剩余残渣如变黑则有 Hg 22+(HgNH 2Cl+Hg )。
第二组、检验铅离子、铋离子、铜离子、镉离子、三价砷、汞离子、三价锑、四价锡。
1.往滤液A 中加入0.3mol/L -1的盐酸,通入硫化氢,加热,产生沉淀:PbS CuS HgS 均为 黑色,黑褐色Bi 2$、黄色的CdS 和SnS 、淡黄色AS 2S 3、橙红色S6S 3,剩余滤液B 用于下组 分析。
2 (铅、铋、铜、镉离子的检验)•过滤以上沉淀,加入过量硫化钠,得 沉淀A (组成有硫化 2- 3- 3-2- 铅、三硫化二铋、硫化铜、硫化镉 )和滤液C (组成有HgS -、AsS s -、SbS -、Sn S -)。
3 (铅、铋、铜、镉离子的检验)•往沉淀A 中加入6摩尔每升硝酸,沉淀溶解,在加入 1:1的甘油和过量的浓氢氧化钠,如有黄色沉淀为氢氧化镉,分离出 滤液 D 待检验,沉淀用 3 摩尔每升盐酸溶解,再稀释3倍,加入硫代乙酰胺(CHCSNH )加热,生成黄色沉淀硫化镉则有镉离子。
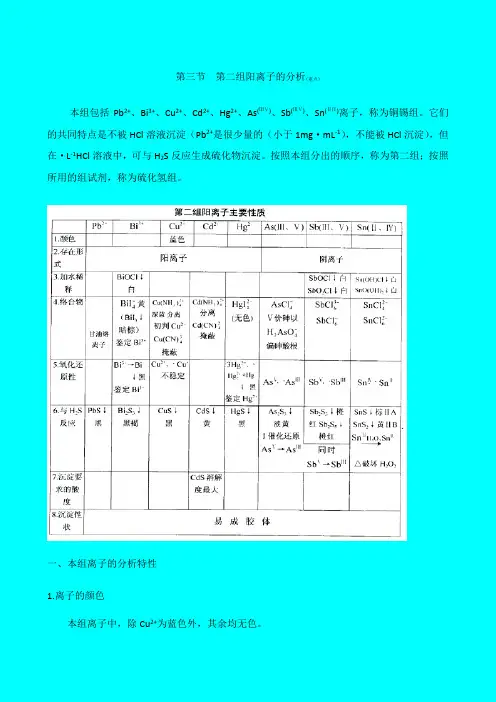
第三节第二组阳离子的分析(重点)本组包括Pb2+、Bi3+、Cu2+、Cd2+、Hg2+、As(ⅢⅤ)、Sb(ⅢⅤ)、Sn(ⅡⅣ)离子,称为铜锡组。
它们的共同特点是不被HCl溶液沉淀(Pb2+是很少量的(小于1mg·mL-1),不能被HCl沉淀),但在·L-1HCl溶液中,可与H2S反应生成硫化物沉淀。
按照本组分出的顺序,称为第二组;按照所用的组试剂,称为硫化氢组。
一、本组离子的分析特性1.离子的颜色本组离子中,除Cu2+为蓝色外,其余均无色。
2.离子的存在形式铅、铋、铜、镉、汞具有显著的金属性质,在水溶液中主要以金属阳离子的形式存在;而砷、锑、锡三种元素则表现出不同程度的非金属性质,它们在溶液中的主要存在形式随酸碱环境而不同,主要以阴离子形式存在于溶液中。
但由于存在下述平衡AsO33-+6H+=As3++3H2OSbCl63-= Sb3++ 6C1-SnCl42-=Sn2++4Cl-溶液中也或多或少地存在着简单阳离子,并能生成相应的硫化物(如SnS2、As2S3等),所以这些元素还是作为阳离子来研究。
鉴定时并不严格区分它们的存在形式,只是泛指该元素,书写时只标出其氧化数,而不具体指明其存在形式。
3.加水稀释Bi3+、Sb(ⅢⅤ)、Sn(ⅡⅣ)离子(见前表)4.络合物本组离子一般都能生成多种络合物。
其中最常见的是氯络离子,因而大量Cl-存在时可影响到各简单离子的浓度。
另外,Cu2+、Cd2+等能生成氨或氰络离子:Cu(NH3)42+、Cd(NH3)42+、Cu(CN)42+、Cd(CN)42+,它们在Cu2+、Cd2+的分离和鉴定上有很多应用。
Bi3+与I-生成黄色的BiI4-;用于铋的鉴定。
Cu2+、Pb2+和Bi3+能与甘油生成络离子;Hg2+与I-生成无色的HgI42-,它与KOH 一起的溶液,可用于NH4+的鉴定,称为奈氏试剂。
这些都具有一定的分析应用价值。
5.氧化还原性质砷、锑、锡三元素的离子具有两种比较稳定的价态,它们在分析上都具有重要的意义。

常见阳离子和阴离子定性或定量分析方法汇总1、铵离子氨氮(纳氏试剂分光光度法)操作要点:试样中性(氢氧化钠+盐酸)+酒石酸钾钠(消除钙镁影响)+纳氏试剂(420nm淡红棕色络合物)氨氮(甲醛快速法)操作要点:试样酚酞红色(氢氧化钠+盐酸)+甲醛(5ml)+氢氧化钠酚酞红色(酸性六次甲基四胺)2、铁离子铁离子Ⅲ(菲啰啉分光光度法)操作要点:试样酸性(PH=2指示剂对硝基酚无色+盐酸)+抗坏血酸或盐酸羟胺(铁离子Ⅱ)+缓冲溶液(乙酸-乙酸钠)+菲啰啉显色剂(510nm橙红色络合物)铁离子Ⅱ(高锰酸钾氧化法+氢氧化钠)操作要点:①试样弱酸性+高锰酸钾溶液(紫色)+二价锰离子(溶液褪色)②试样弱酸性+氢氧化钠(白色沉淀Fe2++2OH-=Fe(OH)2-灰绿色沉淀-红褐色沉淀4Fe(OH)2+O2+2H2O=4Fe(OH)3)3、铜离子铜离子(二乙基二硫代氨基甲酸钠分光光度法或直接光度法)操作要点:试样酸化(1000ml试样+硝酸2ml)+乙二胺四乙酸二钠盐、柠檬酸铵(掩蔽铁钴镍锰)+氨-氯化铵缓冲溶液(PH=9)+淀粉稳定剂(5g/l)+二乙基二硫代氨基甲酸钠显色剂(460nm黄棕色络合物)4、钙镁离子(总硬度)操作要点:试样中性(盐酸+氢氧化钠)+三乙醇胺(掩蔽铁铝铜锰等)+氨-氯化铵缓冲溶液(PH=10)+铬黑T指示剂+乙二胺四乙酸二钠滴定剂(指示剂由酒红色至纯蓝色)5、钙离子操作要点:试样中性(盐酸+氢氧化钠)+盐酸煮沸(消除重碳酸根、磷酸根等)+三乙醇胺(掩蔽铁铝铜锰等)+氢氧化钾(PH=12-13)+钙-羧酸指示剂+乙二胺四乙酸二钠滴定剂(指示剂由紫红色至亮绿色)6、氯离子(银量法)操作要点:①试样中性或弱碱性+硝酸、氢氧化钠(酚酞微红PH=6.5-10.5)+铬酸钾指示剂+硝酸银滴定剂(判断是否出现砖红色沉淀)②试样酸性+硝酸(酚酞至过量硝酸)+硝酸铁显色剂+硫氰酸汞(硫氰酸汞过量显红色)③试样酸性+硝酸(溴酚蓝指示剂由蓝显黄)+二苯偶氮碳酰肼指示剂+硝酸汞(硝酸汞过量显紫红色)④试样酸性+硝酸(PH≤1)+硝酸银(过量)+铁铵矾指示剂(硫酸铁铵)+硫氰酸铵(硫氰酸铵过量由乳白色显浅橙色或红色)7、硫酸根离子(重量法或目视比浊法)操作要点:①试样+盐酸1+1酸化(消除碳酸根、亚硫酸根离子和银离子)+氯化钡(100g/l)(判断是否出现硫酸钡白色沉淀)8、碳酸根离子操作要点:①试样+盐酸(有气泡产生)+捕集气体通入澄清石灰水(氢氧化钙)(出现白色沉淀)②试样+氯化钡(100g/l、出现白色沉淀)+盐酸(白色沉淀消失且有气泡产生)9、亚硫酸根离子(碘酸钾和碘化钾氧化法)操作要点:①试样+盐酸+碘酸钾、碘化钾或碘(碘褪色证明有亚硫酸根存在)②试样+硝酸钡(100g/l)(出现白色沉淀)+硝酸(白色沉淀不消失,证明存在亚硫酸根)10、硫离子(容量法或目视比浊法)操作要点:①试样+碳酸钠和氯化镉(硫化镉吸收剂)+碘(氧化物)+盐酸(酸性)+硫代硫酸钠(碘化镉试液浊白)②试样+酸化(盐酸)+碱式铅酸钾(醋酸铅+氢氧化钾)+与硫化氢标准使用液目视比浊③试样+盐酸(煮沸)+捕集气体+乙酸铅试纸(黑色)④试样+氢氧化钠+双氧水或高锰酸钾(析出单质硫)。

分析化学Analytical chemistry——阳离子的鉴定实验-The cation authenticates an experiment班级:050911学号:05姓名:赵冬儿分析化学实验方案一、观察溶液颜色及其沉淀情况二、测定溶液酸碱性三、溶液分成四份后做检验(一)、取一份试液做初步试验a、检NH4+取2个表面皿,在上表面皿中贴湿润的红色石蕊试纸,在下表面皿中滴入试液,并在两夹缝中滴加碱,加热后,若试纸变蓝则表明NH4+存在。
b、检Fe2+(1)K3Fe(CN)6试法在点滴板上放试液1滴,加3 mol/L溶液1滴,K3Fe(CN)61滴,生成深蓝色KFe[Fe(CN)6]沉淀,示有Fe2+。
(2)邻二氮菲试法在点滴板上放1滴试液,加3 mol/L HCl 1滴,邻二氮菲试剂1滴,溶液如显红色,示有Fe2+存在。
c、检Fe3+(1)NH4SCN试法在点滴板上放1滴试液,NH4SCN 1滴,0.1 mol/L HCl 1滴,溶液显红色,示有Fe3+。
同时做空白实验1 份,与此做对比。
(2)K4Fe(CN)6试法在点滴板上放试液1滴,加3 mol/L HCl 1滴,K4Fe(CN)61滴,生成深蓝色KFe[Fe(CN)6]沉淀,示有Fe3+。
离子未知试液的分析实验报告一、实验药品与仪器药品:6mol/LNaOH 、邻二氮菲、K3Fe(CN)6 、NH4SCN 、HCl(8mol/L 、6mol/L 、3mol/L 、1mol/L 、0.6mol/L ) 、K2CrO4、K4Fe(CN)6 、 6 mol/L HNO3、3mol/L HNO3、6mol/L HAc 、浓HAc 、6 mol/L NH3·H2O、SnCl2溶液、浓HCl 、NH4Cl 、120g/L(NH4)2CO3 、TAA、铝片、HgCl2溶液、K2CrO4、H2O2、NaBiO3固体、戊醇、Na2HPO4试剂、丁二酮肟、玫瑰红酸钠试剂、NaAc、(NH4)2C2O4、醋酸铀酰锌试剂、KClO3固体、镁试剂、Na3Co(NO2)6 、甘油溶液、四苯硼化钠、锡箔、镁试剂、乙醇仪器:电炉、离心机、离心管、坩埚、表面皿、滤纸、黑白点滴板、红色石蕊试纸、PH试纸、玻璃棒二、实验步骤(一)、观察溶液颜色及其沉淀情况溶液颜色:紫红色;沉淀情况:白色沉淀;(二)、测定溶液酸碱性PH=1.0呈酸性(三)、溶液分成四份后做初步检验a、检NH4+取2个表面皿,在上表面皿中贴湿润的红色石蕊试纸,在下表面皿中滴入试液,并在两夹缝中滴加碱,加热后,若试纸变蓝则表明NH4+存在。

水处理之水中阳离子的分析
工业用水中的阳离子主要有钾、钠、钙、镁、铁、铝、锌、铜离子等。
这些离子常用的测定方法包括:火焰光度法测定钾、钠离子,EDTA配合滴定法测定钙、镁、锌等离子,分光光度法测定铁、铝、铜等离子。
1.钾离子的测定
1)原理
钾的化合物在高温火焰中能发射出波长为766.5nm的特征谱线。
把水样喷人稳定的火焰中,用滤光片把766.5nm的光分离出来,使光电管产生光电流,用检流计检测光谱强度。
在一定浓度范围内光谱强度与水样中钾的含景成正比。
为了抑制钾原子在火焰中的离子化,可使用氯化铯溶液作为电离缓冲剂。
碱土金属对测定有干扰,可加人浓度为250g/L的硝酸铝溶液抑制。
2)主要试剂与仪器
(1)钾离子标准溶液。
称取l05°C〜110°C下烘至恒重的高纯氯化钾 1.907g,精确至0.0002g。
放人100mL烧杯中,加20mL蒸馏水,溶解后转移至1000mL容量瓶中,用蒸馏水稀释至刻度,摇匀备用,此溶液1.00ml含钾离子1.00mg。
移取上述钾离子溶液5.00mL于100mL容量瓶中,加蒸馏水稀释至刻度,此溶液1.00mL 含钾离子0.05mg。
(2)氯化铯溶液。
称取126g氯化铯(CsCl)放入200mL烧杯中,加人50mL蒸馏水,再加人1+1盐酸40mL,溶解后转移至1000mL容量瓶中,用蒸馏水稀释至刻度,摇匀。
(3)火焰光度计。


阳离子的鉴定实验报告一、实验目的本实验旨在通过阳离子的鉴定实验,掌握化学分析方法和技能,了解阳离子的性质和特点,提高化学实验操作能力。
二、实验原理阳离子是指带正电荷的离子,通常是金属离子。
在化学分析中,可以通过一系列的反应和试剂来鉴定阳离子的存在。
常用的鉴定方法包括沉淀法、络合滴定法、氧化还原滴定法等。
三、实验步骤1. 沉淀法鉴定铁离子:取待测溶液10ml,加入氢氧化钠溶液至碱性,再加入硝酸铵溶液和硫代硫酸钠溶液,出现棕色沉淀即可证明存在铁离子。
2. 离子交换法分离钙镁:将待测溶液10ml加入小型树脂柱中,并以去离子水洗涤至无色流出。
然后用0.1mol/L盐酸洗脱,并收集洗脱液进行下一步实验。
3. 络合滴定法测定镍含量:将上述洗脱液10ml加入酸性介质中,加入二乙二胺四乙酸(NTA)络合剂,再以EDTA标准溶液滴定至紫色终点,计算出镍含量。
四、实验结果分析1. 沉淀法鉴定铁离子:添加试剂后出现棕色沉淀,说明待测溶液中存在铁离子。
2. 离子交换法分离钙镁:经过树脂柱处理后,得到的洗脱液中只有钙和镁离子。
通过该方法可以有效地分离和富集目标离子。
3. 络合滴定法测定镍含量:经过络合滴定反应后,得到的终点为紫色。
根据计算可知,待测溶液中镍的含量为0.024mol/L。
五、实验注意事项1. 实验操作时要严格按照实验步骤进行,并注意安全。
2. 试剂要精确称取,并严格控制反应条件。
3. 实验设备要干净整洁,并做好消毒和清洗工作。
六、实验总结通过本次阳离子的鉴定实验,我们学习了化学分析方法和技能,掌握了阳离子的性质和特点,提高了化学实验操作能力。
同时,我们也深刻认识到实验操作的重要性和注意事项,加强了实验安全意识。
阳离子系统分析:常见阳离子:Ag+、Hg2+、Hg22+、Pb2+、Bi3+、Cu2+、Cd2+、As(3价和5价)、Sb(3价和5价)、Sn(2价和4价)、Al3+、Cr3+、Fe(2价和3价)、Mn2+、Zn2+、Co2+、Ni2+、Ba2+、Ca2+、Mg2+、K+、Na+、NH4+系统分析步骤:第一组、检验铅离子、亚汞离子、银离子。
1.加入盐酸至有0.6mol/L-1的氯离子剩余,补加稀硝酸至氢离子约2.0mol/L-1,如有白色沉淀,则为氯化铅(溶解度较大,下组仍要除去铅离子)、氯化亚汞、氯化银,剩余滤液A用于下组分析。
2.验铅离子:沉淀加水加热并趁热过滤,加入醋酸酸化,加入铬酸钾产生黄色沉淀铬酸铅则有铅离子;3.验银离子:以上剩余沉淀用热水洗净,加入氨水,分离滤液并用硝酸酸化,滤液产生白色沉淀氯化银则有银离子;4.验亚汞离子:以上第3步剩余残渣如变黑则有Hg22+(HgNH2Cl+Hg)。
第二组、检验铅离子、铋离子、铜离子、镉离子、三价砷、汞离子、三价锑、四价锡。
1.往滤液A中加入0.3mol/L-1的盐酸,通入硫化氢,加热,产生沉淀:PbS、CuS、HgS均为黑色,黑褐色Bi2S3、黄色的CdS和SnS2、淡黄色As2S3、橙红色Sb2S3,剩余滤液B用于下组分析。
2(铅、铋、铜、镉离子的检验).过滤以上沉淀,加入过量硫化钠,得沉淀A(组成有硫化铅、三硫化二铋、硫化铜、硫化镉)和滤液C(组成有HgS22-、AsS33-、SbS33-、SnS32-)。
3(铅、铋、铜、镉离子的检验).往沉淀A中加入6摩尔每升硝酸,沉淀溶解,在加入1:1的甘油和过量的浓氢氧化钠,如有黄色沉淀为氢氧化镉,分离出滤液D待检验,沉淀用3摩尔每升盐酸溶解,再稀释3倍,加入硫代乙酰胺(CH3CSNH2)加热,生成黄色沉淀硫化镉则有镉离子。
4(铅、铋、铜、镉离子的检验).滤液D加入醋酸酸化,再加亚铁氰化钾变红棕色(Cu2Fe (CN)6)则有铜离子。
阳离子分析方法1 pH值的测定——酸度计法1.1 适用范围本方法适用于脱盐水、天然水、锅炉给水、炉水、蒸汽、冷凝液、循环冷却水、污水等水样PH值的测定。
1.2 分析原理在一定条件下,复合电极的电动势(ε)与被测溶液pH值成线性关系:ε=K+0.059pH (25℃)可见,由测得的电动势(ε)就能求出被测液的pH值。
1.3 试剂和仪器1.3.1 试剂1.3.1.1 重蒸馏水1.3.1.2 pH标准缓冲溶液(1)配制见表2-1表2-1 pH值标准缓冲溶液的配制(2)说明:① KHC8H4O4、KH2PO4和Na2HPO4应事先于110℃干燥2h。
②可用市售的经计量单位鉴定合格的袋装pH值标准缓冲溶液的固体粉末直接配制。
③配好的pH标准缓冲溶液应贮存于聚乙烯塑料瓶中,用后盖严,有效期二个月。
④ pH标准缓冲溶液的pH值随温度而变,不同温度下标准缓冲溶液的pH值见表2-2 。
表2-2 不同温度下pH标准缓冲溶液的PH值1.3.2 仪器1.3.2.1 PXS-215型酸度计(测量范围:0~14.00pH;读数精度:0.01pH)。
1.3.2.2 复合电极。
1.3.2.3 温度计(测量范围0℃~100℃)。
1.3.2.4 塑料烧杯(100mL)1.4 分析步骤1.4.1 电极的准备第一次使用的复合电极或长期停用的复合电极,在使用前必须在3mol/L氯化钾溶液中浸泡24h以上。
1.4.2 仪器的标定仪器开启30min后,按《仪器分析规程》中的规定,进行温度补偿和标定操作。
1.4.3 水样的测定将塑料烧杯及电极用蒸馏水洗净后,再用被测水样冲冼2次以上。
然后,将上述电极插入水样中,摇动烧杯,使水样均匀,待读数稳定后,读出水样的pH 值。
1.5 注意事项1.5.1 复合电极在初次使用或久置不用后重新使用前,应将电极在3mol/L氯化钾溶液中浸泡24h以上;1.5.2 测量后,及时将电极插入电极套内,电极套内应放少量外参比补充液(3mol/L氯化钾)以保证电极球泡的湿润,或置于3mol/L氯化钾中。
检验阳离子的操作方法阳离子检验是一种常用的化学分析方法,用于确定一个物质中阳离子的存在和浓度。
阳离子通常是带正电荷的离子,在化学反应中起重要的作用。
正确的阳离子检验方法对于各种化学实验和分析都非常重要。
本文将介绍一些常见的阳离子检验操作方法。
首先,一个常用的阳离子检验方法是使用沉淀反应。
在这种方法中,首先将待检测的物质与特定试剂混合,观察是否会产生沉淀。
根据不同的阳离子,可以使用不同的试剂来进行检验。
以银离子为例,我们可以使用硝酸银试剂进行检验。
首先,取一小部分待检测物质溶解于水中。
然后,将硝酸银试剂滴加到试管中,如果溶液中存在银离子,就会形成白色的沉淀。
这是因为硝酸银试剂与银离子反应生成不溶性的白色沉淀物。
类似地,我们可以使用其他试剂来检验不同的阳离子。
例如,Cu2+可以使用氨水来检验。
将待检测物溶解于水中,然后加入少量氨水。
如果溶液中存在Cu2+,就会产生深蓝色的沉淀。
这是因为氨水与铜离子反应生成不溶性的深蓝色沉淀物。
除了沉淀反应,还有一些其他的方法可以用于阳离子检验。
例如,我们可以使用火焰试验来检验钠离子。
将待检测物溶解于水中,然后将溶液吹到火焰上。
如果溶液中存在钠离子,火焰就会变成明亮的黄色。
另外,也可以使用复合物反应来检验一些金属离子。
复合物反应是指将金属离子与某些有机配体结合形成稳定的金属络合物。
这些络合物通常具有比较明显的颜色变化,可以用于检验特定的金属阳离子。
举个例子,我们可以使用硫氰酸根离子(SCN^-)试剂来检验Fe3+。
首先,将待检测物溶解于水中。
然后,加入几滴硫氰酸盐试剂。
如果溶液中存在Fe3+,就会形成鲜红色的络合物。
此外,还有一些仪器方法可以用于阳离子检验。
例如,光谱分析方法可以通过分析物质吸收或发射的特定波长来确定阳离子的存在和浓度。
原子吸收光谱(AAS)和电感耦合等离子体质谱(ICP-MS)是常用的光谱分析技术,可用于快速和准确地测定各种阳离子。
综上所述,阳离子检验是一种常用的化学分析方法,用于确定物质中阳离子的存在和浓度。
阳离子离子色谱法
阳离子离子色谱法是一种常用的分离和定量分析阳离子的方法。
它基于溶液中阳离子与固定于色谱柱填料上的阴离子交换反应的原理进行分离。
在阳离子离子色谱法中,通常采用阴离子交换色谱柱作为固定相。
色谱柱填料上带有反离子簇,如硅酸树脂等。
样品溶液经过色谱柱时,柱填料上的阴离子与阳离子发生络合反应,将阳离子吸附在固定相上,进而分离不同的阳离子。
为了进行定量分析,通常使用离子色谱仪进行检测。
离子色谱仪通过检测阳离子在柱填料上的吸附和洗脱过程中产生的电流信号,计算出阳离子的浓度。
阳离子离子色谱法具有分离效率高、分析速度快、灵敏度高的优点。
它在环境监测、食品安全、药物分析等领域广泛应用。