第三组阳离子的分析
- 格式:doc
- 大小:465.00 KB
- 文档页数:19




阳离子系统分析:常见阳离子:Ag +、Hg 2+、Hg 22+、Pb 2*、Bi 3+、Cu 2+、Cd 2+、As (3 价和 5 价卜 Sb (3 价和 5 价)、Sn (2 价和 4 价)、Al 3+、Cr 3+、Fe (2 价和 3 价)、Mn 2+、Zn 2+、Co 2+、Ni 2+、Ba 2+、Ca 2+、 Mg 2+、 K +、 Na +、 NH 4+系统分析步骤: 第一组、检验铅离子、亚汞离子、银离子。
1. 加入盐酸至有 0.6mol/L -1 的氯离子剩余,补加稀硝酸至氢离子约 2.0mol/L -1,如有白色沉淀,则为氯化铅(溶解度较大,下组仍要除去铅离子)、氯化亚汞、氯化银,剩余 滤液A 用 于下组分析。
2. 验铅离子: 沉淀加水加热并趁热过滤, 加入醋酸酸化, 加入铬酸钾产生黄色沉淀铬酸铅则 有铅离子; 3. 验银离子:以上剩余沉淀用热水洗净,加入氨水,分离滤液并用硝酸酸化,滤液产生白色沉淀氯化银则有银离子; 4. 验亚汞离子:以上第 3步剩余残渣如变黑则有 Hg 22+(HgNH 2Cl+Hg )。
第二组、检验铅离子、铋离子、铜离子、镉离子、三价砷、汞离子、三价锑、四价锡。
1.往滤液A 中加入0.3mol/L -1的盐酸,通入硫化氢,加热,产生沉淀:PbS CuS HgS 均为 黑色,黑褐色Bi 2$、黄色的CdS 和SnS 、淡黄色AS 2S 3、橙红色S6S 3,剩余滤液B 用于下组 分析。
2 (铅、铋、铜、镉离子的检验)•过滤以上沉淀,加入过量硫化钠,得 沉淀A (组成有硫化 2- 3- 3-2- 铅、三硫化二铋、硫化铜、硫化镉 )和滤液C (组成有HgS -、AsS s -、SbS -、Sn S -)。
3 (铅、铋、铜、镉离子的检验)•往沉淀A 中加入6摩尔每升硝酸,沉淀溶解,在加入 1:1的甘油和过量的浓氢氧化钠,如有黄色沉淀为氢氧化镉,分离出 滤液 D 待检验,沉淀用 3 摩尔每升盐酸溶解,再稀释3倍,加入硫代乙酰胺(CHCSNH )加热,生成黄色沉淀硫化镉则有镉离子。
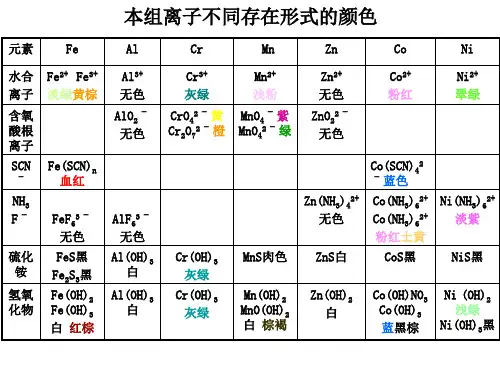


Al3+、Cr3+、Fe2+、Fe3+、Mn2+、Ni2+、Co2+、Zn2+离子混合液的分离和鉴定方法概述这8种离子的氯化物都溶于水,在0.3mol/L盐酸溶液中不被硫化氢沉淀,但在NH3 -NH4缓冲溶液中与硫化氢作用,Al3+和Cr3+生成Al(OH)3和Cr(OH)3沉淀,其它的离子都生成相应的硫化物沉淀。
这8 种阳离子组成硫化氢系统分析中的碱性硫化氢组或被称为铁铝组,在硫化氢系统分析程序上又称为第三组.这些阳离子绝大多数是d区金属元素阳离子,未成对电子的存在使得它们的阳离子在水溶液中呈现一定的颜色,同时又使它们具有强烈的形成配离子的倾向。
下表是这些阳离子以及某些配离子的颜色,但如果试液无色,也不能排除有色离子的存在,因为当某些离子含量很小或不同颜色发生互补现象时,溶液几乎无色。
在上述8种离子中,除Al3+和Zn2+以外,其它离子属不饱和电子构型,由于次外层的d 轨道电子可以全部或部分参与成键,因而常表现出可变价态,具有氧化还原性质。
这些性质在离子的分离和鉴定中显得十分重要。
如利用Mn2+和Cr3+的还原性,在碱性条件下可将它们氧化为MnO2和CrO42-。
在酸性条件下,NaBiO3氧化Mn2+为MnO4-的反应,被用来鉴定Mn2+。
分析步骤分析说明1.在氢氧化钠作用下,两性元素铝,铬,锌的氢氧化物溶解在过量碱中,而与非两性元素分离。
同时锰和铬又被过氧化氢氧化成四价锰和六价铬。
Mn(OH)2 + H2O2→ MnO2 + 2H2O2.MnO2和Co(OH)3在HNO3中溶解不显著,在酸性溶液中用H2O2还原可提高溶解性,反应如下:MnO2 + H2O2 + 2H+→ Mn2+ + 2H2O + O22Co(OH)3 + H2O2 +4H+→ 2Co2+ + 6H2O + O23.在酸性溶液中ClO3-将Mn2+氧化为MnO2而与铁、钴、镍分离。
3Mn2+ + ClO3- + 3H2O → 3MnO2 + 6H+ + Cl-4.用HNO2作还原剂将MnO2再还原为Mn2+,用铋酸钠氧化为紫色的MnO4-,这是鉴定二价锰离子的特征反应:2Mn2+ + 14H+ + 5NaBiO3→ 2MnO4- + 5Bi3+ + 7H2O + 5Na+5.利用铁、钴、镍离子与氨水不同作用,将其分离。

教案2013~2014学年课程名称分析化学院(系)化学与环境科学学院教研室(实验室) 化学系授课班级主讲教师职称副教授使用教材华中师大等编《分析化学(上册)》兰州城市学院化学与环境科学学院制教案(首页)注:课程类别:公共基础课、专业基础课、专业必修课、专业选修课、集中实践环节、实验课、公共选修课教学内容:第一章绪论一、分析化学的任务和作用1.分析化学的任务分析化学是研究关于物质的化学结构、化学组成及测定方法的一门学科。
它是化学科学的一个重要分支。
定性分析的任务:就是鉴定物质的化学结构和化学组成。
定量分析的任务:就是测定物质中各组分的相对含量。
2.分析化学的作用分析化学作为一门学科,对于化学本身的发展起过重大作用。
化学上的基本定律都是依靠大量的分析实验数据才得以创立和发展起来的,而其它各门学科的发展又进一步推动了分析化学的发展。
分析化学对工业、农业、国防和科学技术的发展都有重要的作用。
分析化学在高等学校理、工、农、医、师范各有关专业中,是一门重要的化学基础课。
三、定量分析的方法1.按对象分2.按操作方法分类3.按试样用量分类4.根据被测组分含量分类5.其它专有名词四、分析化学的发展趋势(一)分析化学的发展简史(二)当前的发展趋势第二章定性分析教学内容:§2-1 概述一、定性分析的任务和方法1.任务:鉴定物质中所含有的组分。
2.方法⑴干法:指分析反应在固体之间进行。
⑵湿法:指分析反应在溶液之间进行。
(主要学习湿法分析)二、定性分析反应进行的条件共5点三、鉴定方法的灵敏度和选择性1.鉴定方法的灵敏度鉴定反应的灵敏度常用“最低浓度”和“检出限量”来表示。
⑴最低浓度⑵检出限量⑶检出限量和最低浓度之间的关系2.鉴定反应的选择性四、空白试验和对照试验空白试验:用配制试液用的蒸馏水代替试液,用同样的方法和条件重做试验进行鉴定,就叫做空白试验。
对照试验:用已知溶液代替试液,用同样方法进行鉴定,就叫做对照试验。

分析化学实验思考题答案实验⼀阳离⼦第⼀组(银组)的分析思考题:1.沉淀第⼀组阳离⼦为什么要在酸性溶液中进⾏?若在碱性条件下进⾏,将会发⽣什么后果?答:在系统分析中,为了防⽌易⽔解离⼦的⽔解⽣成沉淀⽽进⼊第⼀组,所以沉淀第⼀组阳离⼦时要在酸性溶液中进⾏。
若在碱性条件下进⾏,第⼀组以后的⼤部分阳离⼦将⽣成沉淀,这样就不到分离的⽬的。
2.向未知溶液中加⼊第⼀组组试剂HCl时,未⽣成沉淀,是否表⽰第⼀组阳离⼦都不存在?答:向未知试液中加⼊第⼀组组试剂时,未⽣成沉淀,只能说明Ag+,Hg22+不存在,⽽不能说明Pb2+不存在,因为当试液中Pb2+的浓度⼩于1mg?ml-1,或温度较⾼时,Pb2+将不在第⼀组沉淀,⽽进⼊第⼆组。
3.如果以KI代替HCl作为第⼀组组试剂,将产⽣哪些后果?答:如果以KI代替HCl作为第⼀组组试剂时,酸度太⼩,第⼆组易⽔解的阳离⼦将⽔解进⼊第⼀组,达不到分离的⽬的。
另外具有氧化性阳离⼦将与I-发⽣氧化还原反应,使这些离⼦的浓度降低不能鉴出。
实验⼆阳离⼦第⼆组(铜锡组)的分析思考题:1.沉淀本组硫化物时,在调节酸度上发⽣了偏⾼或偏低现象,将会引起哪些后果?答:沉淀本组硫化物,若酸度偏低时,第三组阳离⼦Zn2+将⽣成ZnS 沉淀进⼊第⼆组。
若酸度偏⾼时,本组的Cd2+不⽣成硫化物沉淀⽽进⼊第三组。
2.在本实验中为沉淀硫化物⽽调节酸度时,为什么先调⾄0.6mol·L-1HCl酸度,然后再稀释⼀倍,使最后的酸度为0.2 mol·L-1?答:因As(III)的硫化物完全沉淀需在0.6 mol·L-1HCl酸度下,Cd2+的硫化物完全沉淀需在0.2 mol·L-1HCl酸度下。
因此为了使本组离⼦完全⽣成硫化物沉淀⽽与第三组阳离⼦分离,所以在调节酸度时,先调⾄0.6 mol·L-1HCl酸度,然后再稀释⼀倍,使最后的酸度为0.2mol·L-1。
分析化学实验课后习题答案(第四版)篇一:分析化学实验课后习题答案(第四版)实验四铵盐中氮含量的测定(甲醛法)思考题:1.铵盐中氮的测定为何不采用NaOH直接滴定法?答:因NH4+的Ka=×10-10,其Cka0(2)V1>0 V2=0(3)V1>V2(4)V10时,组成为:HCO3- V1>0 V2=0时,组成为:OH- V1>V2时,组成为:CO32-+ OH- V113时测Ca2+对结果有何影响?答:因为滴定Ca2+、Mg2+总量时要用铬黑T作指示剂,铬黑T 在pH为8~11之间为蓝色,与金属离子形成的配合物为紫红色,终点时溶液为蓝色。
所以溶液的pH值要控制为10。
测定Ca2+时,要将溶液的pH控制至12~13,主要是让Mg2+完全生成Mg(OH)2沉淀。
以保证准确测定Ca2+的含量。
在pH为12~13间钙指示剂与Ca2+形成酒红色配合物,指示剂本身呈纯蓝色,当滴至终点时溶液为纯蓝色。
但pH>13时,指示剂本身为酒红色,而无法确定终点。
3.如果只有铬黑T指示剂,能否测定Ca2+的含量?如何测定?答:如果只有铬黑T指示剂,首先用NaOH调pH>12,使Mg2+生成沉淀与Ca2+分离,分离Mg2+后的溶液用HCl调pH=10,在加入氨性缓冲溶液。
以铬黑T为指示剂,用Mg—EDTA标准溶液滴定Ca2+的含量。
实验八铅、铋混合液中铅、铋含量的连续测定思考题:1.按本实验操作,滴定Bi3+的起始酸度是否超过滴定Bi3+的最高酸度?滴定至Bi3+的终点时,溶液中酸度为多少?此时在加入10mL200g·L-1六亚四基四胺后,溶液pH约为多少?答:按本实验操作,滴定Bi3+的起始酸度没有超过滴定Bi3+的最高酸度。
随着滴定的进行溶液pH≈1。
加入10mL200g·L-1六亚四基四胺后,溶液的pH=5~6。
2.能否取等量混合试液凉粉,一份控制pH≈滴定Bi3+,另一份控制pH为5~6滴定Bi3+、Pb2+总量?为什么?答:不能在pH为5~6时滴定Bi3+、Pb2+总量,因为当溶液的pH为5~6时,Bi3+水解,不能准确滴定。
第二章 思考题与习题1.已知用生成AsH 3气体的方法鉴定砷时,检出限量为1μg ,每次取试液0.05mL 。
求此鉴定方法的最低浓度(分别以ρB 和1:G 表示)。
解: 最底浓度 12005.01-⋅===mL g V m B μρ 610=⋅G B ρ466105201010⨯===∴B G ρ 1:G=1:5×1042.取一滴(0.05mL )含Hg 2+试液滴在铜片上,立即生成白色斑点(铜汞齐)。
经过实验发现,出现斑点的必要条件是汞的含量应不低于100μg ·mL -1。
求此鉴定方法的检出限量。
解: 检出限量 g V m B μρ510005.0=⨯=⋅=3.洗涤银组氯化物沉淀宜用下列哪种洗液?为什么?(1)蒸馏水 (2)1mol ·L -1 HCl (3) 1mol ·L -1 HNO 3 (4) 1mol ·L -1 NaCl答:应选用(2)1mol·L -1HCl 作洗液,因为HCl 含有与氯化物沉淀的共同离子,可以减少洗涤时的溶解损失,又保持一定的酸度条件,避免某些水解盐的沉淀析出,另外HCl 为强电解质避免因洗涤剂而引起胶体现象。
如果用蒸馏水洗涤,则不具备上述条件,使沉淀的溶解损失太大,特别是PbCl 2﹑HNO 3不含共同离子,反而引起盐效应而使沉淀溶解度大,NaCl 则虽具有共同离子,但不具备酸性条件,所以亦不宜采用。
4.如何将下列各沉淀分离?(1)Hg 2SO 4-PbSO 4 (2)Ag 2CrO 4-Hg 2CrO 4 (3) Hg 2CrO 4-PbCrO 4(4)AgCl-PbSO 4 (5)Pb(OH)2-AgCl (6) Hg 2CrO 4-AgCl解:(1)用NH 4Ac 溶解PbSO 4,而不溶解Hg 2SO 4 。
(2)用氨水溶解Ag 2CrO 4,而不溶解Hg 2CrO 4 。
(3) 用NaOH 溶解PbCrO 4,而不溶解Hg 2CrO 4 。
定性分析综合实验报告一.实验目的1)掌握化学分析法的基本操作技能和初步运用的能力;2)掌握常见离子的个性、共性、反应条件和鉴定方法; 3)通过综合实验分析混合试液的各阳离子及其性质。
二.实验仪器和试剂仪器: 离心管若干、玻璃棒、离心机、量筒、滴管、电炉、烧杯、石棉网、试管架、试管夹、黑白点滴板、ph试纸、药匙、表面皿、滤纸、红色石蕊试纸、坩埚试剂: 6mol/lhcl、3mol/lhcl、1mol/lhcl、0.6mol/lhcl、6mol/lhac、3mol/l hac、k2cro4溶液、3mol/lh2so4、6mol/lnaoh、6mol/l氨水、蒸馏水、6mol/lhno3、 3mol/lhno3、0。
6mol/lhcl、稀氨水、taa、nh4cl、kclo3、甘油溶液(1:1)、 naac、k4fe(cn)6、浓hac、sncl2、浓hcl、(nh4)2co3、浓hno3、铝片、锡粒、新配制的nabro、k3fe(cn)6、nh4scn、0。
1mol/lhcl、nabio3、h2o2、戊醇、浓(nh4)2hpo4、丁二酮肟、氨气、(nh4)2hg(scn)4、cocl2、(nh4)2c2o4、四苯硼化钠、醋酸铀酰锌、乙醇、浓naoh、镁试剂、nh4no3三.实验步骤1.被测溶液的ph值大于7,显碱性,初步判定试液中可能有nh4+4+2.nh的鉴定水浴被测试液1滴(下表面皿)+湿润的红色石蕊试纸(上表面皿)+浓naoh 红色石蕊试纸变蓝示有nh4+ 3.阳离子第一组(银组)的分析(1)本组的沉淀在试液中加2滴6mol/lhcl,充分搅拌,约2min,离心沉降,吸出离心液,留作第二组测定,沉淀以3滴1mol/lhcl洗涤2次,然后按(2)研究(2)向所得氯化物沉淀上加水1ml,然后在水浴中加热近沸,搅拌,约1-2min后,趁热离心沉淀,并迅速吸出离心液于另一只离心管中①铅的鉴定离心液+6mol/lhac+3滴k2cro pbcro4(黄)示有pb2+②hg2+的鉴定在(2)残渣+6mol/l 氨水无现象没有hg2+③ag+的鉴定离心液++ agcl ,hg2cl2 ,pbcl2ii-iv组1pb,cl agcl,hg2cl2 6mol/lhac6mol/l 氨水4黄)无现象示有pb2+4.阳离子第二组(铜锡组)的分析向上述溶液中加6mol/l氨水,使其呈碱性,再加3mol/lhcl(沉淀溶解,溶液蓝色透明)至酸度为ph=0。
第四节第三组阳离子的分析一、本组离子的分析特性本组包括由7种元素形成的8种离子:Al3+、Cr3+、Fe3+、Fe2+、Mn2+、Zn2+、Co2+、Ni2+,称为铁组,它们的氯化物溶于水,在·L-1HCl溶液中不形成硫化物沉淀,只能在NH3-NH4Cl(pH≈9)溶液中与(NH4)2S或硫代乙酰胺反应生成硫化物或氢氧化物沉淀,按分组顺序称为第三组,按所用试剂称为硫化铵组。
1.离子的颜色——预测某些有色离子是否存在常见阳离子中带有颜色的,除Cu2+以外,其余都集中到本组,而本组中只有Al3+和Zn2+无色。
作用:此性质可用作未知离子的预测。
应注意的问题:(1)当含量少时,即使溶液无色,也不能排除有少量有色离子的存在。
(2)当不同的颜色发生互补现象时,溶液虽然无色也不能排除有色离子的存在。
如Co2+:Ni2+=1:3互补规律:(对角线互补为无色)2.离子的价态本组除Al3+与Zn2+外,都有两种以上的价态,如Fe(2,3),Mn(2,3,4,5,6,7),Cr(2,3,6),Co(2,3),Ni(2,3)等。
可应用于分离和鉴定反应之中。
正因为这样,本组许多离子的分析反应都与其价态的变化有关,有的还有重要的分析意义。
氧化还原反应在分析中的应用(1)分离离子:掩蔽或沉淀以NaOH沉淀Co(OH)2时,因它的溶解度较大,且容易被过量的NaOH部分溶解为HCoO2-,所以沉淀不完全。
为使沉淀完全,一般都将Co(OH)2氧化为Co(OH)3。
Co(OH)2很容易被氧化,甚至放置在空气中都可逐渐转变为Co(OH)3。
在实验条件下,通常是加Na2O2作为氧化剂:2Co(OH)2+Na2O2+2H2O=2Co(OH)3↓+2Na++2OH-(2)鉴定离子Mn2+在稀溶液中接近无色,而MnO4-却有鲜明的紫红色。
利用这一性质,可将Mn2+氧化为MnO4-而加以鉴定,灵敏度很高(m=1μg,c=16ppm)。
又如,Cr3+的鉴定方法之一,是先在碱性溶液中将它氧化为黄色的CrO42-(不够灵敏、受有色离子的干扰),然后再在酸性溶液中进一步氧化为蓝色的过氧化铬CrO5。
这是铬比较特效的方法。
(3)溶解难溶化合物一般的溶解度小的硫化物或氧化物均可用氧化还原法溶解。
CoS+H2O2+2H+==Co2++S↓+2H2OMnO2+2H++H2O2==Mn2++2H2O+O2↑MnO2+4H++4Cl-==MnCl2+2H2O+Cl2↑(4)预处理离子如AsⅤ到AsⅢ、SnⅡ到SnⅣ的转化3.形成络离子的能力本组离子形成络离子的能力较强。
这一性质对本组某些离子的分离和鉴定有很大的方便。
例如Zn2+、Co2+、Ni2+与NH3生成络离子的性质可用于它们与其它离子的分离;在一定条件下,Fe3+;和Co2+与NH4SCN形成有色的络合物,这一性质可用于相应离子的鉴定。
配位反应在分析中的应用(1)鉴定离子如Fe2+在pH=2-9下,与邻二氮菲生成深红色配位化合物用这类反应鉴定离子,在分析检验上经常使用。
阳Ⅲ组Al3+、Fe3+、Fe2+、Zn2+、Co2+、Ni2+均用此类鉴定反应。
(2)掩蔽离子(不分离)如鉴定Co2+时,Co2+与NH4SCN生成蓝色络合物Co(SCN)42-,但Fe3+有干扰,此时可用NaF掩蔽Fe3+。
(3)分离如Ag+、Zn2+、Co2+、Ni2+、Cd2+、Cu2+与Fe3+的分离,可用过量的氨水,形成Fe(OH)3↓,其余的均形成配位化合物。
(4)溶解难溶化合物如AgCl可用氨水溶解。
4.与(NH4)2反应5.沉淀的性状易形成胶体沉淀,特别是NiS。
二、组试剂与分离条件本组组试剂为NH3-NH4Cl(pH=9)存在下的(NH4)2S或硫代乙酰胺(加热)。
与组试剂作用时本组离子有的生成硫化物,有的则生成氢氧化物:Fe2++S2-=FeS↓(黑) 2Fe3++3S2-=Fe2S3↓(黑)Mn2++S2-=MnS↓(肉色) Zn2++S2-=ZnS↓(白)Co2++S2-=CoS↓(黑) Ni2++S2-=NiS↓(黑)2A13++3S2-+6H2O=2A1(OH)3↓(白)+3H2S↑2Cr3++3S2-+6H2O=2Cr(OH)3↓(灰绿)+3H2S↑因Fe3+、Al3+与Cr3+的氢氧化物溶解度很小,当溶液一旦变成微碱性(如在氨性溶液中)时,它们首先就会以氢氧化物的形式析出,加入组试剂后,只有Fe(OH)3转化为黑色Fe2S3沉淀。
为了使本组离子沉淀完全,并与第四组离子有效分离,且所得的沉淀便于离心沉降,在进行沉淀时应注意控制酸度和防止硫化物形成胶体等问题。
1.防止(NH4)2S水解这是为了得到高浓度的S2-。
NH4++S2-+H2O HS-+NH3使[S2-]降低,不利于沉淀生成。
措施:加NH3抑制。
2.酸度要适当在分离第二组后,溶液是L HCl,因此,必须先用氨水中和至弱碱性。
在中和过程中,Fe3+、Al3+和Cr3+会局部析出氢氧化物沉淀,所以,中和的同时又可预测本组三价离子是否存在。
Al(OH)3和Cr(OH)3都属于两性氢氧化物,酸度高时沉淀不完全,太低又容易形成偏酸盐而溶解。
当Al3+和Cr3+的浓度都低于10-2mol·L-1时,Al3+在pH≈4时开始形成沉淀,pH=10-12时沉淀溶解;Cr(OH)3沉淀在pH≈5时开始生成,pH=12-14时沉淀溶解。
另一方面,第四组的Mg2+在pH=时也开始析出Mg(OH)2沉淀。
综合以上情况,Al(OH)3和Cr(OH)3要求溶液的pH应控制在之间,防止第四组的Mg2+形成Mg(OH)2沉淀,经实验得出pH=9为最佳,但是,仅仅把溶液的pH调到9还是不行的,因为在反应过程中还有H+生成,2A13++3S2-+6H2O=2A1(OH)3↓(白)+3H2S↑2Cr3++3S2-+6H2O=2Cr(OH)3↓(灰绿)+3H2S↑会使pH降低。
为保持pH=9,应加入氨水和NH4C1(NH3-NH4C1),以构成缓冲体系。
3.防止硫化物形成胶体一般硫化物都有形成胶体的倾向,而以NiS为最强,不便于分离。
NiS甚至可形成暗褐色溶胶,根本无法分离。
为防止这一现象,除加入NH4C1外,还须将溶液加热,以促使胶体凝聚。
如果在氨性溶液中加入硫代乙酰胺以代替(NH4)2S作为沉淀剂,则由于沉淀是在均相中缓慢生成的,所以一般不会产生胶体现象。
4.使用新鲜的(NH4)2S溶液否则,S2-被空气中的氧气氧化为硫酸根,使第四组阳离子提前沉淀。
5.取原溶液分析Fe2+、Fe3+原因:1)在沉淀第二组阳离子时,Fe3+ H2S Fe2+2)调节pH=9时,Fe2+ O2Fe3+ OH-Fe(OH)3 (NH4)2S Fe2S3结论:由于铁的价态多次改变,为了确定其价态,须取原试液鉴定Fe3+、Fe2+。
5. 本组离子的沉淀条件综合上述,本组的沉淀条件是:在NH3—NH4Cl(pH=9)热的试液中加入(NH4)2S。
若使用TAA作沉淀剂,则应在NH3-NH4Cl存在下加TAA,然后加热10min。
具体操作步骤为:(1)对分离第二组离子后的溶液用氨水中和至弱碱性,并预测本组三价离子(Fe3+、Al3+与Cr3+)是否存在;(2)用pH=9的NH3—NH4Cl缓冲溶液控制酸度;(3)△,加(NH4)2S,再△,促使胶体凝聚;(4)须取原试液鉴定Fe3+、Fe2+。
三、本组离子的系统分析1.本组沉淀的溶解HCl NiS、CoS难溶解稀HNO3可溶解全部沉淀√2.本组系统分析方案简介常见的有氨法、碱法。
(1)氨法系统图。
讨论:+在氨性溶液中易被氧化(部分)2Mn2++4OH-+O2==2MnO(OH)2↓混合液中Mn2+和MnO(OH)2↓共存,当离子量小时,易引起丢失,故应提前鉴定。
b. Co2+易共沉淀于Fe(OH)3、Al(OH)3和Cr(OH)3中,引起丢失,故也应提前鉴定。
(2)碱法系统图。
讨论:a. Co2+、Mn2+在H2O2和NaOH作用下,分别生成Co(OH)3[较Co(OH)2稳定]、MnO(OH)2↓(全部Mn2+反应),b. Zn2+易发生共沉淀现象,应提前鉴定。
四、本组离子的分别鉴定在分离出第一、二组阳离子后在上述的沉淀条件下把本组离子以氢氧化物或硫化物形式沉淀出来,沉淀用热的稀硝酸可全部溶解,此时,亚铁离子被氧化为+3价,要确定铁的价态,应取原溶液进行鉴定。
本组离子一般都有较好的鉴定方法,而且特效性也较好,所以组内不必进行过多的分离,甚至可以不进行分离。
另一方面,本组内部的分离方案都不够理想,有些离子没有明确的所属,当它们的含量较少时,容易在分离过程中丢失。
因此,本组离子的分析宜采用分别分析的方法。
在系统分析中,有时要先进行某些离子的分别鉴定,这种情况一般用于:1.系统分析中会发生价态变化,以需确定其价态的。
如Fe2+、Fe3+。
2.在系统分析中要引入的离子,如NH4+在系统分析中作为试剂加入,因此,原试液是否有NH4+,须先分别鉴定。
3.在分组时易丢失的离子,分离前应分别检出。
如用氨法在第三组内分析时,Mn2+、Co2+就易丢失。
一般在进行分别分析时应注意以下几个问题:1.鉴定反应的条件,反应式、酸碱度、温度、溶剂等2.操作方法,反应器皿,加入试剂的浓度、顺序和用量等。
3.干扰情况,根据干扰情况针对性地采取措施。
4.灵敏度,根据具体情况选择灵敏度适当的鉴定反应。
+的鉴定(CN)6试法(铁氰化钾试法)Fe2+与K3Fe(CN)6试剂生成深蓝色沉淀,为滕氏蓝:Fe2++K++Fe(CN)63-=KFe[Fe(CN)6]↓(1)条件:反应要在微酸性或中性(HAC)非氧化性溶液中进行。
①此沉淀可被碱所分解:KFe[Fe(CN)6]+3OH-=Fe(OH)3↓+Fe(CN)64-+K+②强酸性 CN→HCN(2)干扰:其他阳离子对此鉴定反应一般无干扰。
虽然很多离子也同试剂生成有色沉淀,但它们在一般含量情况下都不足以掩盖Fe2+生成的深蓝色。
(3)灵敏度:m=μg c=1:5×l05(2ppm)。
B.邻二氮菲试法Fe2+与邻二氮菲在酸性溶液中生成稳定的红色可溶性络合物。
(1)条件:酸性溶液(2)干扰:一般无明显干扰Cu2+、Co2+、Zn2+、Ni2+、Cd2+、SbⅢ等也能与试剂生成络合物,但不是红色,不妨碍鉴定。
它们存在时仅需多加一些试剂。
Fe3+大量存在时亦无干扰。
(3)灵敏度:m=μg c=1:2×106。
+的鉴定法Fe3+与NH4SCN或KSCN生成血红色具有不同组成的络合离子:Fe(SCN)2+、Fe(SCN)2+、Fe(SCN)3、Fe(SCN)4-、Fe(SCN)52-、Fe(SCN)63-。