2第二章1-2-2 阳离子分析
- 格式:ppt
- 大小:389.50 KB
- 文档页数:61


第七章综合和设计实验 (125)实验三十五常见阳离子的定性分析 (125)实验三十六常见阴离子的定性分析 (132)实验三十七配合物的光谱化学序测定 (134)实验三十八从废定影液中回收银 (137)实验三十九水热法制备SnO2纳米微晶 (138)实验四十聚碱式氯化铝的制备与净水试验 (141)实验四十一镧-间羟基苯甲酸-8-羟基喹啉三元配合物的合成 (142)实验四十二水热法制备羟基磷灰石纳米粒子 (145)第七章综合和设计实验实验三十五常见阳离子的定性分析一、目的要求1. 掌握常见二十多种阳离子的主要性质。
2. 掌握各种离子的鉴定及混合后的分离操作。
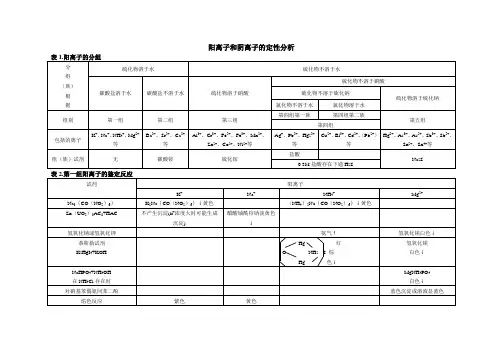
二、实验原理阳离子的种类较多,常见的有二十多种,个别定性检出时,容易发生相互干扰,所以一般阳离子分析都是利用阳离子的共同特性,先分成几组,然后再根据阳离子的个别特性加以检出。
凡能使一组阳离子在适当的条件下,生成沉淀而与其它组阳离子分离的试剂称为组试剂。
利用不同的组试剂将阳离子逐组分离,再进行检出的方法,叫做阳离子的系统分析。
为使学生学到的无机化学理论知识和元素及其化合物性质能够得到反复巩固,本试验将常见的二十多种阳离子分为六组:第一组:易溶组Na+、K+、NH4+、Mg2+第二组:氯化物组Ag+、Hg22+、Pb2+第三组:硫酸盐组Ba2+、Ca2+、Pb2+第四组:氨合物组 Cu 2+、Cd 2+、Zn 2+、Co 2+、Ni 2+ 第五组:两性组 Al 3+、Cr 3+、Sb(Ⅲ,Ⅴ)、Sn(Ⅱ,Ⅳ) 第六组:氢氧化物组 Fe 2+、Fe 3+、Bi 3+、Mn 2+、Hg 2+然后再根据各组离子的特性,加以分离和比较,其分离方法如下:第二组(盐酸盐组)AgCl,PbCl 2,HgCl 2第三组BaSO 4,CaSO SrSO 4,PbSO4溶液2O 2第四组(氨合物组)Cd(NH 3)42+,Cu(NH 3)42+Ni(NH 3)42+,Co(NH 3)62+Zn(NH 3)42+第一组(易溶组)K +,Na +,Mg 2+第五组(两性组)第六组(氢氧化物)(第一组)K +,Na +,Mg 2+(第四组硫化物)(第五组)AlO 2-,CrO 42-SbO 42-,SnO 32-沉淀Fe(OH)3,MnO(OH)2NaBiO 3,HgNH 2Cl (第六组)弃去三、仪器和药品仪器:试管,离心管,离心机,烧杯,玻棒,黑白点滴板,铝试管架 药品:HAc(6 mol·L -1),NaOH(40 %,6 mol·L -1),Na 3[Co(NO 2)6](饱和),醋酸铀酰锌试剂,镁试剂,HCl(浓,2 mol·L -1),NH 4Ac(3 mol·L -1),K 2Cr 2O 7(0.1 mol·L -1),K 2CrO 4(0.1 mol·L -1),HNO 3(浓,6 mol·L -1),NaAc(饱和,3 mol·L -1),KI (0.1 mol·L -1),NH 3·H 2O(浓,6 mol·L -1),H 2SO 4(1 mol·L -1),乙醇(95 %),(NH 4)2C 2O 4(饱和),NH 4Cl(3 mol·L -1,0.1 mol·L -1),H 2O 2(3 %),K 4[Fe(CN)6]7(0.1 mol·L -1),SnCl 2(0.1 mol·L -1),NH 4SCN(饱和),二乙酰二肟,戊醇,(NH 4)2S(6 mol·L -1),二苯硫腙,H 2S(饱和),乙醚,铝试剂,铝片, HgCl 2(0.1 mol·L -1),锡箔,NaBiO 3(s), KNCS(0.1 mol·L -1),pH 试纸,红色石蕊试纸,阳离子试液:Na +,K +,NH 4+,Mg 2+,Ag +,Hg 22+,Pb 2+,Ba 2+,Ca 2+,Cu 2+,Cd 2+,Zn 2+,Co 2+,Ni 2+,Al 3+,Cr 3+,Sb(Ⅲ,Ⅴ),Sn(Ⅱ,Ⅳ),Fe 2+,Fe 3+,Bi 3+,Mn 2+,Hg 2+四、实验内容1. 第一组、第二组、第三组阳离子的分离和鉴别方法1) 第一组易溶组阳离子的分析本组阳离子包含Na+、K+、NH4+、Mg2+,它们的盐大多数可溶于水,没有一种共同的试剂可以作为组试剂,而是采用个别鉴定的方法,将它们检出。


常见阳离子的分离与鉴定二实验报告一、实验目的1、了解常见阳离子的溶解特性;2、熟悉常见阳离子的分离与鉴定的方法;3、巩固常见阳离子的溶解特性,以便于进行实验中的鉴别、分离及分析;二、实验原理阳离子是指带有正电荷的离子,如钠离子(Na+)、钾离子(K+)、氯离子(Cl-)、铵离子(NH4+)等。
阳离子有着不同的电荷,溶解度和溶质的类型不同,因此,可以根据不同的溶解特性将其分离、鉴定出来。
本实验利用沉淀反应、氯化物气体滴定以及媒质对组成离子的影响,结合实验室常见阳离子的特性,在模拟实验中进行阳离子的分离与鉴定。
三、实验材料1、2.0 mol/L的NaCl溶液、KCl溶液、NH4Cl溶液、(NH4)2SO4溶液;2、2.0mol/L溴代乙酸溶液;3、分光光度计;4、蒸馏水;5、吸管、放大器、烧杯及烧瓶等实验用具;四、实验步骤1、将2.0mol/L NaCl溶液、KCl溶液、NH4Cl溶液、(NH4)2SO4溶液分别放入4个烧杯中;2、将2.0mol/L溴代乙酸溶液分别加入到4个烧杯中,观察气体的产生及沉淀反应;3、将沉淀反应结束后的物质加入蒸馏水中,然后充分搅拌;4、用分光光度计测定各烧杯中溶液的溶氧量;5、根据溶氧量的结果,鉴定出阳离子的种类;六、实验结果1、烧杯1中,溶质沉淀出白色晶体,添加溴代乙酸溶液可产生白色气体,同时溶氧量为0.4mg/L,可判定该溶液为等比例混合溶液,溶质为NaCl;2、烧杯2中,溶质沉淀出暗黄色晶体,添加溴代乙酸溶液可产生黄色气体,同时溶氧量为0.5mg/L,可判定该溶液为等比例混合溶液,溶质为KCl;3、烧杯3中,溶质沉淀出淡粉色晶体,添加溴代乙酸溶液可产生白色气体,同时溶氧量为0.7mg/L,可判定该溶液为等比例混合溶液,溶质为NH4Cl;4、烧杯4中,溶质沉淀出白色晶体,添加溴代乙酸溶液可产生淡黄色气体,同时溶氧量为3.5mg/L,可判定该溶液为等比例混合溶液,溶质为(NH4)2SO4。
实验一、第一、二组阳离子混合液分析二、实验配置方案(按20人一个小班配置)1.仪器配置Ag+练习试液Pb2+练习试液Hg22+练习试液Bi3+练习试液Cu2+练习试液Cd2+练习试液Hg2+练习试液As(Ⅲ、Ⅴ) 练习试液Sb(Ⅲ、Ⅴ)练习试液 Sn(Ⅱ、Ⅳ)练习试液HCl(浓,1 mol·L-1 , 6 mol·L-1, 8 mol·L-1) HAc (6 mol·L-1)HNO3 (浓,6mol·L-1 ,3mol·L-1 )NH3·H2O (6 mol·L-1) NaOH (6mol·L-1)K2CrO4(0.5mol·L-1)TAA(5%) 0.5mol·L-1NaAc 0.25mol·L-1K4Fe(CN)60.5mol·L-1SnCl2 1mol·L-1NH4Cl 0.2mol·L-1HgCl2NaBrO(新制):于溴水中滴入NaOH至溴水刚好褪色。
甲基紫溶液(1g/L)(NH4)2CO3(120g/L)Fe丝(或Mg片, Al片)Sn箔或Sn粒KClO3(s)材料:蒸馏水、广泛pH试纸第一、二组阳离子混合液分析预习要求华中教材为主第一组离子分析1.第一、第二组阳离子包括哪些离子?(课前了解)2.沉淀第一组阳离子为什么要在酸性溶液中进行?若在碱性条件下进行,将会发生什么后果?(课前或课后完成)3.向未知液中加入HCl时,未生成沉淀,是否表示第一组阳离子都不存在?(课后完成)4.如果以KI代替HCl作为第一组试剂,将产生哪些后果?(课前了解)第二组离子分析1.沉淀第二组离子硫化物时,在调节酸度上发生了偏高或偏低现象,将会引起哪些后果?(课前了解)2.在本实验中沉淀硫化物而调节酸度时,为什么先调至0.6mol·L-1HCl酸度,然后再稀释一倍,使最后的酸度为0.2mol·L-1HCl?(课后完成)3.以TAA代替H2S作为第二组组试剂时,为什么可以不加H2O2和NH4I?(课前了解)4.已知某未知试液不含第三组阳离子,在沉淀第二组硫化物时是否还要调酸度?(课前了解)5.第二组离子分族的依据及条件,第二组离子与第三组离子分离的条件。




常见阳离子的鉴定二实验报告常见阳离子的鉴定实验报告一、实验目的通过实验,了解常见阳离子的实验鉴定方法,掌握其色谱分离技术,并做出实验报告。
二、实验原理阳离子的色谱分离是利用样品中各成分的不同性质,现将样品加入有机溶剂溶解,然后加入适当的色谱剂,要求色谱剂有适当的吸附性和亲水性。
通过不同阳离子在色谱剂上的吸附性、物理、化学性质等的不同,使各成分的分离效果不同。
在某个温度、某个水浴中,这种不同的物理和化学特性使各成分的活化度不同,从而使它们分离出来,从而得到初步的阳离子分离。
三、实验材料(1) 常用阳离子溶液:Na+, K+, Ca2+, Mg2+;(2) 石墨烯色谱剂:用于色谱分离。
四、实验步骤(1) 将所有常见的阳离子溶液各取出10 ml,加入有机溶剂中,混合均匀;(2) 将上述混合液加入色谱柱中,以室温热源煮沸15分钟;(3) 将热源关闭,冷却柱体至室温;(4) 通过色谱仪分析实验中四种阳离子,并打印出检测结果;(5) 根据实验结果,制作实验报告。
五、实验结果及报告色谱实验结果如下:Na+:浓度为1.5 mg/LK+:浓度为2.3 mg/LCa2+:浓度为3.2 mg/LMg2+:浓度为1.8 mg/L根据上述实验结果,可以看出Na+, K+, Ca2+, Mg2+四种常见的阳离子在色谱柱中分离后,浓度分别是1.5 mg/L、2.3 mg/L、3.2 mg/L、1.8 mg/L,即分离效果良好。
经过色谱实验,通过四种常见阳离子的分离测定,验证了样品中四种阳离子的存在,并且对阳离子的分析效果较好。
六、结论本次实验通过对四种常见阳离子的分离测定,证实了样品中Na+, K+, Ca2+, Mg2+四种阳离子的存在,并且分析效果较好。

阳离子系统分析:常见阳离子:Ag\ Hg 2\ Hg22\ Pb :、Bi 3\ Cu 2\ Cd 2\ As (3 价和 5 价卜 Sb (3 价和 5 价)、Sn (2 价和 4 价)、Al 3\ Cr 3\ Fe (2 价和 3 价)、Mn 2\ ZrT 、Co 2\ Ni 2\ Ba 2\ Ca 2\ Mg 2\ K\ Na\ NH?系统分析步骤:第一组、检验铅离子、亚汞离子、银离子。
1. 加入盐酸至有0. 6mol/L _1的氯离子剩余,补加稀硝酸至氢离子约2. Omol/L _1,如有口色沉淀,则为氯化铅(溶解度较大,下组仍要除去铅离子)、氯化亚汞、氯化银,剩余滤液A 用于下组分析。
2. 验铅离子:沉淀加水加热并趁热过滤,加入醋酸酸化,加入洛酸钾产生黄色沉淀铭酸铅则有铅离子; 3. 验银离子:以上剩余沉淀用热水洗净,加入氨水,分离滤液并用硝酸酸化,滤液产生白色沉淀氯化银则有银离子; 4. 验亚汞离子:以上第3步剩余残渣如变黑则有Hg 22+ (HgNHzCl+Hg )。
第二组、检验铅离子、钮离子、铜离子、镉离子、三价碑、汞离子、三价铢、四价锡。
1・往滤液A 中加入0. 3mol/L t 的盐酸,通入硫化氢,加热,产生沉淀:PbS CuS HgS 均为 黑色,黑褐色Bi 2$、黄色的CdS 和SnS 、淡黄色AS2S3.橙红色S6S&剩余滤液B 用于下组 分析。
•过滤以上沉淀,加入过量硫化钠,得 沉淀A (组成有硫化 2- 3- 3- 2-)和滤液 C (组成有 HgS\ AsSs\ SbS\ Sn S 「)。
•往沉淀A 中加入6摩尔每升硝酸,沉淀溶解,在加入1:1的甘油和过量的浓氢氧化钠,如有黄色沉淀为氢氧化镉,分离出摩尔每升盐酸溶解,再稀释3倍,加入硫代乙酰胺(CHCSNH )加热,生成黄色沉淀硫化镉则有镉离子。
・滤液D 加入醋酸酸化,再加亚铁氧化钾变红棕色(Cu2Fe •滤液D 加醋酸酸化,再加銘酸钾产生黄色沉淀铭酸铅则有•滤液D 加入N*Sn ( 0H -产生黑色沉淀(Bi )则有钮离子。
§ §2.2.3 2.2.3阳离子第二组(硫化氢组)阳离子第二组(硫化氢组)Pb 2+ 、Bi 3+ 、 Cu 2+ 、 Cd2+Hg 2+ 、As Ⅲ,Ⅴ 、Sb Ⅲ,Ⅴ 、SnⅡ,Ⅳ组试剂: 0.3mol/LHCl 存在下的H2S 。
• 本组离子的共同特性是 本组离子的共同特性是在稀的 在稀的HCl HCl 溶液中与 溶液中与H2 S S 可生成 硫化物沉淀硫化物沉淀,按本组被分出的顺序,称为第二组,按所用的试剂称为硫化氢组。
㈠ 主要特性1. 离子的存在形式Ⅲ,Ⅴ Ⅲ,Ⅴ Ⅱ,ⅣAs Ⅲ,Ⅴ 、Sb Ⅲ,Ⅴ 、Sn Ⅱ,Ⅳ 的存在形式n n 2. 氧化性和还原性氧化性和还原性Pb Pb 、 、Bi Bi 、 、Cd 仅各有 仅各有1 1种重要阳离子:种重要阳离子:Pb 2+ 、 、Bi 3+ 、、Cd 2+Cu Cu 、 、Hg Hg 有两种价态的离子:有两种价态的离子:Cu 2+ 、 、Cu + 、 、Hg2 2+ 、 、Hg 2+Cu + 在溶液中不稳定,易被氧化为 在溶液中不稳定,易被氧化为Cu 2+ ; ;Cu 2+ 有氧化性,可利用 有氧化性,可利用Cu 2+ 被还原为被还原为Cu +的反应进行鉴定的反应进行鉴定:它们的氧化性和还原 Hg 2 2+ 很容易被进一步还原,得到黑色的金属汞,故 色的金属汞,故Hg 2+ 还原为 还原为Hg 2 2+ 的反应常用于 常用于Hg Hg 的鉴定的鉴定 Sb Ⅲ Ⅲ, ,Ⅴ 、 、Sn Ⅱ Ⅱ, ,Ⅳ ::它们的氧化性和还原 性在分析上很重要性在分析上很重要 AsAs 有三种价态,即正三价、正五价、 负三价。
负三价的 负三价。
负三价的As As 主要以 主要以AsH 3 形式存 在, 在,AsH 3 还原力极强,能将 还原力极强,能将AgNO 3 中的 中的 Ag + 还原为金属 还原为金属Ag Ag ,是 ,是AsAs 的一种重要检 出反应。