第二组阳离子分析
- 格式:doc
- 大小:387.50 KB
- 文档页数:14


阳离子的分离与鉴定一. 实验目的1. 掌握用两酸三碱系统分析法对常见阳离子进行分组分离的原理和方法。
2. 掌握分离、鉴定的基本操作与实验技能。
二. 实验原理阳离子的种类较多,常见的有二十多种,个别检出时,容易发生相互干扰,所以一般阳离子分析都是利用阳离子某些共同特性,先分成几组,然后再根据阳离子的个别特性加以检出。
凡能使一组阳离子在适当的反应条件下生成沉淀而与其它组阳离子分离的试剂称为组试剂,利用不同的组试剂把阳离子逐组分离再进行检出的方法叫做阳离子的系统分析。
在阳离子系统分离中利用不同的组试剂,有很多不同的分组方案。
如硫化氢分组法,两酸、两碱系统分组法。
下面介绍一种以氢氧化物酸碱性与形成配合物性质不同为基础,以HCl、H2SO4、NH3 H2O、NaOH、(NH4)2S为组试剂的两酸三碱分组方法。
本方法将常见的二十多种阳离子分为六组。
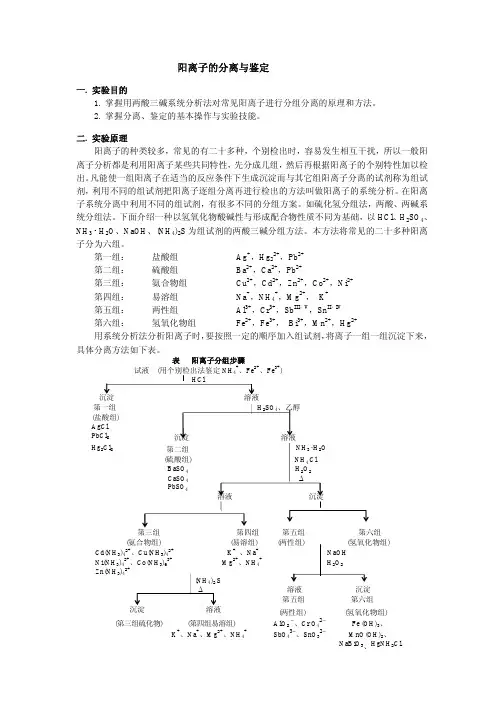
第一组:盐酸组Ag+,Hg22+,Pb2+第二组:硫酸组Ba2+,Ca2+,Pb2+第三组:氨合物组Cu2+,Cd2+,Zn2+,Co2+,Ni2+第四组:易溶组Na+,NH4+,Mg2+,K+第五组:两性组Al3+,Cr3+,Sb III、V,Sn II、IV第六组:氢氧化物组Fe2+,Fe3+, Bi3+,Mn2+,Hg2+用系统分析法分析阳离子时,要按照一定的顺序加入组试剂,将离子一组一组沉淀下来,具体分离方法如下表。
表阳离子分组步骤试液(用个别检出法鉴定NH4+、Fe2+、Fe3+)(Hg)(两性组) (氢氧化物组) (第三组硫化物) (第四组易溶组)AlO2−、Cr O42−Fe(OH)3、K+、Na+、Mg2+、NH4+SbO43−、SnO32−MnO(OH)2、NaBiO3、HgNH2Cl每组分出后,继续再进行组内分离,直至鉴定时相互不发生干扰为止。
在实际分析中,如发现某组离子整组不存在(无沉淀产生)、这组离子的分析就可省去。
从而大大简化了分析的手续。
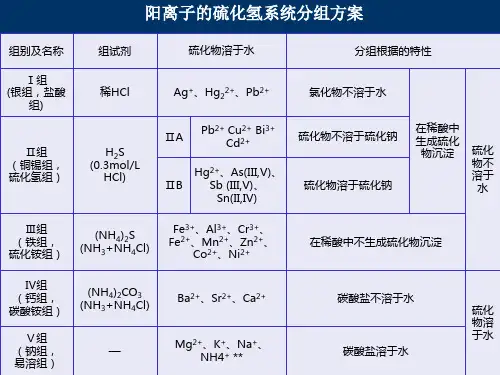

阳离子系统分析:常见阳离子:Ag +、Hg 2+、Hg 22+、Pb 2*、Bi 3+、Cu 2+、Cd 2+、As (3 价和 5 价卜 Sb (3 价和 5 价)、Sn (2 价和 4 价)、Al 3+、Cr 3+、Fe (2 价和 3 价)、Mn 2+、Zn 2+、Co 2+、Ni 2+、Ba 2+、Ca 2+、 Mg 2+、 K +、 Na +、 NH 4+系统分析步骤: 第一组、检验铅离子、亚汞离子、银离子。
1. 加入盐酸至有 0.6mol/L -1 的氯离子剩余,补加稀硝酸至氢离子约 2.0mol/L -1,如有白色沉淀,则为氯化铅(溶解度较大,下组仍要除去铅离子)、氯化亚汞、氯化银,剩余 滤液A 用 于下组分析。
2. 验铅离子: 沉淀加水加热并趁热过滤, 加入醋酸酸化, 加入铬酸钾产生黄色沉淀铬酸铅则 有铅离子; 3. 验银离子:以上剩余沉淀用热水洗净,加入氨水,分离滤液并用硝酸酸化,滤液产生白色沉淀氯化银则有银离子; 4. 验亚汞离子:以上第 3步剩余残渣如变黑则有 Hg 22+(HgNH 2Cl+Hg )。
第二组、检验铅离子、铋离子、铜离子、镉离子、三价砷、汞离子、三价锑、四价锡。
1.往滤液A 中加入0.3mol/L -1的盐酸,通入硫化氢,加热,产生沉淀:PbS CuS HgS 均为 黑色,黑褐色Bi 2$、黄色的CdS 和SnS 、淡黄色AS 2S 3、橙红色S6S 3,剩余滤液B 用于下组 分析。
2 (铅、铋、铜、镉离子的检验)•过滤以上沉淀,加入过量硫化钠,得 沉淀A (组成有硫化 2- 3- 3-2- 铅、三硫化二铋、硫化铜、硫化镉 )和滤液C (组成有HgS -、AsS s -、SbS -、Sn S -)。
3 (铅、铋、铜、镉离子的检验)•往沉淀A 中加入6摩尔每升硝酸,沉淀溶解,在加入 1:1的甘油和过量的浓氢氧化钠,如有黄色沉淀为氢氧化镉,分离出 滤液 D 待检验,沉淀用 3 摩尔每升盐酸溶解,再稀释3倍,加入硫代乙酰胺(CHCSNH )加热,生成黄色沉淀硫化镉则有镉离子。



教案2013~2014学年课程名称分析化学院(系)化学与环境科学学院教研室(实验室) 化学系授课班级主讲教师职称副教授使用教材华中师大等编《分析化学(上册)》兰州城市学院化学与环境科学学院制教案(首页)注:课程类别:公共基础课、专业基础课、专业必修课、专业选修课、集中实践环节、实验课、公共选修课教学内容:第一章绪论一、分析化学的任务和作用1.分析化学的任务分析化学是研究关于物质的化学结构、化学组成及测定方法的一门学科。
它是化学科学的一个重要分支。
定性分析的任务:就是鉴定物质的化学结构和化学组成。
定量分析的任务:就是测定物质中各组分的相对含量。
2.分析化学的作用分析化学作为一门学科,对于化学本身的发展起过重大作用。
化学上的基本定律都是依靠大量的分析实验数据才得以创立和发展起来的,而其它各门学科的发展又进一步推动了分析化学的发展。
分析化学对工业、农业、国防和科学技术的发展都有重要的作用。
分析化学在高等学校理、工、农、医、师范各有关专业中,是一门重要的化学基础课。
三、定量分析的方法1.按对象分2.按操作方法分类3.按试样用量分类4.根据被测组分含量分类5.其它专有名词四、分析化学的发展趋势(一)分析化学的发展简史(二)当前的发展趋势第二章定性分析教学内容:§2-1 概述一、定性分析的任务和方法1.任务:鉴定物质中所含有的组分。
2.方法⑴干法:指分析反应在固体之间进行。
⑵湿法:指分析反应在溶液之间进行。
(主要学习湿法分析)二、定性分析反应进行的条件共5点三、鉴定方法的灵敏度和选择性1.鉴定方法的灵敏度鉴定反应的灵敏度常用“最低浓度”和“检出限量”来表示。
⑴最低浓度⑵检出限量⑶检出限量和最低浓度之间的关系2.鉴定反应的选择性四、空白试验和对照试验空白试验:用配制试液用的蒸馏水代替试液,用同样的方法和条件重做试验进行鉴定,就叫做空白试验。
对照试验:用已知溶液代替试液,用同样方法进行鉴定,就叫做对照试验。

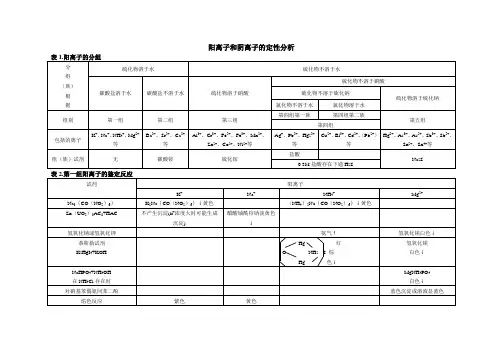
阳离子系统分析:常见阳离子:Ag+、Hg2+、Hg22+、Pb2+、Bi3+、Cu2+、Cd2+、As(3价和5价)、Sb(3价和5价)、Sn(2价和4价)、Al3+、Cr3+、Fe(2价和3价)、Mn2+、Zn2+、Co2+、Ni2+、Ba2+、Ca2+、Mg2+、K+、Na+、NH4+系统分析步骤:第一组、检验铅离子、亚汞离子、银离子。
1.加入盐酸至有0.6mol/L-1的氯离子剩余,补加稀硝酸至氢离子约2.0mol/L-1,如有白色沉淀,则为氯化铅(溶解度较大,下组仍要除去铅离子)、氯化亚汞、氯化银,剩余滤液A用于下组分析。
2.验铅离子:沉淀加水加热并趁热过滤,加入醋酸酸化,加入铬酸钾产生黄色沉淀铬酸铅则有铅离子;3.验银离子:以上剩余沉淀用热水洗净,加入氨水,分离滤液并用硝酸酸化,滤液产生白色沉淀氯化银则有银离子;4.验亚汞离子:以上第3步剩余残渣如变黑则有Hg22+(HgNH2Cl+Hg)。
第二组、检验铅离子、铋离子、铜离子、镉离子、三价砷、汞离子、三价锑、四价锡。
1.往滤液A中加入0.3mol/L-1的盐酸,通入硫化氢,加热,产生沉淀:PbS、CuS、HgS均为黑色,黑褐色Bi2S3、黄色的CdS和SnS2、淡黄色As2S3、橙红色Sb2S3,剩余滤液B用于下组分析。
2(铅、铋、铜、镉离子的检验).过滤以上沉淀,加入过量硫化钠,得沉淀A(组成有硫化铅、三硫化二铋、硫化铜、硫化镉)和滤液C(组成有HgS22-、AsS33-、SbS33-、SnS32-)。
3(铅、铋、铜、镉离子的检验).往沉淀A中加入6摩尔每升硝酸,沉淀溶解,在加入1:1的甘油和过量的浓氢氧化钠,如有黄色沉淀为氢氧化镉,分离出滤液D待检验,沉淀用3摩尔每升盐酸溶解,再稀释3倍,加入硫代乙酰胺(CH3CSNH2)加热,生成黄色沉淀硫化镉则有镉离子。
4(铅、铋、铜、镉离子的检验).滤液D加入醋酸酸化,再加亚铁氰化钾变红棕色(Cu2Fe (CN)6)则有铜离子。
实验一阳离子第一组(银组)的分析思考题:1.沉淀第一组阳离子为什么要在酸性溶液中进行?若在碱性条件下进行,将会发生什么后果?答:在系统分析中,为了防止易水解离子的水解生成沉淀而进入第一组,所以沉淀第一组阳离子时要在酸性溶液中进行。
若在碱性条件下进行,第一组以后的大部分阳离子将生成沉淀,这样就不到分离的目的。
2.向未知溶液中加入第一组组试剂HCl时,未生成沉淀,是否表示第一组阳离子都不存在?答:向未知试液中加入第一组组试剂时,未生成沉淀,只能说明Ag+,Hg22+不存在,而不能说明Pb2+不存在,因为当试液中Pb2+的浓度小于1mg•ml-1,或温度较高时,Pb2+将不在第一组沉淀,而进入第二组。
3.如果以KI代替HCl作为第一组组试剂,将产生哪些后果?答:如果以KI代替HCl作为第一组组试剂时,酸度太小,第二组易水解的阳离子将水解进入第一组,达不到分离的目的。
另外具有氧化性阳离子将与I-发生氧化还原反应,使这些离子的浓度降低不能鉴出。
实验二阳离子第二组(铜锡组)的分析思考题:1.沉淀本组硫化物时,在调节酸度上发生了偏高或偏低现象,将会引起哪些后果?答:沉淀本组硫化物,若酸度偏低时,第三组阳离子Zn2+将生成ZnS 沉淀进入第二组。
若酸度偏高时,本组的Cd2+不生成硫化物沉淀而进入第三组。
2.在本实验中为沉淀硫化物而调节酸度时,为什么先调至0.6mol·L-1HCl酸度,然后再稀释一倍,使最后的酸度为0.2 mol·L-1?答:因As(III)的硫化物完全沉淀需在0.6 mol·L-1HCl酸度下,Cd2+的硫化物完全沉淀需在0.2 mol·L-1HCl酸度下。
因此为了使本组离子完全生成硫化物沉淀而与第三组阳离子分离,所以在调节酸度时,先调至0.6 mol·L-1HCl酸度,然后再稀释一倍,使最后的酸度为0.2 mol·L-1。
3.以TAA代替H2S作为第二组组试剂时,为什么可以不加H2O2和NH4I?答:以TAA代替H2S作为第二组组试剂时,因TAA在90℃及酸性溶液中,可在沉淀时间内将As(V)还原为As(III),故不需另加NH4I。
第三节第二组阳离子的分析(重点)本组包括Pb2+、Bi3+、Cu2+、Cd2+、Hg2+、As(ⅢⅤ)、Sb(ⅢⅤ)、Sn(ⅡⅣ)离子,称为铜锡组。
它们的共同特点是不被HCl溶液沉淀(Pb2+是很少量的(小于1mg·mL-1),不能被HCl沉淀),但在·L-1HCl溶液中,可与H2S反应生成硫化物沉淀。
按照本组分出的顺序,称为第二组;按照所用的组试剂,称为硫化氢组。
一、本组离子的分析特性1.离子的颜色本组离子中,除Cu2+为蓝色外,其余均无色。
2.离子的存在形式铅、铋、铜、镉、汞具有显著的金属性质,在水溶液中主要以金属阳离子的形式存在;而砷、锑、锡三种元素则表现出不同程度的非金属性质,它们在溶液中的主要存在形式随酸碱环境而不同,主要以阴离子形式存在于溶液中。
但由于存在下述平衡AsO33-+6H+=As3++3H2OSbCl63-= Sb3++ 6C1-SnCl42-=Sn2++4Cl-溶液中也或多或少地存在着简单阳离子,并能生成相应的硫化物(如SnS2、As2S3等),所以这些元素还是作为阳离子来研究。
鉴定时并不严格区分它们的存在形式,只是泛指该元素,书写时只标出其氧化数,而不具体指明其存在形式。
3.加水稀释Bi3+、Sb(ⅢⅤ)、Sn(ⅡⅣ)离子(见前表)4.络合物本组离子一般都能生成多种络合物。
其中最常见的是氯络离子,因而大量Cl-存在时可影响到各简单离子的浓度。
另外,Cu2+、Cd2+等能生成氨或氰络离子:Cu(NH3)42+、Cd(NH3)42+、Cu(CN)42+、Cd(CN)42+,它们在Cu2+、Cd2+的分离和鉴定上有很多应用。
Bi3+与I-生成黄色的BiI4-;用于铋的鉴定。
Cu2+、Pb2+和Bi3+能与甘油生成络离子;Hg2+与I-生成无色的HgI42-,它与KOH 一起的溶液,可用于NH4+的鉴定,称为奈氏试剂。
这些都具有一定的分析应用价值。
5.氧化还原性质砷、锑、锡三元素的离子具有两种比较稳定的价态,它们在分析上都具有重要的意义。
例如,As(V)在冷而稀的HCl溶液中,与H2S通过一系列的反应,最终得到的是As2S3↓,但这个过程速率较慢,为了加速反应,先将As(V)还原为As(Ⅲ)。
通常使用NH4I来还原。
另外,Sn(Ⅱ)还原性较强,很容易被氧化为Sn(Ⅳ)。
而且SnS不溶于Na2S,而SnS2能溶于Na2S,这样在进一步分组时,把一种元素分在两个组中,将Sn(Ⅱ)归于ⅡA而Sn(Ⅳ)归于ⅡB组,将使操作不便,故一般在进行沉淀之前加入H2O2将Sn(Ⅱ)全部氧化成Sn(Ⅳ),并加热将剩余的H2O2除去。
锑的罗丹明B试法只对Sb(Ⅴ)有效,若溶液中的锑为三价则必须事先氧化。
此外,将Bi3+还原为金属Bi是铋的重要鉴定反应之一。
6.与H2S的反应及本组硫化物性质PbS Bi2S3CuS CdS HgS As2S3Sb2S3SnS SnS2颜色黑黑褐黑黄黑黄桔红棕黄稀硝酸√√√√王水√√√√浓盐酸√√√√稀盐酸√(△)√Na2S HgS22-AsS33-SbS33-SnS32-(NH4)2S√√√NaOH AsO33-+√√AsS33-氨水√极微溶(NH4)2CO3√沉淀的性状:易成胶体。
沉淀的溶解度:CdS最大。
二、组试剂与分离条件本组与第三、四组离子分离的依据是其硫化物溶解度有显著的差异。
事实上,除本组能形成MS沉淀,第三组大多数离子也能沉淀为硫化物。
如何使本组沉淀完全,又不使第三组离子混入这就是要讨论的分离条件――组试剂的作用条件。
通过对溶解度进行比较可以得出,第二组中溶解度最大的硫化物沉淀是CdS(K SP=×10-28),第三组中溶解度最小的硫化物沉淀是ZnS(K SP=×10-23),比第二组大了大约五个数量级,因此,按照沉淀规律,溶解度小的首先沉淀,溶解度大的不沉淀而留在溶液中,从而达到分离的目的。
也就是说:当第二组中最难沉淀的CdS 都沉淀完全时,第二组其它离子也就沉淀完全,第三组中最容易沉淀的ZnS 没有开始沉淀,第三组其它离子也就没开始沉淀。
由此可见,分离第二组、第三组的关键是使CdS 沉淀完全,ZnS 不沉淀。
从平衡关系来看,这点可通过调整酸度、控制S 2-来实现。
为了将本组比较完全地同第三组分开,我们需要讨论以下几个问题。
(一) 沉淀要求的酸度 1.适宜的酸度范围要达到这个目的,根据溶度积关系:K SP =[M 2+][S 2-],在金属离子浓度一定的情况下,是否发生沉淀反应,取决于溶液中[S 2-],由于H 2S 是弱酸,[S 2-]是随溶液酸度变化而变化,因此,可以通过调节酸度来控制溶液中S 2-的浓度,从而达到分步沉淀的目的。
根据平衡:H 2S =H ++HS 2- K 1=×10-7 HS -=H ++S 2- K 2=×10-15 K 1K 2=[H +]2[S 2-]/[H 2S]=×10-22室温下,饱和H 2S 溶液中[H 2S]≈·L -1 所以,[H +]2[S 2-]=×10-23 [S 2-]=×10-23/[H +]2结论:①稍改变H +,便可大幅度改变[S 2-],如H +改变10倍,[S 2-]将改变100倍。
②直接控制[S 2-]难办到,但改变H +易办到。
③由[H +]2[S 2-]=×10-23和[M][S]=Ksp ,可求出理论上的分离条件。
[H +]=Ksp109.2[M]-23⨯⋅关键1:使第二组的Cd 2+沉淀完全,即要求[Cd 2+]=10-5mol ·L -1,溶液中应达到[H +]=2723-510810910--⨯⨯⨯2. =L意味着只要酸度小于·L -1,就能使第二组离子沉淀完全。
若溶液的酸度过高,第二组中溶解度较大的CdS 、SnS 和PbS 将沉淀不完全或者不沉淀而进入第三组中。
关键2:使第三组Zn2+不沉淀,第三组中最容易沉淀的是ZnS。
在一般鉴定反应中,离子的浓度在·L-1左右,所以设定[Zn2+]=·L-1[H+]= 222310 2109--⨯⨯⨯2.1.=L意味着只要酸度大于·L-1,第三组离子就没有一个能沉淀。
如果酸度太低第三组溶解度最小的硫化物ZnS(K SP=×10-23)则可能析出沉淀而进入第二组中。
结论:①综合起来考虑,理论上酸度应控制在~·L-1。
事实上,沉淀本组硫化物的最适宜的酸度,是通过实验方法测得的,实验证明,分离第二组与第三组最适宜的酸度是·L-1HCl。
②实验中必须认真查对酸度。
2.酸度对砷、锑和锡的硫化物的影响酸度过低对形成砷、锑和锡的硫化物很不利。
这是因为:(1)它们只有在酸性环境中才能产生出生成硫化物所必需的简单阳离子。
以砷为例:AsO33-+6H+=As3++3H2O锑盐和锡盐的情况与此类似。
(2)在中性或碱性溶液中,上述三种离子砷、锑和锡同S2-生成硫代酸盐,而不是生成硫化物沉淀。
3.沉淀的后期处理需要指出的是,在硫化物沉淀的过程中会不断有H+释放出来,例如Cu2++H2S=CuS↓+2H+使得后期溶液的酸度有所增高。
为了抵消这个变化,在通H2S的后期应将溶液适当地加以稀释,稀释的程度与沉淀量有关,一般稀释1倍即可。
(二) 五价砷的沉淀在冷的稀HCl溶液中,三价砷可以很快地同H2S生成As2S3沉淀,2As3++H2S=As2S3↓而五价砷却并不直接与H2S生成As2S5沉淀,而是通过下列三个步骤最后以As2S3的形式析出:H3AsO4+H2S=H3AsO3S+H2OH3AsO3S=H3AsO3+S↓2H3AsO3+3H2S=As2S3+6H2O这个过程是很慢的。
为了加速反应,可以把溶液加热或在溶液中加入I-,先使五价砷还原为三价砷:AsO43-+2I-+2H+=AsO33-+I2+H2OI-转变为I2后,与H2S反应还可再生出来:I2+H2S=2I-+2H++S↓可见,不需要加得太多。
一般使用NH4I,没有NH4I时也可以用碘酒来代替,后者可被H2S还原为I-。
若改用TAA,就不必另NH4I,TAA可还原五价砷。
(三) 防止硫化物生成胶体(沉淀时的温度)硫化物,特别是IIB组硫化物生成胶体的倾向较大,为了防止这一现象发生,第一,要保持溶液的适当酸度,以促进胶体的凝聚(这个目的在调节酸度时即已达到);第二,硫化物沉淀要在热溶液中进行。
其目的是促进胶体凝聚和加速五价砷的还原。
但加热也会降低H2S的溶解度从而使S2-浓度减小,不利于溶解度较大的PbS、CdS等沉淀生成,所以最后还要把溶液冷却至室温,再通H2S。
(四) 二价锡的氧化本组内部分离时,SnS不溶于Na2S,SnⅡ属于IIA组;SnS2溶于Na2S,SnⅣ属于IIB组,同一元素的不同价态分属两个组,组分析带来不便。
为使SnⅡ全部转化SnⅣ,可在通人H2S之前加H2O2将SnⅡ氧化为SnⅣ然后将过剩的H2O2加热分解,以免以后与H2S发生作用。
综上所述,本组离子沉淀的详细步骤如下:1.在酸性溶液中先加H2O2将SnⅡ→SnⅣ,然后,加热使过量H2O2分解;2.用NH3·H2O(在系统分析中,由于分出第一组阳离子的氯化物沉淀后,溶液的酸性较强,故需先用氨水中和,再用盐酸调至所需酸度)和HCl 调节[H +]=·L -1;3.加入少许NH 4I ,还原As Ⅴ、Sb Ⅴ为As Ⅲ、Sb Ⅲ; 4.加热,通H 2S ,防止生成胶体;5.冷却,将试液稀释一倍,然后通H 2S 至沉淀完全。
(使用硫代乙酰胺时,将试液稀释一倍后酸度应为L)。
(五) 硫代乙酰胺CH 3CSNH 2由于H 2S 气体毒性较大,制备也不方便,故近年来已不再使用,而改用其替代品—硫代乙酰胺CH 3CSNH 2(通常简写为TAA)的水溶液代替H 2S 作沉淀剂。
硫代乙酰胺在酸性溶液中水解产生H 2S 。
硫代乙酰胺水溶液在常温下比较稳定,可长期存放,只有在加热时才能发生水解反应。
硫代乙酰胺水溶液在不同的介质中加热时发生不同的水解反应,可以分别代替H 2S 、(NH 4)2S 或Na 2S 。
在酸性溶液中水解产生H 2S ,可代替H 2S: CH 3CSNH 2+H ++2H 2O =CH 3COOH+NH 4++H 2S ↑在氨性溶液中水解生成HS -,相当于(NH 4)2S 的作用:-+++=-∆+HS NH NH C CH NH CSNH CH 433232NH 2在碱性溶液中水解生成S 2-,可代替Na 2S 使用:---+++∆+2233233S O H NH COO CH OH CSNH CH 以硫代乙酰胺代替硫化氢作为组试剂具有以下特点:(1)由于水解过程较慢,同时硫代乙酰胺的沉淀作用属于均相(匀)沉淀,故所得硫化物一般具有良好的晶形,易于分离和洗涤,共沉淀现象较少。