第四组阳离子分析
- 格式:ppt
- 大小:629.00 KB
- 文档页数:19




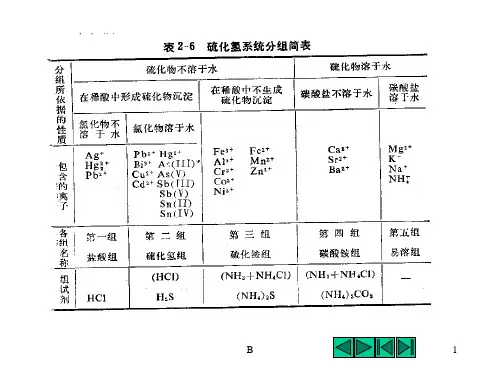

阳离子系统分析:常见阳离子:Ag +、Hg 2+、Hg 22+、Pb 2*、Bi 3+、Cu 2+、Cd 2+、As (3 价和 5 价卜 Sb (3 价和 5 价)、Sn (2 价和 4 价)、Al 3+、Cr 3+、Fe (2 价和 3 价)、Mn 2+、Zn 2+、Co 2+、Ni 2+、Ba 2+、Ca 2+、 Mg 2+、 K +、 Na +、 NH 4+系统分析步骤: 第一组、检验铅离子、亚汞离子、银离子。
1. 加入盐酸至有 0.6mol/L -1 的氯离子剩余,补加稀硝酸至氢离子约 2.0mol/L -1,如有白色沉淀,则为氯化铅(溶解度较大,下组仍要除去铅离子)、氯化亚汞、氯化银,剩余 滤液A 用 于下组分析。
2. 验铅离子: 沉淀加水加热并趁热过滤, 加入醋酸酸化, 加入铬酸钾产生黄色沉淀铬酸铅则 有铅离子; 3. 验银离子:以上剩余沉淀用热水洗净,加入氨水,分离滤液并用硝酸酸化,滤液产生白色沉淀氯化银则有银离子; 4. 验亚汞离子:以上第 3步剩余残渣如变黑则有 Hg 22+(HgNH 2Cl+Hg )。
第二组、检验铅离子、铋离子、铜离子、镉离子、三价砷、汞离子、三价锑、四价锡。
1.往滤液A 中加入0.3mol/L -1的盐酸,通入硫化氢,加热,产生沉淀:PbS CuS HgS 均为 黑色,黑褐色Bi 2$、黄色的CdS 和SnS 、淡黄色AS 2S 3、橙红色S6S 3,剩余滤液B 用于下组 分析。
2 (铅、铋、铜、镉离子的检验)•过滤以上沉淀,加入过量硫化钠,得 沉淀A (组成有硫化 2- 3- 3-2- 铅、三硫化二铋、硫化铜、硫化镉 )和滤液C (组成有HgS -、AsS s -、SbS -、Sn S -)。
3 (铅、铋、铜、镉离子的检验)•往沉淀A 中加入6摩尔每升硝酸,沉淀溶解,在加入 1:1的甘油和过量的浓氢氧化钠,如有黄色沉淀为氢氧化镉,分离出 滤液 D 待检验,沉淀用 3 摩尔每升盐酸溶解,再稀释3倍,加入硫代乙酰胺(CHCSNH )加热,生成黄色沉淀硫化镉则有镉离子。


教案2013~2014学年课程名称分析化学院(系)化学与环境科学学院教研室(实验室) 化学系授课班级主讲教师职称副教授使用教材华中师大等编《分析化学(上册)》兰州城市学院化学与环境科学学院制教案(首页)注:课程类别:公共基础课、专业基础课、专业必修课、专业选修课、集中实践环节、实验课、公共选修课教学内容:第一章绪论一、分析化学的任务和作用1.分析化学的任务分析化学是研究关于物质的化学结构、化学组成及测定方法的一门学科。
它是化学科学的一个重要分支。
定性分析的任务:就是鉴定物质的化学结构和化学组成。
定量分析的任务:就是测定物质中各组分的相对含量。
2.分析化学的作用分析化学作为一门学科,对于化学本身的发展起过重大作用。
化学上的基本定律都是依靠大量的分析实验数据才得以创立和发展起来的,而其它各门学科的发展又进一步推动了分析化学的发展。
分析化学对工业、农业、国防和科学技术的发展都有重要的作用。
分析化学在高等学校理、工、农、医、师范各有关专业中,是一门重要的化学基础课。
三、定量分析的方法1.按对象分2.按操作方法分类3.按试样用量分类4.根据被测组分含量分类5.其它专有名词四、分析化学的发展趋势(一)分析化学的发展简史(二)当前的发展趋势第二章定性分析教学内容:§2-1 概述一、定性分析的任务和方法1.任务:鉴定物质中所含有的组分。
2.方法⑴干法:指分析反应在固体之间进行。
⑵湿法:指分析反应在溶液之间进行。
(主要学习湿法分析)二、定性分析反应进行的条件共5点三、鉴定方法的灵敏度和选择性1.鉴定方法的灵敏度鉴定反应的灵敏度常用“最低浓度”和“检出限量”来表示。
⑴最低浓度⑵检出限量⑶检出限量和最低浓度之间的关系2.鉴定反应的选择性四、空白试验和对照试验空白试验:用配制试液用的蒸馏水代替试液,用同样的方法和条件重做试验进行鉴定,就叫做空白试验。
对照试验:用已知溶液代替试液,用同样方法进行鉴定,就叫做对照试验。


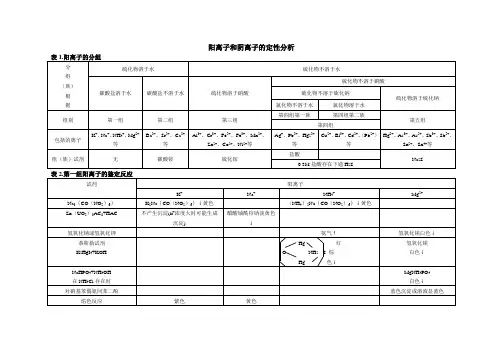
阳离子系统分析:常见阳离子:Ag+、Hg2+、Hg22+、Pb2+、Bi3+、Cu2+、Cd2+、As(3价和5价)、Sb(3价和5价)、Sn(2价和4价)、Al3+、Cr3+、Fe(2价和3价)、Mn2+、Zn2+、Co2+、Ni2+、Ba2+、Ca2+、Mg2+、K+、Na+、NH4+系统分析步骤:第一组、检验铅离子、亚汞离子、银离子。
1.加入盐酸至有0.6mol/L-1的氯离子剩余,补加稀硝酸至氢离子约2.0mol/L-1,如有白色沉淀,则为氯化铅(溶解度较大,下组仍要除去铅离子)、氯化亚汞、氯化银,剩余滤液A用于下组分析。
2.验铅离子:沉淀加水加热并趁热过滤,加入醋酸酸化,加入铬酸钾产生黄色沉淀铬酸铅则有铅离子;3.验银离子:以上剩余沉淀用热水洗净,加入氨水,分离滤液并用硝酸酸化,滤液产生白色沉淀氯化银则有银离子;4.验亚汞离子:以上第3步剩余残渣如变黑则有Hg22+(HgNH2Cl+Hg)。
第二组、检验铅离子、铋离子、铜离子、镉离子、三价砷、汞离子、三价锑、四价锡。
1.往滤液A中加入0.3mol/L-1的盐酸,通入硫化氢,加热,产生沉淀:PbS、CuS、HgS均为黑色,黑褐色Bi2S3、黄色的CdS和SnS2、淡黄色As2S3、橙红色Sb2S3,剩余滤液B用于下组分析。
2(铅、铋、铜、镉离子的检验).过滤以上沉淀,加入过量硫化钠,得沉淀A(组成有硫化铅、三硫化二铋、硫化铜、硫化镉)和滤液C(组成有HgS22-、AsS33-、SbS33-、SnS32-)。
3(铅、铋、铜、镉离子的检验).往沉淀A中加入6摩尔每升硝酸,沉淀溶解,在加入1:1的甘油和过量的浓氢氧化钠,如有黄色沉淀为氢氧化镉,分离出滤液D待检验,沉淀用3摩尔每升盐酸溶解,再稀释3倍,加入硫代乙酰胺(CH3CSNH2)加热,生成黄色沉淀硫化镉则有镉离子。
4(铅、铋、铜、镉离子的检验).滤液D加入醋酸酸化,再加亚铁氰化钾变红棕色(Cu2Fe (CN)6)则有铜离子。
实验一阳离子第一组(银组)的分析思考题:1.沉淀第一组阳离子为什么要在酸性溶液中进行?若在碱性条件下进行,将会发生什么后果?答:在系统分析中,为了防止易水解离子的水解生成沉淀而进入第一组,所以沉淀第一组阳离子时要在酸性溶液中进行。
若在碱性条件下进行,第一组以后的大部分阳离子将生成沉淀,这样就不到分离的目的。
2.向未知溶液中加入第一组组试剂HCl时,未生成沉淀,是否表示第一组阳离子都不存在?答:向未知试液中加入第一组组试剂时,未生成沉淀,只能说明Ag+,Hg22+不存在,而不能说明Pb2+不存在,因为当试液中Pb2+的浓度小于1mg•ml-1,或温度较高时,Pb2+将不在第一组沉淀,而进入第二组。
3.如果以KI代替HCl作为第一组组试剂,将产生哪些后果?答:如果以KI代替HCl作为第一组组试剂时,酸度太小,第二组易水解的阳离子将水解进入第一组,达不到分离的目的。
另外具有氧化性阳离子将与I-发生氧化还原反应,使这些离子的浓度降低不能鉴出。
实验二阳离子第二组(铜锡组)的分析思考题:1.沉淀本组硫化物时,在调节酸度上发生了偏高或偏低现象,将会引起哪些后果?答:沉淀本组硫化物,若酸度偏低时,第三组阳离子Zn2+将生成ZnS 沉淀进入第二组。
若酸度偏高时,本组的Cd2+不生成硫化物沉淀而进入第三组。
2.在本实验中为沉淀硫化物而调节酸度时,为什么先调至0.6mol·L-1HCl酸度,然后再稀释一倍,使最后的酸度为0.2 mol·L-1?答:因As(III)的硫化物完全沉淀需在0.6 mol·L-1HCl酸度下,Cd2+的硫化物完全沉淀需在0.2 mol·L-1HCl酸度下。
因此为了使本组离子完全生成硫化物沉淀而与第三组阳离子分离,所以在调节酸度时,先调至0.6 mol·L-1HCl酸度,然后再稀释一倍,使最后的酸度为0.2 mol·L-1。
3.以TAA代替H2S作为第二组组试剂时,为什么可以不加H2O2和NH4I?答:以TAA代替H2S作为第二组组试剂时,因TAA在90℃及酸性溶液中,可在沉淀时间内将As(V)还原为As(III),故不需另加NH4I。
一、实验目的1、能叙述第四组阳离子分组的依据;2、制定第四组阳离子的分析方案。
3、通过鉴定反应能区分出本组离子,记住各离子及其化合物颜色,学会沉淀是否完全的检查,沉淀的洗涤,沉淀与溶液分离等基本操作;4、对实验室的废液排放进行分析处理,树立环保意识。
二、实验内容1、第四组阳离子的分别鉴定2、第四组阳离子的混合液分析与鉴定三、实验主要仪器和材料实验仪器:离心机、试管、烧杯、离心试管、恒温水浴锅+、Ca2+、Mg2+、Sr+)、6mol/L氨水,实验药品:浓度为10mg/ml的(K+、Na+、NH43mol/LHCl, Na3【Co(NO3)6】、6mol/LNaOH、饱和(NH4)SO4溶液、K2CrO4溶液、镁试剂、2mol/LNaOH四、实验步骤(一)钙钠组离子的鉴定反应(二)混合离子的分析.五.注意事项1、在检验K+、Ca2+时需要去除NH4+,才能正常检验。
2、在调pH时,酸或碱需要慢慢加入,不宜太快。
3、在进行水浴加热时,加热时间不宜过长或过短。
加热时间过短容易造成反应不完全;加热时间过长,容易造成反应物分解等。
4、如果加入沉淀剂,沉淀并未生成,需要先检查pH是否准确,和是否有干扰离子。
5、在进行每一次离心过后,需要检验离子是否沉淀完全?如若不完全,再次滴入沉淀剂进行沉淀,直至完全沉淀为止。
6、在进行沉淀洗涤时,选择恰当的洗涤液,避免导致鉴定离子损耗过大,影响后续实验。
六.思考题1、(1)NaOH (2)(NH4)2SO4(3) HAc (4) (NH4)2SO42、因为在后面的检验中需要加入NH4+,为了检验NH4+在原试液中是否含有,所以需要提前检验。
3、NH4+会和鉴定试剂反应,影响其他离子的鉴定七、讨论讨论主要是分析实验现象或实验数据产生的误差原因,对实验中遇到的疑难问题提出自己的见解,对有关实验方法、实验内容、教学活动等提出意见或建议。
1、在进行实验时,实验现象不明显,主要有以下几个原因:(1)加热时间过长或加热时间过短。