细胞染色操作步骤及注意事项
- 格式:docx
- 大小:37.07 KB
- 文档页数:3
Masson三色染色液染色步骤及注意事项
号:G1340
规格:7×50ml/7×100ml
有效期:12个月有效
产品简介:
结缔组织狭义上是指其含有的三种纤维:胶原纤维、网状纤维、弹力纤维、而胶原纤维(collagenfiber)是分布最广、含量最多的一种纤维。Masson三色染色又称马松染色,是结缔组织染色中最经典的一种方法,是胶原纤维染色权威而经典的技术方法。所谓三色染色通常是指染胞核和能选择性的显示胶原纤维和肌纤维。该法染色原理与阴离子染料分子的大小和组织的渗透有关:分子的大小由分子量来体现,小分子量易穿透结构致密、渗透性低的组织,而大分子量则只能进入结构疏松的、渗透性高的组织。然而,淡绿或苯胺蓝的分子量很大,因此Masson染色后肌纤维呈红色,胶原纤维呈绿色或蓝色,主要用于区分胶原纤维和肌纤维。
Masson试剂盒的特点:◆染色稳定;◆分化时间短,1-2秒;◆色彩清楚鲜艳;◆使用范围广,适宜于组织的石蜡切片、冰冻切片等染色;◆所染切片保存时间长且不易褪色。
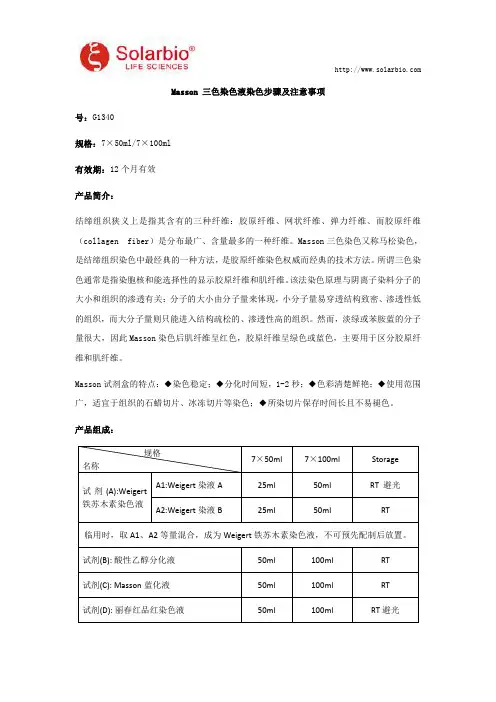
产品组成:规格名称7×50ml7×100mlStorage
试剂(A):Weigert铁苏木素染色液A1:Weigert染液A25ml50mlRT避光A2:Weigert染液B25ml50mlRT
临用时,取A1、A2等量混合,成为Weigert铁苏木素染色液,不可预先配制后放置。试剂(B):酸性乙醇分化液50ml100mlRT试剂(C):Masson蓝化液50ml100mlRT试剂(D):丽春红品红染色液50ml100mlRT避光试剂(E):弱酸溶液50ml100mlRT试剂(F):磷钼酸溶液50ml100mlRT避光试剂(G):苯胺蓝染色液50ml100mlRT避光使用说明书1份
自备材料:
固定液:选用甲醛升汞或甲醛盐溶液、蒸馏水、系列乙醇、二甲苯、染缸
操作步骤(仅供参考):

软骨染色液(甲苯胺蓝法)染色步骤及注意事项
货号:G2543
规格:100ml
保存:室温,避光,12个月。产品说明:
甲苯胺蓝(ToluidineBlueO)是一种常用的人工合成染料,属于醌亚胺染料类。这类染料主
要含有胺基和醌型苯环两个发色团,从而成色原显色。甲苯胺蓝中的阳离子有染色作用,组
织细胞的酸性物质与其中的阳离子相结合而被染色。甲苯胺蓝不仅含有两个发色团,还含有
两个助色团,能促使染料产生电离成盐类,帮助发色团对组织产生染色力,使切片上的组织
细胞着色,可染细胞核使之呈蓝色;肥大细胞胞质内含有肝素和组织胺等异色性物质遇到甲
苯胺蓝可呈异染性紫红色。甲苯胺蓝染色液(甲苯胺蓝法)呈强碱性,更利于组织细胞的着色。
操作说明:(仅供参考)1、常规脱钙,包埋,固定。
2、石蜡切片入二甲苯2次。
3、系列乙醇各1min。自来水洗2min。
4、入ToluidineBlueOStain浸染30min。根据不同组织,染色时间不完全相同。
5、自来水洗2min,滤纸吸干水分。
6、丙酮分化至软骨细胞呈紫蓝色清楚可见。
7、逐级乙醇脱水。
8、二甲苯透明,中性树胶封固。
染色结果:
软骨、成骨细胞呈紫红色;背景呈淡蓝色。
注意事项:1、第一次使用本试剂时建议先取1-2个样品做预实验。
2、针对于胃粘膜组织、软骨组织等较难着色组织的染色,浸染于甲苯胺蓝染色液的时间应
相应延长。
3、为了您的安全和健康,请穿实验服并戴一次性手套操作。
相关试剂:
G3661甲苯胺蓝染色液(1%,磷酸盐法)
G3662甲苯胺蓝染色液(0.5%,磷酸盐法)
G3665甲苯胺蓝染色液(0.5%,硼酸盐法)
AB-PAS染色试剂盒操作步骤及注意事项
AB-PAS染色试剂盒
货号:G1285
有效期:6个月有效。
产品简介:
糖原染色是病理学中常规的染色方法之一,McManus在1946年最先使用高碘酸-雪夫技术显示黏蛋白,该法常用来显示糖原和其他多糖,该染色液不仅能够显示糖原,还能显示中性黏液性物质和某些酸性物质。
阿利新蓝和PAS技术联合使用可鉴别同一组织切片中的中性黏蛋白和酸性黏蛋白。这种技术也常用作广泛检测黏蛋白的手段。该技术染色阴性,可明确断定该物质不是黏蛋白。在大多数方法中,切片先经标准的阿利新蓝(pH值为2.5)染色,在使用PAS技术。阿利新蓝可将唾液黏蛋白、硫黏蛋白和蛋白多糖染成蓝色。PAS技术可将中性黏蛋白染成深红/红紫色,同时将既含中性黏蛋白有含酸性黏蛋白的组织和细胞染成深浅不同的紫色,这是有于阿利新蓝与Schiff试剂结合并反应。上述染色常可出现在含有中性黏蛋白和唾液黏蛋白的小肠杯状细胞中。
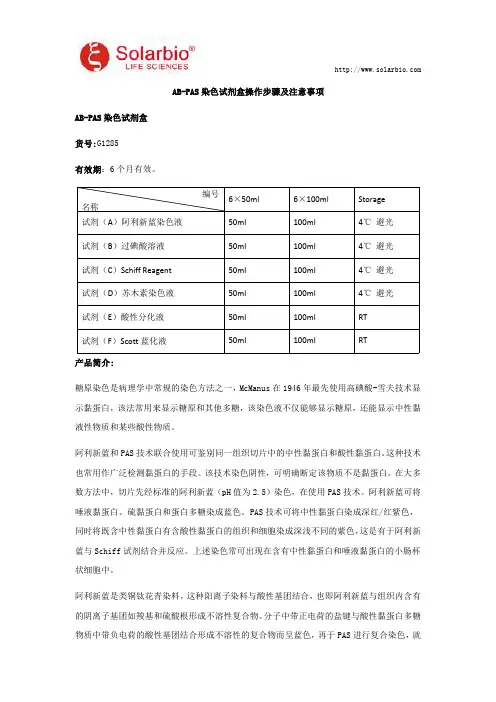
阿利新蓝是类铜钛花青染料,这种阳离子染料与酸性基团结合,也即阿利新蓝与组织内含有的阴离子基团如羧基和硫酸根形成不溶性复合物。分子中带正电荷的盐键与酸性黏蛋白多糖物质中带负电荷的酸性基团结合形成不溶性的复合物而呈蓝色,再于PAS进行复合染色,就编号名称6×50ml6×100mlStorage试剂(A)阿利新蓝染色液50ml100ml4℃避光试剂(B)过碘酸溶液50ml100ml4℃避光试剂(C)SchiffReagent50ml100ml4℃避光试剂(D)苏木素染色液50ml100ml4℃避光试剂(E)酸性分化液50ml100mlRT试剂(F)Scott蓝化液50ml100mlRT
能显示三种不同黏液物质成分。
自备材料:
1、蒸馏水
2、系列乙醇
操作步骤(仅供参考)
1、脱蜡至水,蒸馏水水洗2min。
2、阿利新蓝染色液染色10-20min。

细胞复苏步骤注意事项:
【材料】
1. 常规细胞培养仪器设备 恒温水浴振荡器。
2. 培养液(DMEM)胎牛血清(CBS)二甲基亚砜(DMSO)
【操作程序】
1. 细胞实验室进行常规消毒,紫外照射40min以上。
2. 培养液(DMEM)、0.25%胰蛋白酶(Trypsin)恒温水浴箱370C预热20min,备用。
3. 二甲基亚砜(DMSO)在40C冰箱中冷藏30min,备用。
4. 从液氮保存罐中取出冻存管,立即放入400C水浴中,快速摇晃,直至冻存液完全融化。
5. 将细胞悬液移入15ml离心管,缓慢加入4ml培养液,离心(1000r/min,5min)。
6. 用培养液悬液混悬沉淀细胞,调整细胞浓度,方培养箱中培养。
7. 记录复苏日期。
【注意事项】
1. 取细胞的过程中注意带好防冻手套,护目镜。此项尤为重要,细胞冻存管可能漏入液氮,
解冻时冻存管中的气温急剧上升,可导致爆炸。
2. 冻存液的问题:冻存液的配置已是常识,在这里不作详述,但二甲基亚砜(DMSO)对
细胞不是完全无毒副作用,在常温下,二甲基亚砜对细胞的毒副作 较大,因此,必须在1-2min
内使冻存液完全融化。如果复苏温度太慢,会造成细胞的损伤,二甲基亚砜(DMSO)最好
选择进口产品。
3. 离心前须加入少量培养液。细胞解冻后二甲基亚砜浓度较高,注意加入少量培养液可稀
释其浓度,以减少对细胞的损伤。
4. 离心问题:目前主要有两种见解。一种是解冻后的细胞悬液直接吹打均匀后分装到培养
瓶中进行培养,第二天换液。因为离心的目的是两个,去除 DMSO,去除死细胞,这个是
标准流程,但对一般人来说,把握不好离心转速和时间,转的不够活细胞沉底的少,细胞就
全被扔掉了,转过了活细胞会受压过大, 死亡。此外在操作过程中容易污染,所以不推荐。
另一种说法为细胞悬液中含有二甲基亚砜(DMSO),DMSO对细胞有一定的毒副作用,所
以须将离心后的液 体前倒净,且一定倒干净。我在试验中按照常规的离心分装的方法进行

贴壁细胞培养步骤
一、复苏
1. 把冻存管从液氮中取出来,立即投入37℃水浴锅中,轻微摇动。液体都融化后(大概1-1.5分钟),拿出来喷点酒精放到超净工作台里。
2. 把上述细胞悬液吸到装有10ml培养基的15ml的离心管中(用培养基把冻存管洗一遍,把粘在壁上的细胞都洗下来),1000转离心5分钟。
3. 把上清液倒掉,加1ml培养基把细胞悬浮起来。吸到装有10ml培养基的10cm培养皿中前后左右轻轻摇动,使培养皿中的细胞均匀分布。
4. 标好细胞种类和日期、培养人名字等,放到CO2培养箱中培养,细胞贴壁后换培养基。
5. 3天换一次培养基(具体看细胞生长状态及培养液情况)。
二、传代
1. 培养皿中的细胞覆盖率达到80%-90%时要传代。
2. 把原有培养基吸掉。
3. 加入2毫升PBs洗两遍,最后吸净培养皿中的PBS
4. 加适当的胰蛋白酶(能覆盖细胞就行),消化(消化时长看情况而定)。
5. 当看到细胞开始脱离培养皿时倒掉酶液,加入2毫升左右含血清的培养基终止消化。
6. 用移液枪吹打细胞,把细胞都悬浮起来。
7. 把细胞吸到15ml的离心管中,1000转离心5分钟。
8. 倒掉上清液,加1-2ml培养基,把细胞都吹起来。
9. 根据细胞种类把细胞传到几个培养皿中。一般,癌细胞分5个,正常细胞传3个,继续培养。
10. 若是只培养一皿,只需吹散后倒剩1/4左右,重新加入培养液继续培养。
三、冻存
1. 把原有培养基吸掉。
2. 加入2毫升PBs洗两遍,最后吸净培养皿中的PBS
3. 加适当的胰蛋白酶(能覆盖细胞就行),消化(消化时长看情况而定)。
4. 去掉酶液,加入2毫升左右含血清的培养基终止消化。
5. 吹落后把细胞吸到15ml的离心管中,1000转离心5分钟。
6. 加入1毫升冻存液悬浮细胞,装到灭菌的冻存管中,静止几分钟,写明细胞种类,冻存日期。
7. 4℃ 30min, -80℃过夜,然后放到液氮灌中保存。

翻车机操作步骤及注意事项
翻车机设备主要分为四大部分:重调机、翻车机、迁车台和空调机,共有三种操作模式:“集中手动”、“自动”和“就地调试”,正常情况下是在“集中手动”或“自动”模式下由主控工进行操作。翻车机在翻车过程中,主控工要严密监视现场设备运转情况,当设备出现故障或发生意外情况时要及时停机,并将翻车机转换到“集中手动”模式后,然后通知跟班维修人员维修。
翻车机各部分初始位:重调机停在“回退到位”处,翻车机停在“0度”,迁车台停在“空车线对准”处,空调机停在“返回到位”处。
翻车机设备启动步骤:变频器合闸、油泵合闸、自动启动。停机步骤与之相反。长时间不翻车要将变频器和油泵分闸,冬季油泵可以不停。
“集中手动”和“自动”操作步骤略,主要是“就地调试”操作。
一、重调机就地操作步骤及注意事项:
重调机运行动作顺序及具体步骤:重调机“抬臂到位”停在起始位“回退到位”处,按“接车”按钮——重调机接车,到“停车落臂”处停止——重调机落臂,前后钩同时提销——“落臂到位”且后钩“开到位”——接车,“后钩合到位”后停——牵车,到翻车机“进车口”(当非第一车时,重调机推空车,前钩合到位)——单车计4次(双车计8次)停——人工摘钩完毕后——牵车,到“单(双)车到位”,提后钩——牵车,到“前行到位”,提前钩——接车,到“回退到位”,抬臂——抬臂到位,至此重调机一个动作周期完成。
就地操作时需要注意的事项:
1、就地操作时,牵、接车一律使用低速。
2、在“停车落臂”处落臂时,要先确认重车没有溜车,大臂碰不到重车;接车时,确认后钩开到位,夹轮器送夹到位。
3、牵整列车:牵车时,要先确认翻车机在“0度”,并且“松压到位”、“松靠到位”,以及迁车台“重车线对准”、“插销到位”和“松涨到位”,迁车台上无车。
4、提后钩时,要确认重车停止翻车机中心,前后端未露出翻车机本体。
5、提前钩时,要确认空车确实已全部推倒迁车台上。

1 抛光机调试操作步骤及注意事项
1.1 操作步骤
1、开机,旋开“急停”按钮;
2、调整水槽卡位将水槽适当卡牢,记录各卡位数据,对卡尺位置进行拍照(注:将落水孔对准转盘中心);
3、对程序名进行编号,“复位”至原位;
4、调整磨轮深度,注意调整传感器下限位置及螺杆位置;
5、将已有数据“数据清零”,按下“调试停止”,“调试启动”灯亮,调试开始,步骤如下:
① “磨轮前”,将磨轮前移适当位置;
② “工件正”将工件旋转一定角度;
③ “磨轮后”,将磨轮后移适当位置,使磨轮与水槽圆弧处紧密接触。
6、完成调试,对数据进行“监视”,检查是否有异常数据出现。如果有,对其进行修正;
7、修正完成后,按下“调试启动”,调试启动灯灭,调试结束;”调为“自动”挡,再“复位”,开启“自动启动”,对水槽进行试抛;
8、检查抛光效果,进行修正,完成调试。
1.2 注意事项
1、调试过程中,切勿按下“磨轮停”键;
2、只有当磨轮前移至传感器前限位点位置时,“磨轮降”操作才能进行;
3、在转角处尽量将磨轮压紧,并修正转角位置;
4、在宽边与窄边交接处,切换磨轮转速;
5、在调整水槽深度操作中,切勿将手置于螺杆下。
1.3工艺流程图
放产品水槽到夹具内开始按启动按钮磨头下移下移到位,磨轮启动、磨头前移到水槽后缘工件回零点到位,回起始点产品退后移到位,磨头前移到水槽中心点前移到位,工件转动一个角度工件未转到终点位工件转到终点位磨头回到水槽中心点位中点到位,磨轮上升磨轮上升2秒,磨头停止上升到位,磨头后移,工件回到起始点拿水槽
2更换水槽操作步骤
1、开机,旋开“急停”按钮;
2、根据已有数据调整水槽卡位;
3、选择对应程序;
4、调整磨轮深度,注意调整感应器位置及螺杆位置;
5、对程序数据进行“监视”,检查是否有异常数据出现。如果有,对其进行修正;
6、调整四个转角的位置与变速点位置;
7、对水槽进行试抛;
8、检查抛光效果,进行修正,完成更换。
细胞自噬染色检测试剂盒(MDC法)操作步骤及注意事项
货号:G0170
规格:100T
有效期:12个月有效。
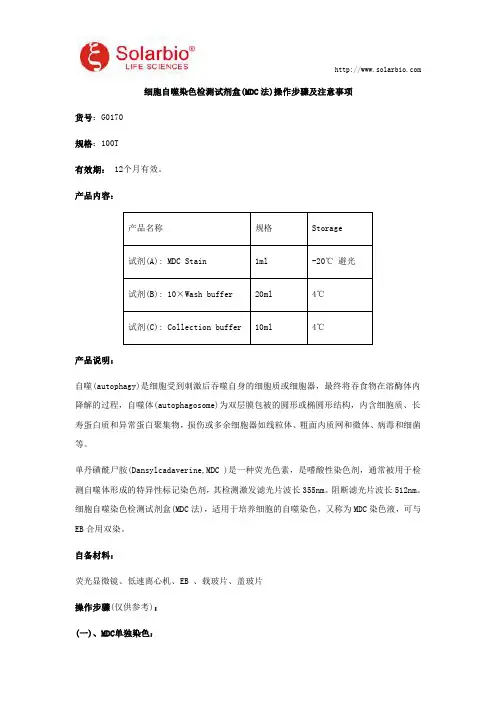
产品内容:产品名称规格Storage
试剂(A):MDCStain1ml-20℃避光
试剂(B):10×Washbuffer20ml4℃
试剂(C):Collectionbuffer10ml4℃
产品说明:
自噬(autophagy)是细胞受到刺激后吞噬自身的细胞质或细胞器,最终将吞食物在溶酶体内降解的过程,自噬体(autophagosome)为双层膜包被的圆形或椭圆形结构,内含细胞质、长寿蛋白质和异常蛋白聚集物,损伤或多余细胞器如线粒体、粗面内质网和微体、病毒和细菌等。
单丹磺酰尸胺(Dansylcadaverine,MDC)是一种荧光色素,是嗜酸性染色剂,通常被用于检测自噬体形成的特异性标记染色剂,其检测激发滤光片波长355nm。阻断滤光片波长512nm。细胞自噬染色检测试剂盒(MDC法),适用于培养细胞的自噬染色,又称为MDC染色液,可与EB合用双染。
自备材料:
荧光显微镜、低速离心机、EB、载玻片、盖玻片
操作步骤(仅供参考):
(一)、MDC单独染色:
1、用去离子水稀释10×Washbuffer至1×。
2、800g离心5min,收集细胞,用300~400μl的1×Washbuffer清洗细胞1次,弃上清。
3、加入适量的1×Washbuffer重悬细胞,计数并调节细胞浓度至106/ml。
4、取适量90μl的细胞悬液至新的EP管中,加入10μl的MDCStain,轻轻混匀。
5、室温避光染色15~45min。
6、800g离心5min,收集细胞,用300~400μl的1×Washbuffer清洗细胞2次,弃上清。
7、加入100μl的Collectionbuffer重悬细胞,滴加于载玻片上并加盖玻片。
8、荧光显微镜下观察(激发滤光片波长355nm,阻断滤光片波长512nm),计数并拍照。

PAS染色试剂盒操作步骤及注意事项
货号:G1280
规格:2×50ml/2×100ml
保存:2-8℃保存,避免光照,复检期为6个月。
试剂盒组成:
高碘酸液50ml/100ml
Schiff染液50ml/100ml
产品说明:
PAS染液(PeriodicAcid-Schiffstain)在组织学上,主要用来检测组织中的糖原或其他多糖物质。高碘酸是一种氧化剂,能将多糖分子中相邻的二醇基氧化成二醛基,醛基能与希夫试剂(Schiffreagent)反应生成红色不溶性复合物。
操作说明:(仅供参考)
1、染色步骤
1)切片脱蜡至水;
2)高碘酸液处理5-10分钟;
3)流水冲洗5分钟,擦干切片上多余水分;
4)滴加Schiff染液,染色10-15分钟;
5)流水清洗5-10分钟;
6)Mayer苏木素复染;
7)分化、水洗;返蓝、水洗;
8)常规脱水,二甲苯透明;
9)中性树胶封片。
2、显微镜观察结果:糖原、中性粘液物质呈红色,细胞核呈蓝色。
注意事项:
1.为了您的安全和健康,请穿实验服并戴一次性手套操作。
2.试剂均应低温保存,临用前半小时取出恢复室温。
3.高碘酸处理温度以不高于20℃为宜,室温高时,处理时间可适当缩短。Schiff染液染色时间可随温度调整,室温高可减少染色时间,冬季室温低,可延长至20分钟左右。
4.第一次使用本试剂时建议先取1-2个样品做预实验。

操作步骤
1、连接电源、气源(压缩气和氧气),湿化罐中加入灭菌注射用水并安装,正确紧密连接管道。
2、开机程序:依次打开压缩机开关→主机开关→湿化器开关。
3、根据病情遵医嘱选择呼吸模式和正确设置参数及报警范围。
4、接模拟肺,观察呼吸机运行是否正常。
5、脱模拟肺,将呼吸机和病人人工气道正确连接。
6、观察胸廓起伏,听诊两肺呼吸音,评估病人通气后状况。
7、严密观察神志、血氧饱和度、呼吸、循环、等各项指标,及时排除呼吸机故障,并作好记录。
8、通气半小时后抽动脉血气分析,根据血气结果调节参数。
9、掌握撤机指征,病人自主呼吸恢复,血气分析正常可试脱机。
10、备好氧气装置和呼吸囊。
11、脱开呼吸机,吸氧。
12、关机程序:脱机→关主机开关→压缩机开关→湿化器开关→拔电源、气源。
13、整理床单位,协助病人舒适体位。
14、清洁消毒呼吸机管道,清洁呼吸机表面。
15、洗手,正确记录护理单。
注意事项
1、清醒的病人给以解释,躁动的病人给以适当镇静或约束。
2、呼吸机管路连接正确。
3、湿化罐护理:保持湿化罐灭菌注射用水在所需刻度,保持吸入气温度在32℃~36℃。
4、保持集水杯处于低位,底处于朝下方向,及时倾倒集水。
5、调节呼吸机机臂时,先取下管道再安装,以免在调节过程中将导管拉出。
6、及时处理报警。
7、定期更换呼吸机管道,建议:48小时更换呼吸机管道。
8、合理消毒呼吸机各种管道。
呼吸机操作相关理论
1、相对禁忌证:(没有绝对禁忌证)
肺大泡、肺囊肿、气胸未行引流者、纵隔气肿、气管食管瘘、大咯血
2、根据病人病情及体重选择模式
控制通气 CMV IPPV
辅助通气 SIMV
自主通气 CPAP PSV
3、呼吸机通气模式
IPPV(间歇正压通气);

细胞凋亡实验步骤及注意事项
一、实验目的
1、掌屋凋亡细胞的形态特征
2、学会用荧光探针对细胞进行双标记来检测正常活细胞、凋亡细胞和坏死细胞的方法
二、实验原理
细胞死亡根据其性质、起源及生物学意义区分为凋亡和坏死两种不同类型。凋亡普遍存在于生命界,在生物个体和生存中起着非常重要的作用。它是细胞在一定生理条件下一系列顺序发生事件的组合,是细胞遵循一定规律自己结束生命的自主控制过程。细胞凋亡具有可鉴别的形态学和生物化学特征。
在形态上可见凋亡细胞与周围细胞脱离接触,细胞变园,细胞膜向内皱缩、胞浆浓缩、内质网扩张、细胞核固缩破裂呈团块状或新月状分布、内质网和细胞膜进一步融合将细胞分成多个完整包裹的凋亡小体,凋亡小体最后被吞噬细胞吞噬消化。在凋亡过程中细胞内容物并不释放到细胞外,不会影响其它细胞,因而不引起炎症反应。
在生物化学上,多数细胞凋亡的过程中,内源性核酸内切酶活化,活性增加。核DNA随机地在核小体的连接部位被酶切断,降解为180-200bp或它的整倍数的各种片断。如果对核DNA进行琼脂糖电泳,可显示以180-200bp为基数的DNA
ladder(梯状带纹)的特征。
相比之下,坏死是细胞处于剧烈损伤条件下发生的细胞死亡。细胞在坏死早期即丧失质膜完整性,各种细胞器膨胀,进而质膜崩解释放出其中的内容物,引起炎症反应,坏死过程中细胞核DNA虽也降解,但由于存在各种长度不等的DNA片断,不能形成梯状带纹,而呈弥散状。
一些温和的损伤刺激及一些抗肿瘤药物可诱导细胞凋亡,通常这些因素在诱导凋亡的同时,也可产生细胞坏死,这取决于损伤的剧烈程度和细胞本身对刺激的敏感程度。
三尖杉酯碱(HT)是我国自行研制的一种对急性粒细胞白血病,急性单核白血病等有良好疗效的抗肿瘤药物。研究表明HT在0.02~5μg/ml范围内作用2小时,即可诱导HL-60细胞凋亡,并表现出典型的凋亡特征。本实验用1μg/ml HT在体外诱导培养的HL-60细胞发生凋亡,同时也有少数细胞发生坏死。用Hoechst33342和碘化丙啶(propidium iodide,PI)对细胞进行双重染色,可以区别凋亡、坏死及正常细胞。
细胞免疫荧光染色操作步骤
免疫荧光染色的主要原理是利用抗原抗体之间的特异性结合来显示目的蛋白,主要包括蛋白和一抗结合,其次是带有荧光基团的二抗识别并结合一抗,荧光显微镜下即可观察到荧光。实验步骤如下:
1.已转染72h的细胞种于共聚焦专用培养皿里,冰PBS洗三遍,每次5分钟。
2. 细胞半干时,覆盖以4%冷的多聚甲醛固定15分钟,避光。
3.吸去多聚甲醛后,用冰PBS洗三遍,每次5分钟。
4. 0.5%Triton X-100覆盖细胞10分钟,冰PBS洗三遍,每次5分钟。
5. 与二抗相同宿主的血清?进口胎牛血清室温封闭30分钟。
6. 配制一抗(SAB2104246-50UG, Sigma, USA):SAB+FBS=1:200。
7.加入一抗覆盖细胞,锡纸包裹4度避光过夜。
次日:
8.取出细胞复温至室温约1h。
9.冰1‰Tween洗两次,每次5分钟,于摇床。冰PBS洗一次,5分钟,于摇床。
10.配制荧光标记二抗:Ab50598 Goat anti-rabbit IgG(H&L) TRITC,用PBS或FBS配制。浓度1:200
11.加入二抗,室温孵育1小时(避光)。
12. 冰1‰Tween洗两次,每次5分钟,于摇床。冰PBS洗一次,5分钟,于摇床。
13.DAPI染核,每皿1滴,完全覆盖住细胞即可。
14. 冰1‰Tween洗两次,每次5分钟,于摇床。冰PBS洗一次,5分钟,于摇床。
15.加入防荧光淬灭封片剂,避光。
16.上机confocol
建议:1.还是染完之后没有封片前直接照一些,因为有的时候可能封片会出现问题,再想照反而没有了,另外不要拖太长时间,荧光会淬灭的。2.荧光的片子一定要避光保存,保存的好的话,过一段时间仍然能照出很好的片子。3.二抗用之前一定离心,不然有的时候有那种沉淀,在片子上就是一个很大的非特异性荧光光点,非常难看。4.不管采用何种方法,在使用PBS缓冲液漂洗时,如果结果背景较高可以延长漂洗的次数和时间。
呼吸机的操作步骤及注意事项
The manuscript was revised on the evening of 2021 操作步骤
1、连接电源、气源(压缩气和氧气),湿化罐中加入灭菌注射用水并安装,正确紧密连接管道。
2、开机程序:依次打开压缩机开关→主机开关→湿化器开关。
3、根据病情遵医嘱选择呼吸模式和正确设置参数及报警范围。
4、接模拟肺,观察呼吸机运行是否正常。
5、脱模拟肺,将呼吸机和病人人工气道正确连接。
6、观察胸廓起伏,听诊两肺呼吸音,评估病人通气后状况。
7、严密观察神志、血氧饱和度、呼吸、循环、等各项指标,及时排除呼吸机故障,并作好记录。
8、通气半小时后抽动脉血气分析,根据血气结果调节参数。
9、掌握撤机指征,病人自主呼吸恢复,血气分析正常可试脱机。
10、备好氧气装置和呼吸囊。
11、脱开呼吸机,吸氧。
12、关机程序:脱机→关主机开关→压缩机开关→湿化器开关→拔电源、气源。
13、整理床单位,协助病人舒适体位。
14、清洁消毒呼吸机管道,清洁呼吸机表面。
15、洗手,正确记录护理单。
注意事项
1、清醒的病人给以解释,躁动的病人给以适当镇静或约束。
2、呼吸机管路连接正确。 3、湿化罐护理:保持湿化罐灭菌注射用水在所需刻度,保持吸入气温度在32℃~36℃。
4、保持集水杯处于低位,底处于朝下方向,及时倾倒集水。
5、调节呼吸机机臂时,先取下管道再安装,以免在调节过程中将导管拉出。
6、及时处理报警。
7、定期更换呼吸机管道,建议:48小时更换呼吸机管道。
8、合理消毒呼吸机各种管道。
呼吸机操作相关理论
1、相对禁忌证:(没有绝对禁忌证)
肺大泡、肺囊肿、气胸未行引流者、纵隔气肿、气管食管瘘、大咯血
2、根据病人病情及体重选择模式
控制通气 CMV IPPV
心电监护操作步骤
核对医嘱与执行单 →检查用物 → 洗手,戴口罩 →携用物至床旁 →核对床头卡与腕带 →口述:XX,你好,感觉怎么样?(病人回答:有些胸闷)遵医嘱现在要给您进行心电监护,心电监护的目的是为了监测您的心率、血压、血氧饱和度和呼吸的变化,动态的信息,观察您的病情,操作前请让我看一下您的皮肤 →遮挡屏风 →查看患者皮肤(肘部、手指、胸部) →口述:患者皮肤完整无破损,无红肿、炎症及溃疡 →给患者盖好被子 →口述:XX,我现在要使用监护仪给您进行心电监护了,您准备好了吗? →(患者同意后)连接电源,打开开关,检查导联线,口述:心电监护仪各导联线连接紧密 →接电极片 →接好电极片放好后对病人口述:XX,连接前请让我先清洁一下您的皮肤→清洁手指,接血氧探头 →清洁胸部皮肤(五个位置) →接导联线 →挽起患者袖子,触摸到肱动脉定位 →缠袖带(松紧以放入一指为宜)→为病人盖好被子,口述:能告诉我您的名字吗?(操作中核对)→调节参数(心率、脉搏、血氧饱和度、血压、呼吸、报警音量)→记录测量的各项数值,并将心电监护单挂于床尾 →调节完毕后再次核对病人姓名及腕带 →整理病人,同时口述:您这个姿势舒服吗?→整理好后口述注意事项:XX,心电监护仪我已经给您连接好了,测量的数值均在正常范围内,请您不要担心。检测过程中请您不要自行移动或触及电极片,以免影响监测结果。翻身活动时不要牵拉导联线,以免引起导联线脱落、打折,请您和您的家人不要在监护仪附近使用手机,请保持监护仪周围清洁干燥。如果感觉电极片周围的皮肤有痒感或者不舒服的话,请您及时告诉我,当监护仪出现报警时请您不要紧张、不要自行调节,请您及时按床头铃,我将床头铃放在您的枕边,您先休息,我一会儿会过来看您,谢谢你的配合 →收起屏风→(病人病情稳定,需要撤除监护仪)口述:XX,您好,您的病情比较稳定,(测量血压)血压值…..心率….,血氧饱和度….,呼吸….,现在我帮您撤除监护仪 →遮挡屏风 →关闭电源 →先撤袖带 →再撤血氧饱和度 →最后撤除电极片,清洁患者胸部皮肤 →帮患者整理,同时口述:您这个姿势舒服吗? →拔除电源线 →收起屏风,取回心电监护单 →向病人口述:谢谢您的配合,再见 →推回治疗车 →用物处理 →洗手 →记录最后一次测量数值
- 1 - FEI TECNAI 20透射电镜
目录
电镜操作面板...................................... - 2 -
使用步骤:.......................................... - 4 -
一.放置样品 ..................................... - 4 -
二.合轴 ............................................. - 4 -
三.拍形貌 ......................................... - 5 -
四.踩带轴 ......................................... - 6 -
五、拍衍射 ...................................... - 6 -
六、能谱分析 .................................. - 7 -
七、高分辨 ...................................... - 7 -
八、拔样品杆及关机 ...................... - 8 -
- 2 -
电镜操作面板
左面板
中间 左
右
下 上 —+
Intersity
Stigmator
光速球 Fine Course Exposure
多功能钮X Fine Course
(不用)L1
(做高分辨时,使Focus归零)L2
(降 Spot Size)L3 只是打衍射采带轴时用 光束倾转 调节光斑大小 一般不用
多功能钮Y Dark field Diffraction
Magnification Wobbler Eucentric
focus
样品杆 — +
Focus
R1(抬屏)
R2(不用)
R3(升Spot size) Z(高度,调焦) 拍暗场像 升降倍数 调焦 左面板
磷脂酰丝氨酸外翻分析(Annexin V法)
磷脂酰丝氨酸(Phosphatidylserine, PS)正常位于细胞膜内侧,但在细胞凋亡早期,PS可从细胞膜内侧翻转到细胞膜表面,暴露在细胞外环境中。磷脂酰丝氨酸的转位发生在凋亡早期阶段,先于细胞核的改变、DNA断裂、细胞膜起泡。体内的吞噬细胞可通过识别磷脂酰丝氨酸来清除凋亡细胞。Annexin-V(green)是一种分子量为35~36KD的Ca2+依赖性磷脂结合蛋白,能与PS高亲和力特异性结合,细胞处于调亡或坏死时,Annexin-V可为阳性(早期坏死细胞可能为阴性),是检测细胞早期凋亡的灵敏指标。将Annexin-V进行荧光素(FITC、PE)或biotin标记,以标记了的Annexin-V作为荧光探针,利用流式细胞仪或荧光显微镜可检测细胞凋亡的发生。
PI和Annexin-V双标:
碘化丙啶(propidine iodide, PI)是一种核酸染料,它不能透过完整的细胞膜,但在凋亡中晚期的细胞和死细胞,PI能够透过细胞膜而使细胞核红染。因此将Annexin-V与PI匹配使用,就可以将凋亡早晚期的细胞以及死细胞区分开来。*注意:细胞凋亡时其DNA可染性降低被认为是凋亡细胞标志之一,但这种DNA可染性降低也可能是因为DNA含量的降低,或者是因为DNA结构的改变使其与染料结合的能力发生改变所致。在分析结果时应该注意。
活细胞不能被Annexin V-FITC或PI染色(右图左下象限)。早期凋亡细胞因磷脂酰丝氨酸的暴露及具有完整细胞膜,故呈Annexin V-FITC染色阳性及PI染色阴性(右图右下象限)。坏死或晚期凋亡的细胞呈Annexin V-FITC及PI染色双阳性(右图右上象限)。
*注意:未处理的对照细胞进行常规培养的过程中也有一小部分的细胞死亡发生。
悬浮细胞的染色:Ⅰ、将正常培养和诱导凋亡的悬浮细胞(0.5×106)用PBS洗2次,加入200μlBinding Buffer和FITC标记的Annexin-V(20ug/ml)10μl及PI(50ug/ml)5μl,室温避光30min,加入400μlPBS,立即用FACScan进行流式细胞术定量检测(一般不超过1小时),同时以不加AnnexinV-FITC及PI的一管作为阴性对照。Ⅱ、贴壁培养的细胞染色:先用0.25%的胰酶消化,洗涤、染色和分析同悬浮细胞。Ⅲ、爬片细胞染色:同上,最后用荧光显微镜和共聚焦激光显微镜进行观察。结果及注意事项:整个操作动作要尽量轻柔,勿用力吹打细胞;操作时注意避光,反应完毕后尽快在一个小时内检测;
细胞染色操作步骤及注意事项
概述
细胞染色是一种常用的实验手段,它可以通过标记细胞的某些特定结构或分子,帮助研究者观察和研究细胞的结构和功能。本文档将介绍细胞染色的常用操作步骤及注意事项。
操作步骤
步骤一:细胞固定
1. 取出培养皿中的细胞载玻片。
2. 用PBS缓冲溶液洗涤细胞载玻片,去除培养基中的残留物质。
3. 使用细胞固定液(如4%的甲醛溶液)固定细胞,通常固定时间为15-30分钟。
4. 用PBS缓冲溶液洗涤细胞载玻片,去除固定液中残留的甲醛。
步骤二:细胞渗透
1. 取出细胞载玻片中的细胞。
2. 用PBS缓冲溶液洗涤细胞载玻片,去除固定剂中的残留物质。 3. 在细胞载玻片上滴加渗透液(如0.1% Triton X-100),孵育10-15分钟。
4. 用PBS缓冲溶液洗涤细胞载玻片,去除渗透液中的残留物质。
步骤三:染色
1. 取出细胞载玻片中的细胞。
2. 在细胞载玻片上滴加适当浓度的染色液(如DAPI染料),孵育时间根据实验需要而定(通常为5-15分钟)。
3. 用PBS缓冲溶液洗涤细胞载玻片,去除染色液中的残留物质。
步骤四:显微观察
1. 将细胞载玻片翻转到显微镜载玻片上。
2. 加入一滴适当的封片液(如甘油/丙酮溶液)。
3. 用显微镜观察和拍摄细胞。
注意事项
1. 操作时要注意佩戴实验手套和眼部防护设备,避免接触有毒或有害物质。 2. 细胞固定液需要根据实验需要和细胞类型进行选择,避免使用具有细胞毒性的固定液。
3. 染色液要根据需要选择,确保染色剂与研究对象的亲和力。
4. 操作过程中要注意细胞的温度和湿润度,避免细胞损伤。
5. 洗涤的PBS缓冲液要充分冲洗,避免残留物质对结果的影响。
6. 操作前要确保显微镜和镜头清洁,以获得清晰的观察结果。
7. 操作结束后要及时清理实验台面和工具,避免交叉污染。
结论
细胞染色是一种重要的细胞学研究手段,通过本文档介绍的操作步骤及注意事项,可以帮助研究者正确地进行细胞染色实验。合理的实验操作和注意细节能够提高实验结果的准确性和可靠性。在进行细胞染色实验时,研究者应根据具体实验要求和细胞类型进行操作,并严格遵守实验安全规范,确保实验的顺利进行和结果的有效分析。