BL21(DE3) 感受态细胞的操作步骤及注意事项
- 格式:pdf
- 大小:76.80 KB
- 文档页数:2

感受态的制备与转化,质粒提取(原理和操作步骤)感受态细胞: 理化方法诱导细胞,使其处于最适摄取和容纳外来DNA的生理状态。
即指细菌细胞在一定的生长阶段,自身或通过人为处理而具有摄取外源DNA并使其基因型和表现型发生相应变化的能力。
如大肠杆菌经CaCl2处理,就成为容易受质粒DNA转化的细胞。
一般来说,感受态细胞的最基本要求是:1、没有质粒2、容易被转进去(一般是G-细菌,细胞壁薄)3、营养条件一般,非苛养菌CaCl2法:操作原理:1.将快速生长的大肠杆菌置于经低温(0℃)预处理的低渗氯化钙溶液中,便会造成细胞膨胀,同时Ca2+会使细胞膜磷脂双分子层形成液晶结构,促使细胞外膜与内膜间隙中的部分核酸酶解离开来,离开所在区域,诱导细胞成为感受态细胞细胞膜通透性发生变化,极易与外源DNA相粘附并在细胞表面形成抗脱氧核糖核酸酶的羟基-磷酸钙复合物。
2.此时,将该体系转移到42℃下做短暂的热刺激(90s),细胞膜的液晶结构会发生剧烈扰动,并随机出现许多间隙,外源DNA就可能被细胞吸收。
进入细胞的外源DNA分子通过复制、表达,实现遗传信息的转移,使受体细胞出现新的遗传性状。
3.将转化后的细胞在选择性培养基上培养,筛选出带有外源DNA分子的阳性克隆。
意义:将构建好的载体转入感受态细胞进行表达,不仅可以检验重组载体是否构建成功,最主要的是感受态细胞作为重组载体的宿主可以进行后续实验,如蛋白质表达纯化等工作。
细菌处于容易吸收外源DNA的状态叫感受态。
转化是指质粒DNA或以他为载体构建的重组子导入细菌的过程。
实验材料:E. col i DH5α菌株: Rˉ,Mˉ,Ampˉ;pBS质粒DNA;eppendorf管。
试剂:1.LB固体和液体培养基2.Amp母液(储存浓度50mg/ml)3.含Amp的LB固体培养基:将配好的LB固体培养基高压灭菌后冷却至60℃左右,加入Amp储存液,使终浓度为50ug/ml,摇匀后铺板。
4.0.05mol/L CaCl2溶液:称取0.28g CaCl2(无水,分析纯),溶于50ml重蒸水中,定容至100ml,高压灭菌。

感受态细胞转化(一)实验准备:1.Amp母液:称取氨苄青霉素100mg溶于1ml dd H2O中。
0.22μm滤器过滤除菌,用EP管分装后储存于-20℃冰箱.2.X-Gal溶液(2%,m/v)称取20mg X-Gal溶于1ml二甲基甲酰胺(DMF)中。
用玻璃试管或聚丙烯管分装后储存于-20℃冰箱,装有X-Gal溶液的试管须用铝箔包裹以防因光照而被破坏.(无须过滤)3.IPTG(20%,m/v,0.8mol/L)称取IPTG2g溶于8ml dd H2O中。
用蒸馏水定容至10mL。
0.22μm 滤器过滤除菌,用EP管分装成1mL一小份后储存于-20℃冰箱. (二)操作步骤“质粒pBS SK(-)的转化1.取感受态细胞置于冰浴中,待感受态细胞融化后,分别在100μl 感受态细胞悬液中加入下列DNA质粒或水,轻轻摇匀后冰上放置30分钟。
感受态细胞+pBS SK(-)质粒2μl (含量不超过50ng,体积不超过10μl)感受态细胞+无菌水2μl (阴性对照)2. 热击:42℃水浴中热击90秒(注:精确计算时间,过长将对细胞造成伤害),热击后立即置于冰上冷2-5分钟(禁止摇动)。
3. 复苏:向每管中加入400μl LB液体培养基(注:不含Amp),混匀后37℃轻摇培养1~1.5小时,使细菌恢复正常生长状态,并表达质粒编码的抗生素抗性基因(Ampr )。
涂布平板筛选转化质粒方法一(《分子克隆实验指南》标准方法)1.将溶化的顶层琼脂分装于17*100mm试管,将试管置于45℃的加热块槽内备用。
(90mm培养板用3mL顶层琼脂;150mm培养板用7mL顶层琼脂)2.从加热块取出一支试管,快速加入活菌含量不多于3000(90培养基)或10000(150培养基)的细菌悬液0.1mL。
盖紧试管盖颠倒数次。
以使细菌在琼脂中混匀。
3.按下表加入:4. 快速将溶化的顶层琼脂倾入含有适当抗生素的凝固琼脂板的中部,旋转培养板使琼脂散匀。

张 迹,李 智,张 宇,等.一步法制备大肠杆菌BL21(DE3)菌株感受态细胞及转化条件优化[J].江苏农业科学,2016,44(12):529-532.doi:10.15889/j.issn.1002-1302.2016.12.156一步法制备大肠杆菌BL21(DE3)菌株感受态细胞及转化条件优化张 迹,李 智,张 宇,袁巧云(淮阴师范学院生命科学学院/江苏省环洪泽湖生态农业生物技术重点实验室,江苏淮安223300) 摘要:大肠杆菌BL21(DE3)菌株是大肠杆菌表达系统最常用的宿主菌株,因此人们需要1种便捷有效的感受态细胞制备和转化方法。
一步法感受态细胞制备操作方便,只加1种试剂即可,更快捷稳定,转化也更方便,不需要热激。
研究大肠杆菌感受态细胞一步法制备对BL21菌株的适用性,并对转化过程中的关键参数进行探索和优化。
结果表明,该一步法制备的BL21菌株感受态细胞可获得106CFU/μgDNA转化效率,完全能够满足常规转化要求。
转化过程中相关参数的最佳条件为冰水浴30min,室温放置10min,37℃、150r/min振荡复苏40min。
关键词:感受态细胞制备;一步法;大肠杆菌BL21(DE3)菌株;转化条件 中图分类号:X172 文献标志码:A 文章编号:1002-1302(2016)12-0529-03收稿日期:2015-11-04基金项目:国家自然科学基金青年科学基金(编号:31300099);江苏省高等学校大学生创新训练计划(编号:201310323046X)。
作者简介:张 迹(1982—),男,江苏宿迁人,博士,讲师,主要从事环境污染物微生物降解及污染环境微生物修复研究。
E-mail:zhangjihnu@163.com。
在分子生物学试验中,DNA重组技术和外源基因的表达是最常用的研究手段之一,质粒转化进入大肠杆菌感受态细胞是其频繁使用的一项基本操作技术。
这项技术分为2个部分,即大肠杆菌感受态细胞的制备和质粒DNA的转化。

感受态细胞的制备的实验步骤CaCl2感受态细胞的制备的实验步骤1.前夜接种受体菌(DH5α或DH10B),挑取单菌落于LB培养基中37℃摇床培养过夜(约16小时);2.取1ml过夜培养物转接于100ml LB培养基中,在37℃摇床上剧烈振荡培养约2.5-3小时(250-300rpm);3.将0.1M CaCl2溶液置于冰上预冷;以下步骤需在超净工作台和冰上操作4.吸取1.5ml培养好的菌液至1.5ml离心管中,在冰上冷却10分钟;5.4℃下3000g冷冻离心5分钟;6.弃去上清,加入100μl预冷0.1M CaCl2溶液,用移液枪轻轻上下吸动打匀,使细胞重新悬浮,在冰放置20分钟;7.4℃下3000g冷冻离心5分钟;8.弃去上清,加入100μl预冷0.1M CaCl2溶液,用移液枪轻轻上下吸动打匀,使细胞重新悬浮;9.细胞悬浮液可立即用于转化实验或添加冷冻保护剂(15% - 20%甘油)后超低温冷冻贮存备用(-70℃)。
·电转化法制备大肠杆菌感受态细胞的实验步骤1.前夜接种受体菌(DH5α或DH10B),挑取单菌落于LB培养基中37℃摇床培养过夜;2.取2ml过夜培养物转接于200ml LB培养基中,在37℃摇床上剧烈振荡培养至OD600=0.6(约2.5-3小时);3.将菌液迅速置于冰上。
以下步骤务必在超净工作台和冰上操作4.吸取1.5ml培养好的菌液至1.5ml离心管中,在冰上冷却10分钟;5.4℃下3000g冷冻离心5分钟;6.弃去上清,加入1500μl冰冷的10%甘油,用移液枪轻轻上下吸动打匀,使细胞重新悬浮;7.4℃下3000g冷冻离心5分钟8.弃去上清,加入750μl冰冷的10%甘油,用移液枪轻轻上下吸动打匀,使细胞重新悬浮;9.4℃下3000g冷冻离心5分钟10.加入20μl冰冷10%的甘油,用移液器轻轻上下吸动打匀,使细胞重新悬浮;11.立即使用或迅速置于-70℃超低温保存。


感受态细胞(DH5α,,TOP10)操作步骤第一天1.配制试剂100mM CaCl2:7.35g CaCl2.2H2O /500 ml dd H2O100mM MgCl2:10.15g MgCl2.6H2O /500 ml dd H2O50%(V/V)甘油1L LB 培养基(1L dd H2O+25g LB粉末)75%(V/V)酒精配制试剂(100mM CaCl2100mM MgCl2):称取相应质量的固体粉末将其转移到事先清洗干净的烧杯里(若有容量瓶,使用容量瓶),用超纯水清洗量筒三次,加少量dd H2O到烧杯溶解固体粉末,将烧杯里溶液加到量筒里,用少量dd H2O清洗量筒三次,将量筒定容到500 ml,将溶液加到试剂瓶里,留待消毒。
配制50%(V/V)甘油:用量筒量取250ml甘油,甘油较粘稠,加时要小心慢加,将量好后的甘油加到试剂瓶里。
用另一个量筒量取250ml dd H2O,用少量水清洗量取甘油的量筒,最终将所有dd H2O加到试剂瓶里,留待消毒。
2. 准备实验用品:1个500mL摇瓶、2个2 L摇瓶(加有锡箔纸);3个无抗生素的LB平板(100ml dd H2O+3.7g LB粉末,可倒6-7个平板,下午1点左右做平板,所有感受态平板侧面需划两条线);2个Kana LB平板(100ml LB加入50ul kana);3ml巴氏吸管;1.5ml 小管(使用没有拆封过的小管,不需灭菌)1ml 枪头;200ul 枪头;4个400ml 离心管(每管实际装350ml液体)。
3. 灭菌锅消毒:100mM CaCl2;100mM MgCl2;50%(V/V)甘油;LB 培养基,dd H2O(若有灭菌水则不需灭);500 ml 摇瓶;2 L摇瓶;1ml 枪头;200ul 枪头;6个100ml 离心管。
灭完菌后拿到烘箱中60℃烘干,试剂则放到4℃冰箱中。
4. 涂布感受态细胞平板(以DH5α为例)pm 2:30-3:00⑴戴好手套,清理干净操作台,喷洒75%酒精;⑵将三个无抗性的LB平板放在工作台上,在底部标记上DH5α及日期;⑶倒5-8个Beads在第一个平板上,将beads倾到一边,在空白处加10ul灭菌的dd H2O;⑷第一个将LB平板,移液枪、枪头一起拿到-80℃冰箱那的操作台上,从冰箱迅速拿出装有感受态细胞的管子(三中感受态细胞的管子装在一个大袋子里,灰色为DH5α,紫色为TOP10,管子上有标记),用枪头在管子中搅出一小冰块,将冰块加到10ul 水上,盖好平板盖子,将感受态细胞管子迅速放到-80℃冰箱里,整个步骤要迅速小心。
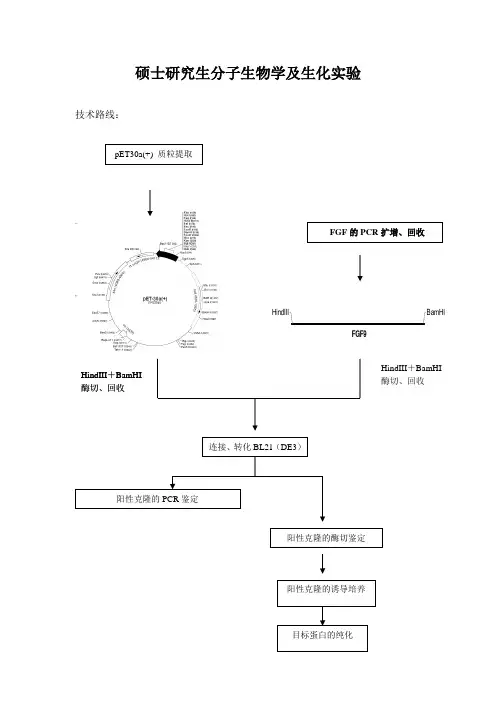
硕士研究生分子生物学及生化实验技术路线:HindIIIBamHIFGF9FGF 的PCR 扩增、回收HindIII 连接、转化BL21(DE3)阳性克隆的PCR 鉴定+BamHI 酶切、回收HindIII +BamHI 酶切、回收pET30a(+) 质粒提取阳性克隆的酶切鉴定阳性克隆的诱导培养 目标蛋白的纯化一、感受态细胞的制备1.实验材料及试剂受体菌:BL21(DE3)、质粒pET-30a+转化液:50mM CaCl2培养基:LB培养基(pH7.0) 121℃,20min 高压灭菌NaCl 5g/L酵母提取物5g/L胰蛋白胨10g/L2..实验步骤1. 感受态细胞的制备1)活化的BL21(DE3)平板上挑取一单菌落,接种于100mL LB液体培养基中37℃振荡培养过夜。
2)取培养过夜的菌液100μL接种于100ml新鲜的LB培养基中,37℃振荡培养约5h。
3)每组取2支10ml离心管,各转入8ml菌液,4000r/min离心3min,收集菌体。
4)弃去上清液,在涡旋器上将细胞悬浮于冰冷的2mL 50mmol/L CaCl2溶液中,将2管合并为1管,并在冰上放置15-30min。
4000r/min离心3min。
5)弃去上清液,加入1ml冰冷的50mmol/L CaCl2溶液,小心悬浮细胞,置冰上,即制成了感受态细胞悬液,可直接用于转化实验,也可加入占总体积20%左右高压灭菌过的甘油,混合后分装于Eppendorf管中,置于-70℃条件下,可保存6-12个月。
二、FGF的PCR扩增与回收(一)试剂电泳缓冲液(50×TAE)Tris 242g冰醋酸 57.1mlEDTA(0.5mol/L pH8.0) 100ml使用时用蒸馏水稀释50倍。
DNA快速纯化/回收试剂盒(二)方法1.PCR反应条件目的基因模板来源于质粒pcDNA3.1-FGF,将质粒稀释100倍,PCR反应采用50μl反应体系。

BL21 G old P lysS(DE3)大肠杆菌菌株编号 名称北京华越洋生物NRR01230 BL21 G old P lysS(DE3)大肠杆菌菌株基本信息:名称:BL21 G old P lysS(DE3)大肠杆菌菌株规格:300ul甘油菌储存温度:-‐80℃基因组:E. coli B F-‐ dcm+ Hte ompT hsdS(rB-‐ mB-‐) gal λ (DE3) [pLysS Camr]a endA T etr简介:BL21 Gold(DE3)菌株使用的是以T7RNA聚合酶为基础的高水平表达系统,如BL21(DE3),BL21 Gold(DE3)也对有毒性的蛋白表达进行严格的控制。
当和CE6噬菌体一起使用的时候,BL21 G old(DE3)对蛋白的控制表达最严格。
BL21 Gold(DE3)也可用于没有T7RNA聚合酶的表达系统。
pLysS质粒能够产生T7溶菌酶,可以有效降低目的基因的基础表达水平。
pLysS质粒使得该菌株具有氯霉素抗性。
pLysS质粒的起始复制位点是p15 Origin, 这使得该质粒能够和pUC-‐及pBR322-‐衍生的质粒互相共存。
操作说明:1,本品包含一份甘油菌,使用本甘油菌时可以不用完全融解,在甘油菌表面蘸取少量涂板或进行液体培养即可。
也可以完全融解后使用,但随着冻融次数的增加,细菌的活力会逐渐下降。
2,为保证菌种纯正,避免其它细菌污染,尽量先划平板,然后再挑单克隆菌落进行后续操作。
冷冻管开封:用浸过75%酒精的脱脂棉严格消毒冷冻管盖。
菌株复溶:无菌环境中旋开装有复溶液的滴瓶盖,吸取1ml 左右复溶液,加入到冷冻管中。
轻轻振荡,使冻干菌株溶解呈悬浮状。
菌株复壮:用无菌吸管吸取菌悬液,转移到复溶液滴瓶中。
做好标识,在适宜温度下培养。
细菌在30-‐35℃培养箱中培养24-‐48h,真菌在23-‐28℃培养箱中培养24-‐72h (必要时,可适当延长培养时间)。

一步法制备大肠杆菌BL21(DE3)菌株感受态细胞及转化条
件优化
一步法制备大肠杆菌BL21(DE3)菌株感受态细胞及转化
条件优化
张迹;李智;张宇;袁巧云
【期刊名称】《江苏农业科学》
【年(卷),期】2016(044)012
【摘要】大肠杆菌BL21(DE3)菌株是大肠杆菌表达系统最常用的宿主菌株,因此人们需要1种便捷有效的感受态细胞制备和转化方法。
一步法感受态细胞制备操作方便,只加1种试剂即可,更快捷稳定,转化也更方便,不需要热激。
研究大肠杆菌感受态细胞一步法制备对BL21菌株的适用性,并对转化过程中的关键参数进行探索和优化。
结果表明,该一步法制备的BL21菌株感受态细胞可获得106 CFU/μg DNA转化效率,完全能够满足常规转化要求。
转化过程中相关参数的最佳条件为冰水浴30 min,室温放置10 min,37℃、150 r /min振荡复苏40 min。
【总页数】4页(529-531,532)
【关键词】感受态细胞制备;一步法;大肠杆菌BL2 1 (DE3)菌株;转化条件
【作者】张迹;李智;张宇;袁巧云
【作者单位】淮阴师范学院生命科学学院/江苏省环洪泽湖生态农业生物技术重点实验室,江苏淮安223300;淮阴师范学院生命科学学院/江苏省环洪泽湖生态农业生物技术重点实验室,江苏淮安223300;淮阴师范学院生命科学学院/江苏省环洪泽湖生态农业生物技术重点实验室,江苏淮安223300;淮阴师范学院生命科学学院/江苏省环洪泽湖生态农业生物技术重点实验室,江苏淮安223300【正文语种】中文。

感受态细胞制备制备感受态常用的方法是电击法和CaCl2制备法,以下介绍CaCl2制备法:1、可以从-80℃冰柜中,取出一支冻存菌株,于事先照过紫外的超净台中,用无菌的接种环轻轻蘸取菌种后,在无抗平板(由于Rocetta含有氯霉素抗性,需要涂布在氯霉素抗性的平板,后面的都是如此)上划线,并将菌种迅速放回-80℃保存,在划线板上做好相应标记,于37℃培养过夜。
2、从37℃培养过夜的新鲜平板上挑取一个单克隆,接种于2mlEP管中,37℃,220rpm震荡培养约6个小时至对数生长中后期;将该菌悬液以1:100的比例接种于50mlLB液体培养基(2瓶)中,37℃振荡培养2.5小时至OD600=0.5。
注意:接种比例不得大于1:10。
3、在无菌条件下将细菌转移到一个无菌、预冷的离心管(50ml)中,在冰上放置5~10min;注意:划板、接种为了防止意外发生最好多划一块平板和多接一根试管,划板、接种、转接均要严格按照无菌操作。
4、4℃5000g离心5分钟。
用预冷的去离子水洗涤沉淀,4℃5000g离心5分钟;Note:此步主要是为了洗去培养基中的盐等5、沉淀加入2ml预冷的0.05mol/LCaCl2-15%甘油混合溶液,轻吹散,冰浴5分钟,4℃5000g离心5分钟;6、沉淀加入2ml预冷的0.05mol/LCaCl2-15%甘油混合溶液,轻吹散,即成为感受态细胞悬液。
分装成50~100μl的小份,贮存于-70℃可保存半年。
含15%甘油的0.05mol/LCaCl2制备方法:称取0.28gCaCl2(无水,分析纯),溶于50ml重蒸水中,加入15ml甘油,定容至100ml,高压灭菌。
感受态细胞的特征感受态:通过特殊处理使细胞处于能够吸收外源DNA的状态。
感受态细胞的特征:(1)细胞表面暴露出一些可接受外来DNA的位点(以溶菌酶处理,可促使受体细胞的接受位点充分暴露)。
(2)细胞膜通透性增加(用钙离子处理,可使膜通透性增加,使DNA直接穿过质膜进入细胞)。

CaCl2法制备感受态细胞1)从新划线的平皿上挑取一个单菌落接种到10ml的LB培养基中于37℃过夜培养2)吸取500μl上述过夜培养的新鲜菌液,接种到一个盛有50ml LB的锥形瓶中,在37℃,200rpm条件下振荡培养直至菌浓度达到5×107个/ml,对大多数大肠杆菌菌株来说这时的OD600值为0.4~0.5。
一般从转接到达到此OD值约需2.5―3小时。
3)将培养液转至一灭菌并已预冷的50ml离心管(聚丙烯管)中于冰上放置10min,使培养物冷却至0℃。
4)然后于4℃以3000 rpm离心10min沉淀细胞,小心地弃去上清液,并倒转管子将残余的液体沥干。
5)将细胞悬浮在10ml冷的0.1mol/lCaCl2中,置冰上10min。
重复第4步操作,以沉淀菌体细胞。
6)收集菌体,加入1.5ml预冷的0.1mol/lCaCl2,小心悬浮,分装于200ul/管,若不马上进行转化,该感受态细胞可加入终浓度为10%的灭菌甘油,置于-70℃保存小刚论文:大肠杆菌BL21(DE3)感受态细胞的制备挑取新鲜的大肠杆菌BL21(DE3)单菌落接种于5ml LB培养基中,于37℃摇床培养过夜;培养物按1%接种量接种于100ml LB培养基中,37℃培养至OD600为0.5。
培养物冰上放置10分钟,然后于4℃,4000r/min 离心收集菌体(无菌离心管);将菌体用10ml冰冷的0.1M CaCl2洗一次;4℃,4000r/min 离心收集菌体,用10ml冰冷的0.1M CaCl2重悬菌体,冰浴30min;4℃,4000r/min 离心收集菌体,加入2ml冰冷的0.1M CaCl2溶液,即制备成大肠杆菌BL21(DE3)感受态细胞。
质粒转化过程操作步骤(1)事先将恒温水浴的温度调到42℃。
(2)从-70℃超低温冰柜中取出一管(100μL)感受态菌,立即用手指加温融化后插入冰上,冰浴5 10min。
(3)加入5–10 μL连接好的质粒混合液(DNA含量不超过100ng),轻轻震荡后放置冰上30min。
(整理)感受态细胞的制备和重组质粒的转化1.掌握用CaCl2法制备感受态细胞的原理和方法。
2.学习和掌握质粒DNA的转化和重组质粒的筛选方法。
【实验原理】质粒在不同的细菌之间转移是微生物世界中一种普遍的现象,一个细菌品系通过吸收另一个细菌品系的质粒DNA而发生了遗传性状的改变,这种现象叫做转化,获得了外源DNA 的细胞称为转化子。
在基因克隆技术中,所谓转化是指质粒或重组质粒被导入受体细胞,表达相应的选择标记基因,并在一定的培养条件下,在选择性培养基上长出转化子的过程。
质粒必须通过转化进入细菌细胞内,才能进行扩增和表达,从而获得大量的克隆基因,使我们能够进行进一步的DNA操作,如亚克隆等;或者获得其表达产物。
转化效率的高低与受体菌的生理状态有关。
细菌吸收外源DNA的能力最高时的状态被称为感受态细胞(competent cell)。
有些种类的细菌在其生长的任一阶段都处于感受态,而另一些细菌只有处于某个生长时期时(一般为对数生长早、中期),才会处于感受态,如本实验所用的大肠杆菌。
用一定浓度的CaCl2 处理对数生长早中期的细菌可以大大提高细菌吸收周围环境中的DNA分子的能力。
对这种现象的一种解释是CaCl2能使细菌细胞壁的通透性增强,从而提高转化率。
这种转化方法称为“化学法”。
目前还可以使用电激的方法,通过瞬间的高压电流,在细胞上形成孔洞,使外源DNA进入胞内,从而实现细胞的转化。
电激转化的效率往往比化学法高出1到2个数量级,达到1 x 108转化子/μg DNA,甚至1 x 109转化子/μg DNA,所以常用于文库构建时的转化或遗传筛选。
微生物转化是基因工程的常用技术,大肠杆菌是基因工程中最常用的受体菌,本实验即是用前面实验获得的重组质粒转化大肠杆菌细胞。
【试剂与器材】〈一〉试剂1.LB液体培养基: 参见附录每组配200mL, 其中100mL分装于500mL三角瓶中,另各取3mL装于2只大试管中,其余装于装于500mL三角瓶中,121℃高压蒸汽灭菌20分钟。
大肠杆菌经Ca离子处理后可摄取外源DNA(Plasmid、Phage DNA),处于这种状态的细胞称作感受态细胞(Competent Cells)。
在进行基因重组实验时,使用感受态细胞的转化实验应用十分广泛。
制作基因文库、重组质粒体以及进行亚克隆实验时,特别是在目的基因含量十分低的情况时,使用高效的感受态细胞十分重要。
本公司生产的感受态细胞长期以来备受广大客户的喜爱,可用于DNA的化学转化。
使用pUC19质粒检测,转化效率可达107-108,在-70℃下保存几个月转化效率不发生改变。
二、使用方法(1)取出感受态细胞,手心融化感受态或者置于冰上5min解冻。
(2)然后将连接产物10ul加入感受态中(100ul),轻弹感受态离心管底部,混匀,冰浴30min。
(3)42℃水浴热激90S,之后再冰浴5min。
(4)取出离心管(感受态),吸水纸吸去离心管外壁水分,室温放置10min。
(5)每管中加900μl LB(或SOC)培养基(不含抗生素),37℃振荡培养1小时。
目的是使质粒上相关的抗性标记基因表达,使菌体复苏。
(6)室温4,500rpm离心5分钟,弃去900μl上清后,用剩余100μl培养基重悬细胞并涂布到含抗性的的LB琼脂平板。
(7)将平板置于室温直至液体被吸收。
(8)倒置平皿,于37℃培养,12~16小时后可出现菌落。
研究了保存时间、温度和抗冻剂对大肠杆菌感受态细胞保存的影响。
结果表明:在4℃-、40℃、-70℃条件下,大肠杆菌感受态细胞转化效率在保存前期随保存时间增加呈上升趋势,转化效率在第1天或第7天达到最大值,此后随保存时间增加而呈下降趋势;在保存前期,保存于4℃的大肠杆菌感受态细胞转化效率高于保存在-70℃、-40℃的大肠杆菌感受态细胞的转化效率,在保存后期低于保存在-70℃、-40℃的大肠杆菌感受态细胞的转化效率;在相同保存温度和保存时间下,保存在甘油的大肠杆菌感受态细胞转化效率高于保存在DMSO 的大肠杆菌感受态细胞的转化效率。
大肠杆菌感受态细胞的制备 细胞能够从周围环境中摄取DNA分子,并且不易被细胞内的限制性核酸内切酶分解时所处的一种特殊生理状态称感受态(competence)。
实验准备(按实验先后排序):冰盒,超净工作台,无菌水,100μL黄色枪头,100μL的移液器,无抗LB培养基,培养皿,恒温摇床,100ML的锥形瓶,分光光度计,50ML的离心管,4度离心机,0.1 M CaCl2溶液,0.1 M CaCl2(含有15%-30%甘油)。蓝色字体代表需要特别注意的步骤
1、取出保存于-80 ℃ 的DH5α或者BL21菌种在冰上解冻[1],用枪头沾取少量菌液溶于100 μL无菌水[2]中,吹打混匀后涂布[3]于无抗生素的LB固体培养平板上, 37℃培养12-14 h。 2、从过夜培养的平板中挑取单菌落[4]接种于3-5 mL无抗生素LB液体培养基中, 37 ℃ , 220 rpm培养过夜( 12 h左右)。 3、将上步培养过夜的菌液以1:50-1:100的比例接种于100 mL不含抗生素的LB液体培养基中,37 ℃,220 rpm培养2-3 h直至OD600=0.4-0.5,即达到对数生长期。 4、将上述菌液分装至灭菌预冷的50 mL离心管[5]中,冰上放置10 min,然后于4 ℃ 、 4000 rpm离心10 min。 5、轻轻地倒掉上清, 然后将离心管倒置于吸水纸上以去除残余的液体。 6、向每管中加入10 mL预冷的0.1 M CaCl2,轻轻[6]拨动管底以重悬细菌,冰上放置20 min, 然后于4 ℃ 、 4000 rpm离心10 min。 7、弃上清,加入2.5-3 mL预冷[7]的0.1 M CaCl2(含有15%-30%甘油)轻轻悬浮细胞,冰上放置5 min,即为感受态细胞。 8、按照每管100 μL分装到灭菌预冷的1.5 mL EP管中,于-80 ℃ 保存备用。
[1]这一步应当在冰上放置3至5分钟左右,但是不要反复冻融
感受态细胞的制备过程— LB 液体培养基:胰蛋白胨, 1%(W/V ;酵母提取物, 0.5%(W/V ; NaCl ,1%(W/V ,用固体 NaOH 调节 pH 为 7.0~7.2,分装于三角瓶中,灭菌后存于室温。
摇动三角瓶,如果发现变浑浊,表明已染菌,应弃掉重新配制; — 0.1 mol/L CaCl2:称取 1.47 g CaCl2•2H 20(Amresco 分装溶于 100 mL去离子水中,灭菌后存于 4℃;—离心管(50 mL或 80 mL或 100 mL ,灭菌;—培养试管,灭菌;— 1 mL枪头,灭菌;— 1 mL加样枪;—滤纸,用牛皮纸包好后灭菌;— 10 mL量筒,灭菌;— 5 mL移液管,用棉花塞入管口,卷于报纸中灭菌;—冰,离心管架;—恒温摇床,可见分光光度计,玻璃比色杯。
1.接种空白大肠杆菌于 3 mL LB培养基中, 37℃剧烈震荡培养过夜;2.将已培养好的种子液转入 100 mL LB培养基中扩大培养至 OD 650=0.3后,将培养好的细菌置于冰上冷却 10 min;3. 4℃, 4 000 rpm离心 10 min收集细菌,倒出上清,将离心管倒置于一干净滤纸上,将培养基控干;4.用 40 mL 冰预冷的 CaCl 2悬浮细菌,用加样枪冲吸,使菌体尽可能分散。
冰上放置 30 min;5. 4℃, 4 000 rpm离心 10 min收集细菌,倒出上清,再用 4 mL冰预冷的 CaCl 2悬浮细菌,这些细菌可以立即使用,或者于 4℃放置 12~24 h以增加其敏感性后使用。
6.如果证明所制备的感受态细胞可用,可以在冰上分装为100 μL每管,再加入100 μL甘油(注意:甘油非常黏稠,吸取时应该多一点。
,于液氮或 -70℃冰箱中存放。
存于低温下的感受态细胞, 一定不能融解。
如果已经融解, 应丢弃, 而不能再冻结保存而继续使用。
注意事项:1.本实验室所用空白大肠杆菌菌株为 JM109。
http://www.solarbio.com
BL21(DE3)感受态细胞操作步骤及注意事项
货号:C1400
规格:10×100ul/20×100ul
保存:-70℃保存,运输为干冰包装。自收货之日起液氮保存至少一年,
-70℃保存至少6个月。
产品简介:
BL21(DE3)感受态细胞是采用大肠杆菌BL21(DE3)菌株经特殊工艺处
理得到的感受态细胞,可用于DNA的化学转化。使用pUC19质粒检测,转化
效率可达107,-70℃保存6个月转化效率不改变。
基因型:F_ompThsdSB(rB_mB_)dcmgal(DE3)
特点:该菌株用于高效表达克隆于含有噬菌体T7启动子的表达载体
(如pET系列)的基因。T7噬菌体RNA聚合酶位于λ噬菌体DE3区,
该区整合于BL21的染色体上。该菌适合表达非毒性蛋白。
操作方法:(以下各步骤均为无菌操作)
1、将感受态细胞置于冰上融化,以下实验以100ul感受态细胞为例。
2、向感受态细胞悬液中加入需转化的目的DNA,注意目的DNA的体积
不要超过感受态细胞悬液体积的十分之一,轻轻旋转离心管以混匀内容物,
冰浴放置30分钟。
3、将离心管置于42℃水浴中放置60-90秒,然后快速转移到冰浴中
放置2-3分钟,注意不要摇动离心管。
4、向离心管中加入500ul无菌无抗的SOC或LB培养基,37℃
http://www.solarbio.com
180rpm振荡培养1小时。目的是使质粒上相关的抗性标记基因表达,使菌
体复苏。
5、取适量已转化的感受态细胞涂布含相应抗生素的SOC或LB平板,
37℃倒置培养12-16小时。涂布用量可根据具体实验来调整,如转化的DNA
总量较多,可取100ul左右的转化产物涂板;反之,如转化的DNA总量较
少,可取200-300ul的转化产物涂板。过多菌液可以抑制细菌生长。如果预
计的克隆较少,可通过离心后吸除部分培养液,悬浮菌体后将其涂布于一个
平板中。涂布剩余的菌液可4℃保存,如果次日的转化菌落数过少可以将剩
下的菌液再涂布新的平板。
注意事项:
1、感受态细胞应保存在-70℃,不可反复冻融,否则其转化效率将会降
低。
2、实验过程中应严格无菌操作,防止其它DNA或杂菌的污染,避免为
以后的筛选、鉴定带来影响。
3、转化时,转化效率与外源DNA的浓度在一定范围内成正比,但当加
入的外源DNA量过多或体积过大反而会降低转化效率。转化时DNA体积要
小于感受态细胞体积的十分之一。
4、转化率的计算:转化率=产生菌落的总数/铺板DNA总量。
5、为防止转化实验不成功,可以保留部分连接产物,以重新转化,将损
失降到最低。