去势抵抗性前列腺癌中雄激素受体信号通路再激活的研究进展
- 格式:pdf
- 大小:282.03 KB
- 文档页数:4

前列腺癌的分子生物学研究现状前列腺癌是男性常见的恶性肿瘤之一,对于这种疾病的分子生物学研究具有重要意义。
本文将围绕前列腺癌的分子生物学研究现状展开论述,主要包括致癌基因、信号通路、治疗靶点等方面的内容。
一、前列腺癌的基因变异1. 基因突变与前列腺癌发生关系密切前列腺癌的发生与多个基因突变相关。
其中,PTEN、TP53和RB1等肿瘤抑制基因的缺失或突变被广泛认为是前列腺癌发生和进展过程中最常见的变异类型。
这些突变会导致细胞功能紊乱,增加细胞增殖能力和凋亡抵抗能力,从而促进前列腺肿瘤生长和扩散。
2. 启动子甲基化在前列腺癌中扮演重要角色启动子甲基化是一种影响DNA转录活性的表观遗传调控机制。
近年来的研究表明,在前列腺癌中存在大量启动子甲基化事件。
这些甲基化改变可以引起多个肿瘤相关基因的静默或过度表达,影响细胞增殖、凋亡和转移等关键生物学过程。
二、前列腺癌的信号通路调控1. 雄激素受体信号通路在前列腺癌中的重要性雄激素受体(AR)信号通路是前列腺癌发生和发展中的核心调控机制。
在正常情况下,AR通过与雄激素结合调控细胞增殖和分化。
然而,在前列腺癌中,AR 通常被广泛过度表达或突变,使得肿瘤细胞对雄激素无处不在地敏感,并且即使在低雄激素水平下仍能持续活跃。
2. PI3K/AKT/mTOR信号通路异常激活PI3K/AKT/mTOR信号通路异常激活在前列腺癌发展中扮演重要角色。
当该通路被激活时,会导致细胞增殖加速、凋亡抑制以及血管新生等恶性特征的出现。
因此,针对该信号通路的抑制剂已经成为前列腺癌治疗领域的研究热点。
三、前列腺癌的治疗靶点1. AR信号通路是治疗前列腺癌的重要靶点由于AR信号通路在前列腺癌中的重要作用,因此针对该通路进行干预已成为治疗前列腺癌的主要策略之一。
目前,第一代雄激素阻断剂(如达尼索胺)以及第二代雄激素拮抗剂(如恩托维酮)已被广泛应用于临床实践,并取得了一定的效果。
2. 靶向PI3K/AKT/mTOR信号通路治疗前列腺癌除了针对AR信号通路进行治疗外,近年来越来越多的研究关注于PI3K/AKT/mTOR信号通路。

分析去势抵抗性前列腺癌化疗耐药机制的研究进展前列腺癌是男性最常见的恶性肿瘤之一,在治疗中,激素治疗和化疗是比较常用的方法,其中化疗可用于治疗抵抗性前列腺癌。
然而,化疗抵抗性对于前列腺癌来说是一个常见且难以处理的问题,因此研究去势抵抗性前列腺癌化疗耐药机制具有重要的意义。
近年来,许多研究表明,化疗抵抗是由多个因素共同影响引起的。
其中最重要的是复杂的信号通路以及在药物代谢和转运中的变化。
此外,DNA损伤修复和自噬等细胞生物学进程也可以影响化疗的效果。
固定用于治疗前列腺癌的化疗药物包括多个类别,如顺铂、紫杉醇类、土霉素类和多西紫杉醇。
然而,当这些药物开始具有耐药性时,治疗难以实现,因此研究抵抗前列腺癌的化疗药物是很重要的。
在治疗前列腺癌的化疗中,信号转导通路被证明对治疗反应具有重要影响。
通过合适的信号转导通路,前列腺癌细胞可以更容易地适应化疗环境,并且前列腺癌细胞也可以通过多种方式抑制药物诱导的凋亡。
另一个影响药物耐受性的因素是与药代谢相关的基因变异。
细胞可以通过表达不同基因型中不同的代谢酶来影响化疗药物的吸收和转运。
这些酶包括组蛋白脱乙酰酶、NAT2和MDR1等。
DNA损伤修复也与改善前列腺癌细胞的化疗耐药性有关。
细胞有多个途径来对DNA损伤响应,尤其是在前列腺癌中,这些途径对于药物的毒性非常重要。
通过诱导DNA修复,癌细胞可能会减少化疗对其的杀伤作用。
自噬是细胞自我降解的过程,这在前列腺癌中也可能发挥作用。
自噬通过清除细胞器和蛋白质来维持细胞稳态。
然而,当细胞对化疗产生了抗药性时,它们可以通过增加自噬途径中特定基因的表达来适应环境。
总之,去势抵抗性前列腺癌的化疗药物耐受性是一个复杂的问题,涉及多种机制和信号通路。
然而,对这些机制的研究可以为发展更有效的治疗方案提供指导。
目前,基于上述机制的治疗方案正在不断开发并在基础研究和临床实践中取得了一定成果。

医学研究生学报2020 年 9 月第33 卷第9 期J Afcd /W g r o, V〇1.33,N o.9, Septem ber, 2020995•综述H ippo途径治疗前列腺癌研究进展李梦轩综述,玄延花,金昱审校[摘要]前列腺癌是全世界第二大最常见的癌症,所有前列腺癌患者晚期都不可避免的发展成为去势抵抗型前列腺癌。
目前,去势抵抗前列腺癌尚无有效的治疗方法。
Hippo途径及其下游效应-转录共激活因子是干细胞和癌症生物学的重要调节 因子。
Hippo信号通路的过度活化在各种癌症中都很常见。
文章回顾Hippo通路与前列腺癌发生和发展的最新进展,研究了 Hippo通路与雄激素受体之间的相互调控作用,以及Y es相关蛋白和或带有PDZ结合序列的转录共激活因子的不受控制的表 达,如何通过诱导细胞干性来推动去势抵抗作一综述,为治疗去势抵抗型前列腺癌提供参考。
[关键词]Hi ppo通路;YAP/TAZ;前列腺癌;雄激素受体[中图分类号]R737.25 [文献标志码] A [文章编号]1008-8199(2020)09-0995-05[D O I] 10.16571/ki. 1008-8199.2020.09.020Research progress of Hippo pathway in the treatment of prostate cancerLI Meng-xuan review in g,XUAN Yan-hua,JIN Yu checking(Y a n b ia n U niversity C ollege o f M ed ic in e,Yanji 133002, J i lin,C h in a)[Abstract] Prostate cancer is the second most common cancer in the world. All prostate cancer patients inevitably develop into castration resistant prostate cancer in the late stage. Currently, there is no effective treatment for castration resistant prostate cancer. Hippo pathway and its downstream effect transcription co-activator are important regulatory factors in stem cells and cancer biology. Hippo pathway signaling hyperactivation is common across various cancers. Therefore, this article reviewed the latest developments in the Hippo pathway and the occurrence and development of prostate cancer, studied the regulatory interaction between Hippo pathway and the androgen receptor and how uncontrolled expression of Yes associated protein and/or Transcriptional co-activator with PDZ-bind- ing motif drives castration resistance by inducing cellular sternness and provide reference for the treatment of castration resistant prostate cancer.[Key words] Hippo pathway;YAP/TAZ;prostate cancer;androgen receptor〇引 言前列腺癌(prostate cancer,PCa)是全世界第二大最常见的癌症,也是男性癌症死亡的第六大原因,2018年估计有127万例新癌症病例和35万例死 亡[1]。

去势抵抗性前列腺癌化疗耐药机制的研究进展佚名【期刊名称】《中华实验外科杂志》【年(卷),期】2019(036)001【摘要】前列腺癌是老年男性常见的恶性肿瘤之一.化疗是治疗转移性去势抵抗性前列腺癌的有效方法,但多数患者在经过6~8个周期的全身化疗后会出现耐药,中位生存期不足1年.因此,阐明去势抵抗性前列腺癌与化疗耐药的相关机制显得十分重要.我们将围绕雄激素受体信号通路、微小RNA、肿瘤微环境、肿瘤干细胞以及相关分子事件,对前列腺癌化疗耐药的机制研究进展进行综述.%Prostate cancer is one of the most common malignancies in old males.While chemotherapy remains an effective method for metastatic castration resistant prostate cancer (mCRPC),most patients develop chemo-resistance with median survival less than 1 year after six to eight cycles of systematic chemotherapy.Therefore,it is very important to elucidate the mechanisms of CRPC and chemotherapy resistance.This article is to focus on the androgen receptor signaling pathway,micro-RNA,tumor microenvironment,cancer stem cells as well as related molecular events,and to summarize the research progress.【总页数】4页(P190-193)【正文语种】中文【相关文献】1.去势抵抗性前列腺癌对恩杂鲁胺耐药机制的研究进展 [J], 陈学栋;陆捷阳;俞世成;李恭会2.去势抵抗性前列腺癌化疗耐药机制的研究进展 [J], 胡斐;朱雅慧;许青3.去势抵抗性前列腺癌化疗研究进展 [J], 高建军4.益气散结法联合化疗治疗转移去势抵抗性前列腺癌的疗效观察 [J], 王雅琦;邱志敏;颜伟;郑智5.阿比特龙联合泼尼松用于未化疗转移性去势抵抗性前列腺癌治疗的效果及不良反应分析 [J], 崔当鸽;崔粉鸽;舒细娥;高娟碧;胡佳雯因版权原因,仅展示原文概要,查看原文内容请购买。


分析去势抵抗性前列腺癌化疗耐药机制的研究进展前列腺癌是男性最常见的恶性肿瘤之一,化疗是其主要的治疗手段之一。
大部分病例在接受一段时间的化疗后会出现耐药性,导致治疗效果降低或无效。
研究去势抵抗性前列腺癌化疗耐药机制成为当前的研究热点之一。
本文将对相关研究进展进行分析。
目前的研究表明,去势抵抗性前列腺癌化疗耐药机制与细胞凋亡逃避相关。
细胞凋亡是机体正常的细胞死亡过程,而肿瘤细胞通过各种途径逃避细胞凋亡,从而获得耐药性。
研究发现,去势抵抗性前列腺癌细胞中凋亡相关基因的表达发生变化,如BAX、BCL-2、p53等,这些基因的异常表达会抑制细胞凋亡,从而导致化疗耐药。
一些研究表明,去势抵抗性前列腺癌化疗耐药与DNA损伤修复能力降低有关。
化疗药物通常通过干扰DNA的正常功能,从而引起肿瘤细胞死亡。
去势抵抗性前列腺癌细胞中DNA损伤修复相关基因的表达出现异常,如BRCA1、BRCA2、ATM等,导致DNA损伤修复能力降低,从而减少了化疗药物对肿瘤细胞的杀伤作用。
一些研究还发现,去势抵抗性前列腺癌化疗耐药还与肿瘤干细胞的存在有关。
肿瘤干细胞是一小部分具有自我更新和分化能力的肿瘤细胞,它们具有抗药性和复发性,是导致化疗失败的主要原因之一。
研究发现,去势抵抗性前列腺癌中肿瘤干细胞的数量增加,并且其表面标记物的表达发生改变,使其免疫耐药、抗凋亡和抗氧化能力增强,从而导致化疗药物对肿瘤干细胞的杀伤能力降低。
一些研究还发现,去势抵抗性前列腺癌化疗耐药与细胞信号通路的异常激活有关。
如PI3K/AKT/mTOR信号通路的异常激活可以调节细胞凋亡和细胞周期,从而导致化疗药物对前列腺癌细胞的抗性增强。
研究还发现,STAT3、NF-κB等信号通路的异常激活与放化疗耐药相关。
去势抵抗性前列腺癌化疗耐药机制是一个复杂的过程,包括凋亡逃避、DNA损伤修复能力降低、肿瘤干细胞的存在以及细胞信号通路的异常激活等多个方面。
在今后的研究中,需要进一步深入探索这些机制,以寻找新的治疗靶点,提高化疗的治疗效果。


去势抵抗性前列腺癌形成机制的研究进展冯小兰; 黄喜健【期刊名称】《《医学综述》》【年(卷),期】2019(025)015【总页数】5页(P3019-3023)【关键词】去势抵抗性前列腺癌; 雄激素受体; 干细胞; 神经内分泌分化【作者】冯小兰; 黄喜健【作者单位】广西壮族自治区民族医院病理科南宁530001; 广西壮族自治区民族医院泌尿外科南宁530001【正文语种】中文【中图分类】R737.25前列腺癌是男性最常见的恶性实体肿瘤之一。
多数患者诊断时已为中晚期。
雄激素剥夺治疗(androgen deprivation therapy,ADT)是中晚期前列腺癌最主要的治疗方法,多数患者对ADT治疗初期有效,但经过18~36个月的治疗后,将逐渐发展为去势抵抗性前列腺癌(castration-resistant prostate cancer,CRPC),“去势”指利用手术去势或药物去势方式将95%来源于下丘脑-垂体-性腺轴的雄激素去除;“去势抵抗”指手术去势或药物去势后,其他途径如雄激素合成增加、肿瘤雄激素受体(androgen receptor,AR)改变及非雄激素信号活化等诸多因素导致疾病进展[1]。
CRPC发病机制至今不明,是当前研究的难点和热点。
有学者在已有前列腺癌基础和临床研究的基础上,提出了CRPC的3种形成机制:①AR相关机制。
AR信号通路的激活发挥重要作用。
②干细胞形成机制。
干细胞生长不依赖AR,能够在ADT治疗后向CRPC进展。
③神经内分泌转化机制[2]。
去势治疗可诱导前列腺癌细胞发生神经内分泌分化(neuroendocrine differentiation,NED),前列腺癌NED细胞不再依赖于AR信号通路而通过旁分泌和自分泌的作用促进前列腺癌细胞的生长。
现对CRPC形成机制的研究进展进行综述。
1 AR相关机制前列腺是性腺器官。
雄激素可以调节前列腺细胞的生长,并通过与前列腺细胞内的AR结合介导多种生物学功能。
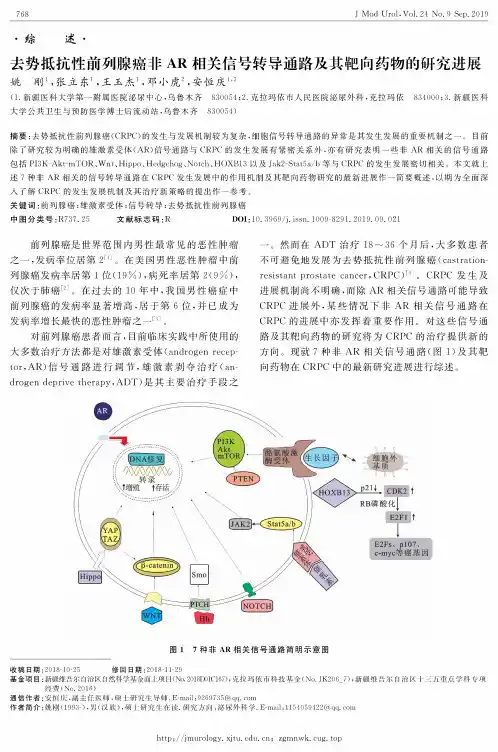
・综 述・去势抵抗性前列腺癌非AR 相关信号转导通路及其靶向药物的研究进展姚 刚1,张立东1,王玉杰1,邓小虎2,安恒庆13(1.新疆医科大学第一附属医院泌尿中心,乌鲁木齐 830054#.克拉玛依市人民医院泌尿外科,克拉玛依 834000#.新疆医科大学公共卫生与预防医学博士后流动站,乌鲁木齐830054)摘要:去势抵抗性前列腺癌(CRPC)的发生与发展机制较为复杂,细胞信号转导通路的异常是其发生发展的重要机制之一(目前 除了研究较为明确的雄激素受体(AR)信号通路与CRPC 的发生发展有紧密关系外,亦有研究表明一些非AR 相关的信号通路 包括 P3K-AktmTOR 、Wnt 、Hippo 、Hedgehog 、Notch 、HOXB13 以及 Jak2-Stat5a/b 等与 CRPC 的发生发展密切相关。
本文就上 述7种非AR 相关的信号转导通路在CRPC 发生发展中的作用机制及其靶向药物研究的最新进展作一简要概述,以期为全面深入了解CRPC 的发生发展机制及其治疗新策略的提出作一参考。
关键词:前列腺癌;雄激素受体;信号转导;去势抵抗性前列腺癌中图分类号:R737. 25 文献标志码:R DOI :10. 3969/j. issn. 1009-8291. 2019. 09. 021前列腺癌是世界范围内男性最常见的恶性肿瘤 之一,发病率位居第2「门。
在美国男性恶性肿瘤中前 列腺癌发病率居第1位(19%),病死率居第2(9%),仅次于肺癌「2*。
在过去的10年中,我国男性癌症中前列腺癌的发病率显著增高,居于第6位,并已成为 发病率增长最快的恶性肿瘤之一⑶(对前列腺癌患者而言,目前临床实践中所使用的 大多数治疗方法都是对雄激素受体(androgen recep tor, AR) 信号通路进行调节,雄激素剥夺治疗(an drogen deprive therapy,ADT)是其主要治疗手段之一(然而在ADT 治疗18〜36个月后,大多数患者 不可避免地发展为去势抵抗性前列腺癌(castration resistant prostate cancer , CRPC )4*。


分析去势抵抗性前列腺癌化疗耐药机制的研究进展CRPC的化疗耐药机制涉及多种因素,包括肿瘤细胞外环境、肿瘤细胞内环境及药物作用靶点等方面。
首先,肿瘤细胞外环境中的药物代谢和药物转运对化疗耐药发展有重要作用。
药物代谢酶能够清除体内药物,使其在肿瘤细胞内达到较低水平,从而导致化疗耐药。
药物转运分子(如ABCB1、ABCG2等)可能促进药物泵出,降低药物浓度,进而增加药物耐药性。
其次,肿瘤细胞内环境中的多种信号通路、增强型DNA修复机制以及转录因子等都参与了CRPC的化疗耐药。
其中,信号通路包括PI3K/Akt、Wnt、mTOR等,这些信号通路激活可以通过增强细胞存活能力、调节细胞周期等方式影响化疗的疗效;增强型DNA修复机制(如靶向修复、激活CYP450代谢等)可以使细胞对DNA损伤的抵抗性增强,进而降低化疗药物的疗效;而转录因子(如P53、NF-κB等)则可以影响细胞凋亡和反应性氧化物种的生成,从而影响化疗药物的疗效。
另外,药物作用靶点的改变也是化疗耐药的一个重要机制。
在化疗过程中,药物通常靶向肿瘤细胞的某些分子(如抑制雄激素合成等),在细胞适应性响应中,肿瘤细胞可能产生新的调节因子或途径,从而使靶点失去作用或药物产生复合效应,使化疗药物的疗效降低。
因此,目前在探索CRPC化疗耐药机制的过程中,有许多针对肿瘤细胞外环境、肿瘤细胞内环境及药物作用靶点的研究。
其中,针对肿瘤细胞外环境的策略主要包括调节ABCB1、ABCG2等药物转运分子的表达;针对肿瘤细胞内环境的策略主要包括抑制PI3K/Akt、Wnt、mTOR等常见信号通路,以及对肿瘤细胞进行辅助治疗(如激光治疗、基因治疗等);针对药物作用靶点的策略主要包括开发新的靶向药物、合理选用化疗组合方案等。
总之,CRPC的化疗耐药机制涉及多种因素,目前尚需进一步深入探索和研究。
针对不同的耐药机制,将药物组合与辅助疗法相结合,可能是CRPC治疗的有效方法。
未来的研究可以通过开发新的化疗药物、探索新的治疗靶点等,为CRPC患者的治疗带来新的突破。
2021年4月第29卷㊀第2期中国实验动物学报ACTA LABORATORIUM ANIMALIS SCIENTIA SINICAApril 2021Vol.29㊀No.2税雪,许荣,赵菊梅,等.去势抵抗性前列腺癌PDX 模型研究进展[J].中国实验动物学报,2021,29(2):230-235.Shui X,Xu R,Zhao JM,et al.Research progress in PDX models of castration-resistant prostate cancer [J].Acta Lab Anim Sci Sin,2021,29(2):230-235.Doi:10.3969/j.issn.1005-4847.2021.02.013[基金项目]国家自然科学基金(32070532)㊂Funded by National Natural Science Foundation of China(32070532).[作者简介]税雪(1995 ),女,研究生,研究方向:肿瘤分子病理与药物㊂Email:Pamelashui@ [通信作者]师长宏,男,博士生导师,研究方向:人类疾病的动物模型㊂Email:changhong@;赵菊梅,女,教授,硕士生导师,研究方向:肿瘤分子病理与药物㊂Email:jmz2003.stu@㊂∗共同通信作者去势抵抗性前列腺癌PDX 模型研究进展税雪1,2,许荣2,赵菊梅1∗,师长宏2∗(1.延安大学医学院,陕西延安㊀716000;2.空军军医大学实验动物中心,西安㊀710032)㊀㊀ʌ摘要ɔ㊀去势抵抗性前列腺癌(castration-resistant prostate cancer,CRPC)具有较高的发病率和死亡率,是前列腺癌的主要临床特征,且预后较差㊂建立具有CRPC 特征的肿瘤病人临床手术标本异种移植(patient-derivedxenograft,PDX)模型对于前列腺癌研究具有重要的意义㊂本文重点综述了多种CRPC PDX 模型的主要表型特征,包括激素非依赖表型㊁雄激素受体相关表型和神经内分泌表型,以及病理生理学特征,以期为CRPC 的发生机制和靶向药物筛选研究提供良好的实验工具㊂ʌ关键词ɔ㊀去势抵抗性前列腺癌;PDX 模型;雄激素受体;神经内分泌分化ʌ中图分类号ɔQ95-33㊀㊀ʌ文献标识码ɔA㊀㊀ʌ文章编号ɔ1005-4847(2021)02-0230-06Research progress in PDX models of castration-resistant prostate cancerSHUI Xue 1,2,XU Rong 2,ZHAO Jumei 1∗,SHI Changhong 2∗(1.Medical College of Yanan University,Yan an 716000,boratory Animal Center,the Air Force Medical University,Xi an 710032)Corresponding author:SHI Changhong.E-mail:changhong@;ZHAO Jumei.E-mail:jmz2003.stu@ ʌAbstract ɔ㊀Castration-resistant prostate cancer (CRPC)has high morbidity and mortality,and the prognosis forpatients is poor.Establishing patient-derived xenograft models with CRPC characteristics using clinical surgical specimens is critical for CRPC research.In this article,we review the main phenotypic characteristics of a variety of CRPC patient-derived xenograft models,including hormone-independent phenotypes,androgen receptor-related phenotypes andneuroendocrine phenotypes,as well as pathophysiological characteristics,and we discuss potential experimental tools for studying the mechanisms of CRPC and for targeted drug screening for the disease.ʌKeywords ɔ㊀castration-resistant prostate cancer (CRPC);patient-derived xenograft (PDX);androgen receptor;neuroendocrine differentiationConflicts of Interest:The authors declare no conflict of interest.㊀㊀前列腺癌(prostate cancer,Pca)的发病率与死亡率呈现逐年攀升趋势,已成为我国泌尿生殖系统常见的恶性肿瘤之一,严重威胁老年男性健康[1]㊂通过药物或手术等手段进行雄激素剥夺(androgen deprivation therapy,ADT)是目前治疗Pca 的主要方法,但随着医治时间延长,大多数患者都将会复发,发展为去势抵抗性前列腺癌(castration-resistant prostate cancer,CRPC),而CRPC 患者预后较差,平均中位生存期不满2年[2]㊂已证实,大多数CRPC 仍依赖于AR 信号通路[3],因此,一些新型的雄激素合成抑制剂和雄激素受体(androgen receptor,AR)通路抑制剂如:阿比特龙和恩杂鲁胺等在临床广泛使用[4-5]㊂但患者最终也会对这些药物产生耐药性㊂因此,迫切需要开发有效的模拟临床特征的动物模型,开展CRPC的发病机制和新型药物的研究㊂目前常应用于CRPC研究的动物模型主要包括细胞系异种移植模型(cell line-derived xenografts, CDX),遗传工程小鼠模型(genetically-engineered mouse models,GEMM)和人源化异种移植模型(patient-derived xenograft,PDX)㊂常用的CRPC细胞系22RV1,C4-2和DU145等经过长期体外培养,其基因谱表达水平和异质性较原发瘤会发生明显的变化[6];GEMM模型也由于成本较高且与临床差异较大等限制了其应用[7]㊂PDX模型的出现,很好的弥补了上述模型的不足㊂该类模型是通过将患者新鲜的肿瘤组织经皮下㊁肾包膜等不同方法移植到免疫缺陷小鼠体内建立㊂因其较好的保留了原发瘤的生物学特征和异质性,在临床药物筛选方面体现出良好的应用前景[8]㊂本文重点介绍利用临床肿瘤标本建立的不同类型的CRPC PDX模型,阐述该类模型的主要表型特征和病理生理学特征,以期为CRPC的发生机制和靶向药物筛选研究提供良好的实验工具㊂1㊀CRPC PDX模型的表型特征1.1㊀PDX模型的激素非依赖表型特征前列腺癌初期呈激素依赖性生长,在经ADT治疗以后,体内雄激素水平下降使肿瘤体积逐渐缩小,但CRPC的激素非依赖特性使肿瘤能在雄激素剥夺的情况下复发和远处转移[9]㊂近年来已有多个研究小组直接将复发后患者的肿瘤组织移植到免疫缺陷小鼠中构建了多例CRPC的PDX模型[10-12]㊂然而,也有研究发现通过这种途径构建的PDX模型并非总表现为激素非依赖特性㊂Corey 等[13]在LuCaP35模型中分析发现,CRPC肿瘤组织中的激素非依赖性细胞在雄激素存在的条件下,又恢复为激素依赖性表型㊂因此,这种方法构建的模型结果不稳定,人们开始探索其它方法㊂有研究小组尝试通过对激素依赖性的腺癌PDX模型进行ADT干预诱导CRPC的发生,该模型可以更好的展现临床CRPC患者向激素非依赖特性转变的动态发展过程㊂LAPC-9[14]㊁PC-310[15]和KuCaP-2[16]就是激素依赖性的PDX模型通过去势诱导获得的CRPC PDX模型㊂该类模型保持了与原发肿瘤相似的遗传特征,其生长不依赖于雄激素,表达AR和前列腺癌特异抗原(prostate specific antigen,PSA),很好地模拟了临床CRPC的进展过程,即激素依赖向非依赖性的转变[15-16]㊂更为重要的是,通过比对前列腺癌PDX模型CRPC发生前后的基因表达水平变化,可以深入研究CRPC形成的分子机制㊂比如,有研究者通过该动态转化模型,发现前列腺素E受体蛋白4(EP4)水平在CRPC后显著升高,且与PSA 水平呈正相关,这提示EP4可能是治疗CRPC的潜在靶点[16]㊂综上所述,使用去势诱导的CRPC PDX 研究前列腺癌由激素依赖表型向激素非依赖性表型的转化过程,将有助于探索CRPC的发生发展,从而为临床患者的治疗提供新策略㊂1.2㊀PDX模型的雄激素受体相关表型特征阻断雄激素-雄激素受体信号通路的转导可以抑制前列腺癌PDX模型肿瘤的进展和转移㊂但外源诱导使AR发生基因突变与变异,或表达上调时,该信号通路可再次被激活从而发挥促瘤作用[17]㊂有研究者比对PDX模型在去势和给予外源性雄激素的不同条件下肿瘤的生长情况,发现AR突变和剪接变异的CRPC PDX模型在补充外源性雄激素的情况下生长速度增快,而AR缺失的模型生长速度没有变化[10],这提示CRPC PDX模型的发展与AR有关㊂因此,越来越多的研究者在建立CRPC PDX模型的同时,将模型中AR的表达作为一个重要的监测指标㊂利用PDX模型研究发现,一方面AR基因变异可能是去势抵抗发生的潜在机制[11]㊂例如,雄激素受体剪接变体7(AR splice variant7, AR-V7)作为CRPC中检出频率最高的剪切变异体之一,可以促进LuCaP96CR模型肿瘤的发展[18];另一方面,AR基因变异与新型内分泌治疗药物的耐药性产生也有关[19-21]㊂Lawrence等[10]在CRPC PDX模型中发现了表达缺失的雄激素受体剪接变异体AR-s567es,并证实AR缺失和AR突变可能是原发肿瘤患者对阿比特龙和恩杂鲁胺耐药的重要分子机制㊂也有人使用LuCaP35CR模型发现AR-V7的变异与CRPC耐药性相联系,进而揭示AR-V7可作为指导CRPC患者药物选择的分子标志物[12],同样的结果也在CWR22模型中得到印证[22]㊂1.3㊀PDX模型的神经内分泌(neuroendocrine, NE)表型特性神经内分泌前列腺癌(neuroendocrine prostatecancer,NEPC)是一种CRPC亚型,恶性度极高,不表达PSA和AR,而突触素(SYP)㊁嗜铬粒蛋白A (CgA)㊁CD56和神经元特异性烯醇化酶(NSE)等神经内分泌标志物为阳性㊂研究表明,NEPC多发生于AR抑制剂治疗之后,且与临床不良预后明确相关[23]㊂目前对于NEPC的起源尚未形成共识,Lin 等[24]对前列腺腺癌PDX模型LTL331和NEPC PDX模型LTL331R进行了比对研究,相应的DNA 和RNA测序结果支持NEPC可以通过适应性反应直接从腺癌转分化而来的假说,并且在这过程中可能产生了一组参与神经内分泌转分化(neuroendocrine differentiation,NED)的基因㊂该结果引起了众多学者的关注,研究者陆续发起了多个NED分子机制的研究㊂基于相关CRPC PDX模型和NEPC PDX模型的实验证实,异染色质蛋白1α(HP1α)[25]㊁SRRM4[26]及PEG10[27]的异常表达可能是介导NEPC发生的新机制㊂此外,也有一部分人支持另一种假说,即NEPC来源于前列腺腺体正常的神经内分泌细胞癌变及前列腺肿瘤干细胞转化㊂van Haaften-Day等[28]对其所建立的NEPC模型UCRU-PR-2的综合分析结果,支持该假说㊂截至目前,NEPC的起源仍在探索中,研究的热点主要集中于激素依赖性前列腺癌(hormone-naïve prostate cancer,HNPC)/CRPC模型向NEPC模型动态演化过程㊂有人直接利用NEPC患者肿瘤组织建立了静态NEPC PDX模型㊂这类模型的制备主要是通过将患者新鲜肿瘤组织剪碎后植入6~8周免疫缺陷的雄性小鼠体内,待瘤体长至适当体积时行去势手术,去势后小鼠瘤体继续生长并能稳定传代视为建模成功㊂如LuCaP49模型[29]㊂这类静态模型虽然较好地展现出与原发瘤相似的病理学结构和遗传特征,但对于模拟前列腺癌临床动态进展过程具有一定的局限性㊂在将去势后肿瘤再复发的激素依赖性前列腺癌PDX模型诱导为CRPC PDX 模型的基础上,取该模型的小鼠瘤体接种至已提前去势的雄性小鼠皮下并给予药物等处理因素进而诱导为NEPC PDX模型㊂这种体现疾病动态过程的模型制备方法,能够完整地再现临床病人的特征,是理想的动物模型㊂Jongsma等[30]建立的NE 分化模型PC-310,为HNPC PDX模型转变为NEPC 表型奠定了良好基础㊂Wu等[31]使用多西紫杉醇诱导B45354模型出现NE特征,为研究NE细胞在Pca进展过程中的作用提供了优良的动物模型㊂但由于缺乏大量的PDX模型进行支撑和考证,上述实验结果有待进一步确认,因此,建立NEPC动态研究模型仍然需要不断地努力㊂2㊀CRPC PDX模型的肿瘤病理生理学特征㊀㊀为了更好的了解临床患者肿瘤的病理生理学特征,在CRPC PDX模型上进行扩散,转移和耐药等病理研究,能够为转移相关信号通路识别和靶向药物测试提供重要参考㊂2.1㊀PDX模型的扩散和转移特性扩散和转移是前列腺癌重要的生物特征㊂据调查显示,转移性CRPC(metastatic castration resistant prostate cancer,mCRPC)肿瘤细胞最常定植于骨骼(55%),其次是淋巴结(52%)和肝(48%)[32]㊂CRPC患者一旦发生骨转移,其死亡风险将显著升高㊂因此,mCRPC的扩散和转移机制已成为前列腺癌防治研究的重要环节,成功建立真实模拟人CRPC组织细胞扩散和转移生物学行为及特征的PDX模型已成为研究的重点㊂目前,制备mCRPC PDX的方法多是通过将CRPC PDX模型的瘤体制成单细胞悬液,再经原位注射到免疫缺陷小鼠体内,观察注射部位肿瘤生长情况[32]㊂这种制备方法的优势在于能在较短的时间内成模,并且人为决定肿瘤生长部位,从而提高mCRPC PDX模型的成功率㊂该模型主要应用于转移机制和新药开发研究㊂多项实验证实,成骨细胞表型CRPC PDX模型在前列腺癌转移研究中具有独特优势㊂例如, Kiefer等[33]使用骨保护素Fc-OPG(osteoprotegerin, Fc-OPG)作用于骨转移PDX模型LuCaP23.1,明确了Fc-OPG的使用可减慢骨骼瘤的生长速度并降低血清PSA水平㊂Chiang等[34]利用前列腺癌转移性LTL-313H和非转移性LTL-313B模型的基因表达谱差异,筛选出与转移相关的驱动基因GATA2㊂同样,这两种模型也被用于TMEM45B基因的筛选[35],并确认上述基因的过表达与前列腺癌的进展和转移密切相关,从而为预测转移提供了新的生物标志物㊂2.2㊀PDX模型的耐药特性CRPC的临床治疗方法以激素治疗和化疗居多,此外还包括免疫治疗和放射核素治疗㊂目前已有研究将CRPC PDX模型应用于以上不同治疗方案的临床前研究㊂由于PDX模型缺乏免疫细胞,无法准确模拟机体免疫系统与肿瘤之间的相互作用关系,因此该模型在肿瘤免疫治疗研究中具有一定的局限性㊂但免疫系统人源化小鼠模型的成功建立为该类研究提供了良好的实验工具[36]㊂在激素治疗药物的相关研究中,PDX模型也体现出良好的优势,如阿比特龙(abiraterone)能阻断肿瘤内外雄激素的合成,适用于联合治疗等,从而显著提高进展期mCRPC患者的生存期,但也可能导致耐药[12,37]㊂最近有研究将阿比特龙作用于不同系列LuCaP模型以评估肿瘤对药物敏感性程度,结果发现LuCaP35CR作为耐阿比特龙的PDX模型,表达了一系列与持续低水平AR信号转导相关的生物遗传标志物[38]㊂因此,开发这类耐药表型的CRPC PDX具有巨大的潜在应用价值,具有代表性的一个例子是Lee等[39]应用MDA PCa118b PDX模型发现了CRPC骨转移的耐药机制,结果显示骨转移灶中也存在对卡博替尼耐药的肿瘤细胞,其耐药原因是因为表达了整联蛋白配体㊂另外,这类耐药模型还可用于新治疗方案的开发㊂Suominen等[40]通过耐阿比特龙的LuCaP58模型成功测定出放射性药物镭223的作用方式和抗肿瘤功效,结果显示镭223能够在短时间内诱导癌细胞的DNA双链发生断裂以及PSA水平下降,从而成功抑制肿瘤诱导的成骨细胞生长㊂Low等[41]利用耐恩杂鲁胺的CRPC PDX模型证实RNA聚合酶I抑制剂BMH-21可以显著抑制肿瘤的生长并降低Ki67的增殖指数㊂并有研究者将RNA聚合酶I抑制剂与PIM激酶抑制剂联合作用于PDX模型,从而开发出一种新型的CRPC治疗方法[42]㊂同样,Lawrence等[10]也发现核糖体靶向剂能对耐恩杂鲁胺和阿比特龙的CRPC PDX模型重新敏感㊂此外,随着近年来对CRPC耐药机制的深入探索,相关通路的治疗靶标也在不断被开发㊂如针对CRPC对mTOR途径的依赖性,La 等[43]将mTOR途径抑制剂Rapalink-1作用于CRPC PDX和体外肿瘤类器官发现,Rapalink-1可以导致小鼠肿瘤消退,具有明显的抗肿瘤效力㊂3 展望成功建立模拟临床特征的高保真CRPC PDX 模型已成为CRPC病理机制研究和靶向药物筛选的重要前提㊂理想的CRPC PDX模型不仅需要准确模拟原发肿瘤的生物学特征及其异质性,而且其疾病的进展过程及特定基因的表达情况也应与临床结果高度相似㊂但目前CRPC PDX模型的构建仍存在诸多问题,如模型的总体成功率较低,成本较高,建模周期长等,这些因素限制了CRPC PDX模型的发展与应用㊂为此,研究者们正尝试采取补充外源性雄激素[44],从激素依赖的前列腺癌模型逐步诱导等不同策略,改进现阶段模型存在的不足,以增加动物模型和人类疾病之间的相似性,更好的促进临床前研究成果向临床的转化㊂参㊀考㊀文㊀献(References)[1]㊀Siegel RL,Miller KD,Jemal A.Cancer statistics[J].CACancer J Clin,2020,70(1):7-30.[2]㊀Lowrance WT,Murad MH,Oh WK,et al.Castration-resistantprostate cancer:AUA guideline amendment[J].J Urol,2018,200:1264-1272.[3]㊀Watson PA,Arora VK,Sawyers CL.Emerging mechanisms ofresistance to androgen receptor inhibitors in prostate cancer[J].Nat Rev Cancer,2015,15(12):701-711.[4]㊀de Bono JS,Logothetis CJ,Molina A,et al.Abiraterone andincreased survival in metastatic prostate cancer[J].N Engl JMed,2011,364(21):1995-2005.[5]㊀Hussain M,Fizazi K,Saad F,et al.Enzalutamide in men withnonmetastatic,castration-resistant prostate cancer[J].N Engl JMed,2018,378:2465-2474.[6]㊀Dobbin ZC,Katre AA,Steg AD,et ing heterogeneity ofthe patient-derived xenograft model to identify the chemoresistantpopulation in ovarian cancer[J].Oncotarget,2014,5(18):8750-8764.[7]㊀de Morrée E,Soest R,Aghai A,et al.Understanding taxanes inprostate cancer;importance of intratumoral drug accumulation[J].Prostate,2016,76(10):927-936.[8]㊀van Weerden WM,Bangma C,de Wit R.Human xenograftmodels as useful tools to assess the potential of novel therapeuticsin prostate cancer[J].Br J Cancer,2009,100(1):13-18.[9]㊀Abd Wahab NA,Lajis NH,Abas F,et al.Mechanism of anti-cancer activity of curcumin on androgen-dependent and androgen-independent prostate cancer[J].Nutrients,2020,12(3):679-713.[10]㊀Lawrence MG,Obinata D,Sandhu S,et al.Patient-derivedmodels of abiraterone-and enzalutamide-resistant prostate cancerreveal sensitivity to ribosome-directed therapy[J].Eur Urol,2018,74(5):562-572.[11]㊀Sun S,Sprenger CC,Vessella RL,et al.Castration resistance inhuman prostate cancer is conferred by a frequently occurringandrogen receptor splice variant[J].J Clin Invest,2010,120(8):2715-2730.[12]㊀Mostaghel EA,Marck BT,Plymate SR,et al.Resistance toCYP17A1inhibition with abiraterone in castration-resistantprostate cancer:induction of steroidogenesis and androgenreceptor splice variants[J].Clin Cancer Res,2011,17(18):5913-5925.[13]㊀Corey E,Quinn JE,Buhler KR,et al.LuCaP35:a new modelof prostate cancer progression to androgen independence[J].Prostate,2003,55(4):239-246.[14]㊀Craft N,Chhor C,Tran C,et al.Evidence for clonal outgrowthof androgen-independent prostate cancer cells from androgen-dependent tumors through a two-step process[J].Cancer Res,1999,59(19):5030-5036.[15]㊀Jongsma J,Oomen MH,Noordzij MA,et al.Androgendeprivation of the PC-310[correction of prohormone convertase-310]human prostate cancer model system inducesneuroendocrine differentiation[J].Cancer Res,2000,60(3):741-748.[16]㊀Terada N,Shimizu Y,Kamba T,et al.Identification of EP4as apotential target for the treatment of castration-resistant prostatecancer using a novel xenograft model[J].Cancer Res,2010,70(4):1606-1615.[17]㊀Zhao N,Peacock SO,Lo CH,et al.Arginine vasopressinreceptor1a is a therapeutic target for castration-resistant prostatecancer[J].Sci Transl Med,2019,11(498):1206-1215.[18]㊀DiPippo VA,Nguyen HM,Brown LG,et al.Addition of PSMAADC to enzalutamide therapy significantly improves survival in invivo model of castration resistant prostate cancer[J].Prostate,2016,76(3):325-334.[19]㊀Kregel S,Wang C,Han X,et al.Androgen receptor degradersovercome common resistance mechanisms developed duringprostate cancer treatment[J].Neoplasia,2020,22(2):111-119.[20]㊀Wang S,Yang S,Nan C,et al.Expression of androgen receptorvariant7(AR-V7)in circulated tumor cells and correlation withdrug resistance of prostate cancer cells[J].Med Sci Monit,2018,24:7051-7056.[21]㊀Kwegyir-Afful AK,Ramalingam S,Ramamurthy VP,et al.Galeterone and the next generation galeterone analogs,VNPP414and VNPP433-3βexert potent therapeutic effects in castration-/drug-resistant prostate cancer preclinical models in vitro and invivo[J].Cancers(Basel),2019,11(11):1637-1655. [22]㊀Seedhouse SJ,Affronti HC,Karasik E,et al.Metastaticphenotype in CWR22prostate cancer xenograft followingcastration[J].Prostate,2016,76(4):359-368. [23]㊀Cornford P,Bellmunt J,Bolla M,et al.EAU-ESTRO-SIOGguidelines on prostate cancer.part II:treatment of relapsing,metastatic,and castration-resistant prostate cancer[J].EurUrol,2016,71(4):630-642.[24]㊀Lin D,Wyatt AW,Xue H,et al.High fidelity patient-derivedxenografts for accelerating prostate cancer discovery and drugdevelopment[J].Cancer Res,2014,74(4):1272-1283.[25]㊀Ci X,Hao J,Dong X,et al.Heterochromatin protein1αmediates development and aggressiveness of neuroendocrineprostate cancer[J].Cancer Res,2018,78(10):2691-2704.[26]㊀Li Y,Donmez N,Sahinalp C,et al.SRRM4drivesneuroendocrine transdifferentiation of prostate adenocarcinomaunder androgen receptor pathway inhibition[J].Eur Urol,2017,71(1):68-78.[27]㊀Akamatsu S,Wyatt AW,Lin D,et al.The Placental GenePEG10promotes progression of neuroendocrine prostate cancer[J].Cell Rep,2015,12(6):922-936.[28]㊀van Haaften-Day C,Raghavan D,Russell P,et al.Xenograftedsmall cell undifferentiated cancer of prostate:possible commonorigin with prostatic adenocarcinoma[J].Prostate,1987,11(3):271-279.[29]㊀True LD,Buhler K,Quinn J,et al.A neuroendocrine/small cellprostate carcinoma xenograft-LuCaP49[J].Am J Pathol,2002,161(2):705-715.[30]㊀Jongsma J,Oomen MH,Noordzij MA,et al.Different profiles ofneuroendocrine cell differentiation evolve in the PC-310humanprostate cancer model during long-term androgen deprivation[J].Prostate,2002,50(4):203-215.[31]㊀Wu P,Xu R,Chen X,et al.Establishment and characterizationof patient-derived xenografts for hormone-naïve and castrate-resistant prostate cancers to improve treatment modality evaluation[J]Aging(Albany NY),2020,12(4):3848-3861. [32]㊀Pinthus JH,Waks T,Schindler DG,et al.WISH-PC2:a uniquexenograft model of human prostatic small cell carcinoma[J].Cancer Res,2000,60(23):6563-6567.[33]㊀Kiefer JA,Vessella RL,Quinn JE,et al.The effect ofosteoprotegerin administration on the intra-tibial growth of theosteoblastic LuCaP23.1prostate cancer xenograft[J].Clin ExpMetastasis,2004,21(5):381-387.[34]㊀Chiang YT,Wang K,Fazli L,et al.GATA2as a potentialmetastasis-driving gene in prostate cancer[J].Oncotarget,2014,5(2):451-461.[35]㊀Luo F,Yang K,Wang YZ,et al.TMEM45B is a novelpredictive biomarker for prostate cancer progression andmetastasis[J].Neoplasma,2018,65(5):815-821. [36]㊀郭文文,乔天运,张彩勤,等.免疫系统人源化小鼠模型的构建及其在肿瘤治疗研究中的应用[J].中国比较医学杂志,2019,29(11):98-104.Guo WW,Qiao TY,Zhang CQ,et al.Establishment of mousemodels with a humanized immune system and applications fortumor immunotherapy[J].Chin J Comp Med,2019,29(11):98-104.[37]㊀Kluetz PG,Ning YM,Maher VE,et al.Abiraterone acetate incombination with prednisone for the treatment of patients withmetastatic castration-resistant prostate cancer:U.S.Food andDrug Administration drug approval summary[J].Clin CancerRes,2013,19(24):6650-6656.[38]㊀Lam HM,Mcmullin R,Nguyen HM,et al.Characterization of anabiraterone ultraresponsive phenotype in castration-resistantprostate cancer patient-derived xenografts[J].Clin Cancer Res,2017,23(9):2301-2312.[39]㊀Lee YC,Lin SC,Yu G,et al.Identification of bone-derivedfactors conferring de novo therapeutic resistance in metastaticprostate cancer[J].Cancer Res,2015,75(22):4949-4959.[40]㊀Suominen MI,Fagerlund KM,Rissanen JP,et al.Radium-223inhibits osseous prostate cancer growth by dual targeting of cancercells and bone microenvironment in mouse models[J].ClinCancer Res,2017,23(15):4335-4346.[41]㊀Low JY,Sirajuddin P,Moubarek M,et al.Effective targeting ofRNA polymerase I in treatment-resistant prostate cancer[J].Prostate,2019,79(16):1837-1851.[42]㊀Rebello RJ,Kusnadi E,Cameron DP,et al.The dual inhibitionof RNA Pol I transcription and pim kinase as a new therapeuticapproach to treat advanced prostate cancer[J].Clin CancerRes,2016,22(22):5539-5552.[43]㊀La Manna F,De Menna M,Patel N,et al.Dual-mTOR inhibitorRapalink-1reduces prostate cancer patient-derived xenograftgrowth and alters tumor heterogeneity[J].Front Oncol,2020,10:1012.[44]㊀Lawrence MG,Pook DW,Wang H,et al.Establishment ofprimary patient-derived xenografts of palliative TURP specimensto study castrate-resistant prostate cancer[J].Prostate,2015,75(13):1475-1483.[收稿日期]㊀2020-07-27中国医学科学院首次建立新冠肺炎恒河猴模型,当选 中国生命科学十大进展 SARS-CoV-2引起的COVID-19暴发,对全球构成了重大公共卫生威胁㊂动物模型对于阐明病毒感染与发病机制㊁传播途径以及药物和疫苗评价十分关键,是国务院联防联控机制科研攻关组部署的五大主攻方向之一㊂中国医学科学院医学实验动物研究所秦川团队率先建立了COVID-19的转基因小鼠模型和恒河猴模型,并于2020年2月18日通过科技部组织的新冠动物模型鉴定㊂这两种动物模型首次阐明了SARS-CoV-2感染的致病性,加深了对COVID-19病因学和病理学的认知,促进了抗病毒药物和疫苗研发㊂该项研究作为知识创新类项目 新冠肺炎动物模型的构建 ,于2021年1月13日当选中国科协生命科学学会联合体评选的2020年度中国生命科学十大进展,对防控当前全球面临的新冠肺炎疫情有重大意义㊂其中,恒河猴新冠肺炎模型研究,由秦川团队联合中国疾病预防控制中心病毒病预防控制所㊁中国医学科学院病原生物学研究所㊁首都医科大学的研究团队进行,研究成果发表于‘动物模型与实验医学(英文)“期刊(Animal Model&Experimental Medicine,2020,3:93-97)㊂该模型是国际上第一个构建的新冠病毒恒河猴模型,其研制方法和标准已提供给世界卫生组织(WHO),供国际研究使用㊂。
分析去势抵抗性前列腺癌化疗耐药机制的研究进展前列腺癌是男性最常见的恶性肿瘤之一。
虽然化疗是前列腺癌治疗中的重要手段之一,但患者经常出现化疗抵抗性,这导致了治疗失败和患者死亡。
因此,研究前列腺癌化疗耐药机制是非常必要的。
去势抵抗性是前列腺癌治疗中最常见的耐药机制之一。
在去势抵抗性前列腺癌中,睾酮水平降低,导致肿瘤细胞在低激素水平下增殖、生存和转移。
研究表明,去势后前列腺癌细胞在骨髓微环境中能够得到足够的营养和生长因子的供应,这导致前列腺癌细胞在肿瘤细胞周围的骨骼结构内长期存活和繁殖,并产生明显的耐药性。
研究证明,一些信号通路在前列腺癌化疗耐药中起着关键作用。
例如,抗肿瘤药物诱导的激活肾上腺素能受体-β2激活Erk信号通路是导致化疗耐药的机制之一。
另外,PI3K/Akt/mTOR通路的过度活化也被认为是化疗耐药的机制。
通此外,ATP结合盒(ABC)转运体家族的过度表达也促进前列腺癌化疗耐药。
ABC转运体家族的基因在单一突变的情况下可以被高度表达,这在治疗抗肿瘤药物中也是相当重要的。
除此之外,DNA修复机制可能也是重要的耐药机制。
前列腺癌细胞中高表达的MRE11蛋白和其他参与DNA双链断裂修复的蛋白可能导致化疗失败和耐药性增加。
近年来,研究表明某些不同类型肿瘤之间的化疗耐药机制偏向于相互重叠。
利用组合治疗或通过针对多种上述机制的联合靶向治疗可能是化疗耐药前列腺癌治疗的有效途径。
例如,抑制PI3K/Akt/mTOR通路和ABC转运体家族表达的AKT抑制剂可在前列腺癌的治疗中产生协同作用。
另外,研究还表明,BET抑制剂和抑制TAK1信号通路的药物可以在前列腺癌细胞中作为有效的联合治疗药物。
总之,研究前列腺癌化疗耐药机制是非常重要的。
未来的研究应该注重探究多种耐药机制之间的关系,并寻找更多有效的联合治疗方案,以提高前列腺癌患者的治疗效果。
分析去势抵抗性前列腺癌化疗耐药机制的研究进展
前列腺癌是男性常见的恶性肿瘤之一,化疗是其治疗的重要手段之一。
然而,许多患
者往往会在化疗过程中产生耐药现象,导致治疗效果不佳。
其中,去势抵抗性前列腺癌(CRPC)的耐药性更为严重,是目前晚期前列腺癌治疗的难点之一。
本文将对CRPC耐药机制的研究进展进行分析。
1. 雄激素受体(AR)的局部表达水平下降
AR在前列腺癌细胞生长和分化中扮演着重要作用。
在CRPC的治疗过程中,由于长期
去势治疗等因素,AR的表达水平会下降,降低了细胞对药物的敏感性。
此外,AR的突变和拷贝数变异等也容易导致耐药性的形成。
2. MDR1、MRP1等药物外排泵的过度表达
多重耐药(MDR)现象是各种肿瘤细胞耐药性的共性表现,其中MDR1和MRP1相较其他泵更为常见。
这些外排泵可以通过将药物从细胞内向外排出,使前列腺癌细胞对化疗药物
产生耐药性。
3. 翻译后修饰调控
翻译后修饰在CRPC耐药性中的作用越来越受到关注。
比如,蛋白酶体的增加可能导致前列腺癌细胞对化疗药物的抵抗性增加。
此外,越来越多的研究表明,N-甲基转移酶(NMT)也可能参与耐药性的形成。
4. 其他机制
除了以上几个方面,还有一些研究表明,PI3K/Akt信号通路、Wnt/β-catelin信号通路等对CRPC耐药机制也存在着影响。
总之,CRPC的耐药机制非常复杂,涉及多个层面、多个信号通路的影响。
针对其耐药性的治疗研究也日益深入,目前已经有一些新的抗肿瘤药物和治疗策略得到了验证并取得
了不错的效果,可望为CRPC患者带来更好的治疗前景。