含磷手性配体及在不对称催化中的应用
- 格式:pdf
- 大小:365.98 KB
- 文档页数:6

一种手性双膦配体在不对称催化氢化制备度洛西汀中的应用研究陆锦平;陈国术;刘吉旦;陈亿新【摘要】度洛西汀是5-羟色胺和去肾上腺素再摄取抑制剂,第三代抗抑郁药.应用手性双膦配体(P-Phos)不对称催化氢化制备度洛西汀的关键中间体,在40 ℃、3 MPa H2、异丙醇为溶剂的条件下使3-(二甲胺基)-1-(2-噻吩基)-1-丙酮转化为(S)-3-(二甲胺基)-1-(2-噻吩基)-1-丙醇,并取得了极好的收率(99%)和对映选择性(94% ee),产品经重结晶,光学纯度>99% ee.度洛西汀全合成总收率为87%.【期刊名称】《广州大学学报(自然科学版)》【年(卷),期】2016(015)003【总页数】4页(P39-42)【关键词】抗抑郁药;不对称催化氢化;度洛西汀;双膦配体【作者】陆锦平;陈国术;刘吉旦;陈亿新【作者单位】广州大学化学化工学院,广东广州510006;广州大学化学化工学院,广东广州510006;广州大学化学化工学院,广东广州510006;广州大学化学化工学院,广东广州510006【正文语种】中文【中图分类】O63盐酸度洛西汀(Duloxetine hydrochloride),化学名为(S)-N-甲基-3-(1-萘氧基)-3-(2-噻吩基)-1-丙胺盐酸盐,由美国Eli Lilly公司开发的一类具有噻吩结构的抗抑郁药物,能够有效地抑制5-羟色胺和去肾上腺素的再吸收[1],2002年9月经美国FDA批准,用于成人重度抑郁症的治疗[2],并于2004年被欧盟和美国FDA批准用于妇女紧张性尿失禁和成人糖尿病继发的外周神经疼痛的治疗[3].鉴于度洛西汀年销售额高达50亿美元,并且专利保护已于2013年12月到期,度洛西汀新合成方法的研究已成为当前市场迫切需求的创新技术[4].度洛西汀的合成路线是以3-(二甲胺基)-1-(2-噻吩基)-1-丙酮为原料,经还原、手性拆分或不对称催化[5-6]得到关键中间体(S)-3-(二甲胺基)-1-(2-噻吩基)-1-丙醇,再经芳基化和成盐得产物盐酸度洛西汀(图1).度洛西汀目前的生产工艺主要使用化学还原方法得到外消旋醇,再用扁桃酸将外消旋的中间体拆分,其中的R-构型中间体没有利用价值,收率低,步骤繁琐[7-9];而不对称催化氢化合成方法简单,一步到位,因此成为目前研究的热点.CHAN开发的新型含N联吡啶双膦配体(PPhos)在不对称催化氢化中是最有工业应用前景的手性配体[10](图2).含联吡啶结构双膦手性配体应用于不对称催化反应中具有潜在的优势,配体中的N杂环属于富电子体系,其与金属配位形成手性催化剂,一方面,可以极大地提高对反应中间体手性面的控制,从而提高反应的对映选择性;另一方面,由于催化剂含有N杂环,只须通过调节溶液的酸碱性就可以从反应体系中回收催化剂.本文首次报道了应用手性双膦配体(P-Phos)不对称催化氢化制备度洛西汀的新工艺研究,并且对反应影响因素也进行了系统的考察.1.1 主要试剂与仪器上海民标FA1104电子分析天平;巩义英峪予华SHZ-D循环水泵;美国Ashcroft高压反应釜;日本EYELA N-1000旋转蒸发仪;美国 HPLC-Agilent 1100高效液相色谱仪;德国Bruker 400 MHz核磁共振谱仪.所用溶剂全部按照标准方法进行了纯化,并在氮气环境下保存.[RuCl2(benzene)]2和其它试剂均购于百灵威公司,氢气为99.9%高纯气体.1.2 催化剂制备度洛西汀中间体前手性酮3-(二甲胺基)-1-(2-噻吩基)-1-丙酮按照文献方法[11-12]改进后合成,以乙酰噻吩、多聚甲醛和盐酸二甲胺为起始原料,经Mannich反应,最终得到白色针状晶体产物,产率94%.催化剂trans-RuCl2[(S)-P-Phos][(S)-daipen]的制备:在氮气保护下,102.4 mg(0.159 0 mmol)(R)-P-Phos、39.8 mg(0.079 5 mmol)[RuCl2(benzene)]2、3 mL DMF加入到 15 mL容量的Schlenk反应管中.100℃条件下反应20 min得到红棕色溶液.冷却至室温后,加入50 mg(0.159 mmol)(S)-daipen,然后继续反应6 h.减压蒸去 DMF,残留物溶解于4 mL无水乙醚中,过滤除去黑色不溶物,滤液浓缩得浅棕色固体.1.3 催化反应不对称氢化实验过程:取0.5 mmol底物、2.1 mg(0.002mmol) trans-RuCl2[(S)-P-Phos][(S)-daipen]、4 μL(0.004 mmol)1M氢氧化钾的异丙醇溶液,3 mL脱气异丙醇加入高压反应釜中,通入氢气至3 MPa,室温磁力搅拌反应24 h. TLC监测反应完全,反应混合物真空旋转蒸发至浓缩液,经快速柱层析分离,得到白色粉末状目标产物(S)-3-(二甲胺基)-1-(2-噻吩基)-1-丙醇,收率>99%(HPLC检测).1H NMR(400 MHz,CDCl3)δ 7.20(dd,J=5.0,1.2 Hz,1H),7.02 ~6.90(m,2H),5.17(dd,J=7.9,4.2 Hz,1H),2.67~2.49(m,2H),2.28(s,6H),1.99 ~1.86(m,2H).13C NMR (100 MHz,CDCl3)δ 149.94,126.67,123.75,122.34,72.17,58.17,45.39,34.78.Ee值经高效液相色谱手性OD-H柱检测,(流速:0.75 mL/min;正己烷∶异丙醇= 99∶1(包括0.2%二乙胺),λ=234 nm,Tminor= 30.96 min,Tmajor=36.96 min)白色固体.(99%ee).1.4 盐酸度洛西汀的合成配有冷凝管、恒压滴液漏斗和磁力搅拌的100 mL三口烧瓶中加入2.00 g(10.8 mmol)(S)-3-(二甲胺基)-1-(2-噻吩基)-1-丙醇,DMSO 20 mL,室温搅拌下加入氢化钠0.35 g(14.2 mmol),反应0.5 h后,缓慢滴加1-氟萘1.5 mL(14.2 mmol),滴毕,升温至50℃下反应5 h,TLC监测反应完全,冷却至室温,将反应液倒入冰水中,乙酸乙酯萃取,合并有机层,无水Na2SO4干燥,过滤后滴加盐酸调节pH值为4~5,析出产品,少量乙醇洗涤,干燥称重2.96 g,收率87%.1H NMR(400 MHz,CDCl3)δ 8.33(m,1H),7.76(m,1H),6.84~7.48(m,8H),5.76(m,1H),2.50(m,2H),2.25(s,6H),2.18~2.45(m,2H).以3-(二甲胺基)-1-(2-噻吩基)-1-丙酮为反应底物,P-Phos为手性配体,中心金属为苯基氯化钌,助剂为手性二胺[(S)-daipen],室温反应 24 h,考察了反应的影响因素(表1).当底物与催化剂摩尔比为100,H2压力为3 MPa,在此条件下,考察了不同溶剂对反应的影响,以甲醇为溶剂,得到极低的收率和良好的对映选择性(86%ee)(编号1);异丙醇为溶剂,反应转化率为99%,对映选择性(94%ee),再经过简单的结晶,产品的光学纯度(>99%ee)(编号2);而用甲苯、四氢呋喃和二氯甲烷为溶剂,则反应不能进行.显然,含氧溶剂参与了不对称催化氢化过程.反应式见图3.图3反应过程中碱作为助剂,叔丁醇钾与KOH的效果基本接近,都具有很高的转化率和对映选择性.当使用碳酸钾时,反应的转化率只有78%(编号9),说明弱碱效果没有强碱好.氢气压力对反应也有明显影响,压力低,反应不完全,转化率和对映选择性都降低(编号6),压力提高,反应速度加快,转化率和光学选择性也提高(编号7),当氢气压力为3 MPa时,转化率和对映选择性可以达到非常好的效果(编号2).在此基础上,选择以异丙醇为溶剂,提高底物与催化剂摩尔比(S/C)为250,转化率和对映选择性均不变(编号10).当S/C为500时,反应的转化率降低至89%,ee值也有所降低(编号11);当S/C为1 000时,转化率只有72%,并且ee值也降低到80% (编号 12).本文报道了手性含N双膦配体(P-Phos)首次应用在不对称催化氢化合成度洛西汀的研究中,通过一系列的研究筛选出3-(二甲胺基)-1-(2-噻吩基)-1-丙酮合适的不对称氢化反应条件:手性配体为(S)-P-Phos,手性二胺为[(S)-daipen],金属源为[RuCl2(benzene)]2,无机碱为KOH,氢气压力为3 MPa,反应溶剂为异丙醇,室温反应24 h,得到了极高的反应转化率(>99%)和对映选择性(99%ee),此方法相比于传统的拆分法工艺更简单,并获得了87%的总收率.致谢:感谢江苏理文化工有限公司对本研究的资助.【相关文献】[1] DUGAN S E,FULLER M A.A dual reuptake inhibitor[J].Ann Pharm,2004,38(12):2078-2085.[2] KIRWIN J L,GOREN J L.Duloxetine:An antidepressant that inhibits both norepinephrine and serotonin uptake[J].For-mulary,2003,38(1):29-30.[3] NONOGAKI K.Serotonin and noradren aline reuptake inhibitors as antidiabetic [P].Japan,JP 2004292445.2004.[4]阴彩霞,刘志东,周雪琴,等.度洛西汀的不对称合成研究进展[J].化学通报,2007,70(9):684-690. YIN C X,LIU Z D,ZHOU X Q,et al.Progresses on the asymmetric synthesis of duloxetine[J].Chemistry,2007,70 (9):684-690.[5] BERGLUND R A.Asymmetric synthesis of key intermediate in the synthesis ofduloxetine via arylation of S-(-)-N,N-dimethyl-3-(2-thienyl)-3-hydroxypropanamine with 1-fluoronaphthan-lene in presence of potassium compound [P].US,5362886.1994-11-08.[6]王晓杰,潘志权.度洛西汀合成路线图解[J].中国医药工业杂志,2004,35(5):315-317. WANG X J,PAN Z Q.Graphical synthetic routes of duloxetine[J].Chin J Pharm,2004,35(5):315-317.[7] RAO D R,KANKAN R N,WAIN C P.A process for preparing duloxetine and intermediates for use terein[P].WO:056795,2004.(CA 2004,141:106360n)[8] ROBERTSON D W,WONG D T,KRUSHINSKI J J H.3-aryloxg-3-substituted propanamines[P].USP:5023269,1991. (CA 1991,109:170224n).[9]温新民,毛庆华,汤建,等.度洛西汀的合成进展[J].合成化学,2004,12(6):551-554. WEN X M,MAO Q H,TANG J,et al.Development in the synthesis of duloxetine [J].Chin J Syn Chem,2004,12(6):551-554.[10]WU J,CHAN A C S.P-Phos:A family of versatile and effective atropisomeric dipyridylphosphine ligands in asymmetric catalysis[J].Acc Chem Res,2006,39(10):711-720.[11]DEETER J,FRAZIER J,STATEN G,et al.Asymmetric synthesis and absolute stereochemistry of LY248686[J].Tetrah Lett,1990,31(49):7101-7104.[12]LIU H,HOFF B H,ANTHONSEN T.Chemo:Enzymatic synthesis of the antidepressant duloxetine and its enantiomer [J].Chirality,2000,12(1):26-29.。

新型手性磷化合物的合成及其作为配体催化剂在某些不对称合
成反应中的应用
周正洪;杨卓鸿;李康应;刘建兵;唐除痴
【期刊名称】《高等学校化学学报》
【年(卷),期】2001(022)0z1
【摘要】从L-氨基酸、D-樟脑、(-)-假麻黄碱、(-)-α-苯乙胺、(S)-(-)-联萘二酚等旋光源出发,合成了26个三配位及四配位手性磷化合物.作为配体催化剂,试验了它们在潜手性酮及亚胺的不对称硼烷还原反应、醛与二乙基锌的不对称烷基化反应以及醛的不对称硅腈化反应中的催化活性.发现其中有些催化剂有很好的立体选择性.
【总页数】6页(P71-76)
【作者】周正洪;杨卓鸿;李康应;刘建兵;唐除痴
【作者单位】南开大学元素有机化学研究所,;南开大学元素有机化学研究所,;南开大学元素有机化学研究所,;南开大学元素有机化学研究所,;南开大学元素有机化学研究所,
【正文语种】中文
【中图分类】O624
【相关文献】
1.手性膦配体催化剂在不对称合成中的应用研究 [J], 耿启金
2.新型手性羟基噁唑啉配体的合成及其在N-二苯基次磷酰亚胺的不对称乙基锌加
成反应中的应用 [J], 闫革新;吴勇;林文清;张晓梅
3.不对称合成中手性磷配体催化剂的研究进展(Ⅰ)(待续) [J], 李康应;周正洪;唐除痴
4.不对称合成中手性磷配体催化剂的研究进展(Ⅱ)(续完) [J], 李康应;周正洪;唐除痴
5.手性磷酰胺类配体不对称催化串联反应合成手性3-取代苯酞化合物 [J], 郭庆君因版权原因,仅展示原文概要,查看原文内容请购买。

《具有类TADDOL骨架手性单磷酸的合成及催化不对称Biginelli反应研究》一、引言在有机合成领域,手性化合物的合成与催化反应一直是研究的热点。
其中,Biginelli反应作为一种重要的多组分反应,在合成杂环化合物中具有广泛的应用。
近年来,具有类TADDOL骨架手性单磷酸的合成及其在不对称Biginelli反应中的催化作用逐渐受到研究者的关注。
本文旨在探讨该类化合物的合成方法及其在催化不对称Biginelli反应中的应用。
二、类TADDOL骨架手性单磷酸的合成1. 合成路线设计类TADDOL骨架手性单磷酸的合成过程涉及多个化学步骤,需要综合考虑反应条件、原料的可得性及产物的纯度等因素。
在现有研究的基础上,本文设计了从相应手性醇出发,经过酯化、缩合、水解等步骤,最终得到目标产物的合成路线。
2. 实验方法与结果在实验过程中,首先对手性醇进行酯化处理,得到相应的酯类化合物。
然后,通过缩合反应引入TADDOL骨架,形成中间体。
最后,经过水解反应,得到目标产物类TADDOL骨架手性单磷酸。
通过核磁共振、红外光谱等手段对产物进行表征,确认其结构。
三、催化不对称Biginelli反应研究1. 反应机理Biginelli反应是一种多组分反应,涉及醛、胺和羧酸或酰氯等组分。
在类TADDOL骨架手性单磷酸的催化下,这些组分发生缩合反应,生成具有杂环结构的化合物。
该过程涉及亲核加成、环化等步骤。
2. 实验方法与结果在实验中,将类TADDOL骨架手性单磷酸作为催化剂,加入醛、胺和羧酸等组分,在适当的温度和压力下进行反应。
通过调整催化剂的用量、反应时间及温度等参数,得到最佳的反应条件。
同时,通过核磁共振、高效液相色谱等技术对产物进行表征和分离。
结果表明,类TADDOL骨架手性单磷酸能够有效催化不对称Biginelli反应,提高产物的对映选择性。
四、讨论与展望1. 合成方法的优化尽管已经成功合成出类TADDOL骨架手性单磷酸,但仍需进一步优化合成方法,提高产物的纯度和收率。

手性二茂铁膦配体在不对称催化反应中的应用
支永刚;韩杰;董春娥;郑维忠;张良辅
【期刊名称】《合成化学》
【年(卷),期】2000(008)005
【摘要】综述了手性二茂铁膦配体的过渡金属配合物催化不对称氢化、硅氢化、交叉偶联、环加成、Aldol等反应的最新进展,参考文献56篇.
【总页数】11页(P384-394)
【作者】支永刚;韩杰;董春娥;郑维忠;张良辅
【作者单位】中国科学院成都有机化学研究所,成都,61O041;中国科学院成都有机化学研究所,成都,61O041;中国科学院成都有机化学研究所,成都,61O041;中国科学院成都有机化学研究所,成都,61O041;中国科学院成都有机化学研究所,成
都,61O041
【正文语种】中文
【中图分类】O643.36
【相关文献】
1.二茂铁衍生的手性硫膦配体在铱催化喹啉不对称氢化中的应用 [J], 赵玉军;汪游清;周永贵
2.钯-手性膦配体催化剂在烯烃不对称催化反应中的应用 [J], 董建霞;杨定乔;韩英锋;刘二畅
3.手性二茂铁类配体在钯催化不对称反应中的应用 [J], 刘振德;何煦昌
4.手性恶唑基二茂铁膦配体的合成及工艺优化 [J], 吴红英;化林;周铎;赵顺伟;陈辉;
刘婷婷
5.官能团化的手性联芳基单齿膦配体在不对称均相金催化反应中的应用 [J], 赵可;洪志;张立明
因版权原因,仅展示原文概要,查看原文内容请购买。

不对称催化反应中手性配体的设计与应用研究引言化学反应中的对称性是一个重要的概念,对于合成化学家来说,不对称催化反应是一种旨在获取手性化合物的重要工具。
在不对称催化反应中,手性配体起着至关重要的作用。
本文将探讨手性配体的设计与应用研究在不对称催化反应中的关键作用。
配体设计的原则在不对称催化反应中,手性配体是实现高选择性合成手性化合物的关键。
配体通过与催化剂形成配位键来影响催化剂的立体结构,从而实现对催化剂的立体和反应的立体选择性的控制。
因此,合理设计手性配体是实现高效不对称催化反应的前提。
手性配体的设计原则包括选择合适的手性中心,合理安排手性基团以及控制配体的构象。
首先,选择适当的手性中心对于设计手性配体非常重要。
手性中心的选择应考虑到反应底物和催化剂之间的相互作用,例如氢键、范德华力等。
此外,手性中心的位置和数量也应该得到充分的考虑,以提高手性诱导效应。
其次,合理安排手性基团有助于增强手性诱导效应。
手性配体通常包含特定的手性基团,例如氨基醇、磷酸盐等。
这些手性基团能够通过与底物、催化剂或溶剂的相互作用来传递手性信息,从而影响反应的立体选择性。
最后,控制配体的构象对于不对称催化反应的成功进行是至关重要的。
分子构象的改变可以改变配体的立体特异性,从而影响催化反应的立体选择性。
通过控制配体构象,可以改变配体与催化剂之间的相互作用方式,提高催化反应的效率和选择性。
手性配体的应用研究通过合理设计手性配体,可以实现对各种不对称催化反应的高选择性控制。
下面将介绍几种常见的不对称催化反应及其手性配体的应用。
1. 环加成反应环加成反应是一种有机合成中常用的重要反应。
通过合适的不对称催化剂和手性配体的设计,可以将环加成反应转化为不对称合成手性环化合物的有效工具。
例如,以质子或金属催化剂为基础的烯烃环加成反应常需要配体的辅助。
通过合理设计和调整配体结构,可以实现对手性环合物的高选择性合成。
2. 羟基化反应在合成中,羟基化反应是一类重要的转化。

基于新型亚磺酰胺类单膦手性配体的钯、铜催化不对称反应研究手性单膦配体在不对称催化中占有举足轻重的地位,其发展也随着反应的需求越来越成熟。
虽然众多高效的配体已合成,但真正能用于工业化生产的还少之又少,这是因为许多膦配体的合成还存在一些问题,如原料昂贵、合成繁琐、结构复杂、拆分困难等。
因此,开发效率更高、环境更友好的手性膦配体并将其应用于各类不对称反应中乃至工业化生产中,依然是一个具有挑战性的研究课题。
本论文主要围绕亚磺酰胺类手性单膦配体Ming-Phos的改造与新型手性单膦配体Xu-Phos的合成,并致力于其在不对称反应的应用研究,为新型配体的设计与合成提供了新的思路,并为不对称催化反应提供了新的配体库。
具体包括以下三方面内容:一、新型亚磺酰胺类手性单膦配体设计与合成研究我们发展了一种以二取代膦氢硼烷络合物和邻二溴苯为起始原料快速合成叔丁基亚磺酰胺类手性单膦配体的方法。
对于之前Ming-Phos配体改造中存在的膦取代基团、母体苯环等改造路线长、条件苛刻等难题,现通过该方法可高效解决,如:(1)可通过不同取代的膦氢硼烷络合物解决之前膦上取代基团;(2)可通过不同取代的芳基二溴化合物快速实现配体母体苯环的改造;(3)可通过使用具有脂肪醛衍生的叔丁基亚磺酰亚胺实现具有亚甲基的配体合成。
值得一提的是,我们首次将富电子的二环己基膦引入配体骨架中,完成了一系列叔丁亚磺酰胺类的二环己基单膦手性配体(Xu-Phos)及其相关配体的快速高效(“一锅法”)合成。
二、钯催化的不对称Heck串联反应研究基于配体合成的基础,我们成功地将Xu-Phos配体应用到钯催化的不对称Heck串联反应中,解决了钯催化的不对称Heck串联反应中的一些难题:(1)首次将该类配体成功地应用于钯催化邻碘芳基烯丙基醚的不对称还原Heck反应,完成了具有全碳季碳中心的手性2,3-二氢苯并呋喃类化合物的高区域选择性和立体选择性合成;(2)发展了首例高效、高对映选择性的邻碘芳基烯丙基醚的不对称碳碘化反应。
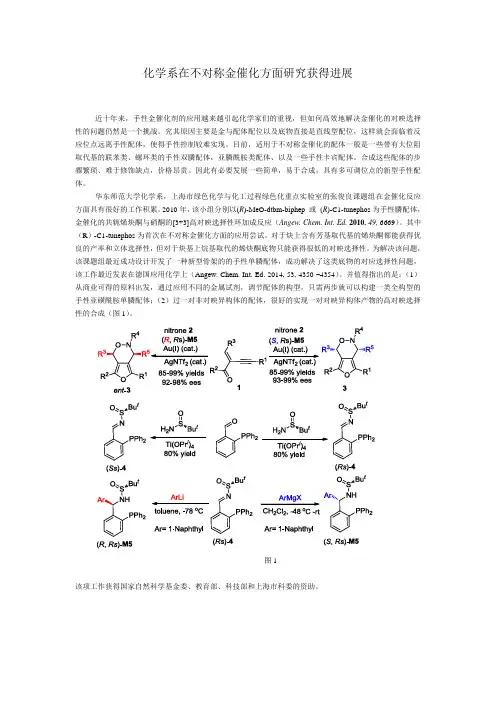
化学系在不对称金催化方面研究获得进展近十年来,手性金催化剂的应用越来越引起化学家们的重视,但如何高效地解决金催化的对映选择性的问题仍然是一个挑战。
究其原因主要是金与配体配位以及底物直接是直线型配位,这样就会面临着反应位点远离手性配体,使得手性控制较难实现。
目前,适用于不对称金催化的配体一般是一些带有大位阻取代基的联苯类、螺环类的手性双膦配体,亚膦酰胺类配体、以及一些手性卡宾配体。
合成这些配体的步骤繁琐、难于修饰缺点,价格昂贵。
因此有必要发展一些简单,易于合成,具有多可调位点的新型手性配体。
华东师范大学化学系,上海市绿色化学与化工过程绿色化重点实验室的张俊良课题组在金催化反应方面具有很好的工作积累。
2010年,该小组分别以(R)-MeO-dtbm-biphep 或(R)-C1-tunephos为手性膦配体,金催化的共轭烯炔酮与硝酮的[3+3]高对映选择性环加成反应(Angew. Chem. Int. Ed. 2010, 49, 6669)。
其中(R)-C1-tunephos为首次在不对称金催化方面的应用尝试。
对于炔上含有芳基取代基的烯炔酮都能获得优良的产率和立体选择性,但对于炔基上烷基取代的烯炔酮底物只能获得很低的对映选择性。
为解决该问题,该课题组最近成功设计开发了一种新型骨架的的手性单膦配体,成功解决了这类底物的对应选择性问题,该工作最近发表在德国应用化学上(Angew. Chem. Int. Ed. 2014, 53, 4350 –4354)。
并值得指出的是:(1)从商业可得的原料出发,通过应用不同的金属试剂,调节配体的构型,只需两步就可以构建一类全构型的手性亚磺酰胺单膦配体;(2)过一对非对映异构体的配体,很好的实现一对对映异构体产物的高对映选择性的合成(图1)。
图1该项工作获得国家自然科学基金委、教育部、科技部和上海市科委的资助。
