从1cm到3cm:黄金昶五位超低位直肠癌患者针刺保肛实录
- 格式:docx
- 大小:19.26 KB
- 文档页数:7

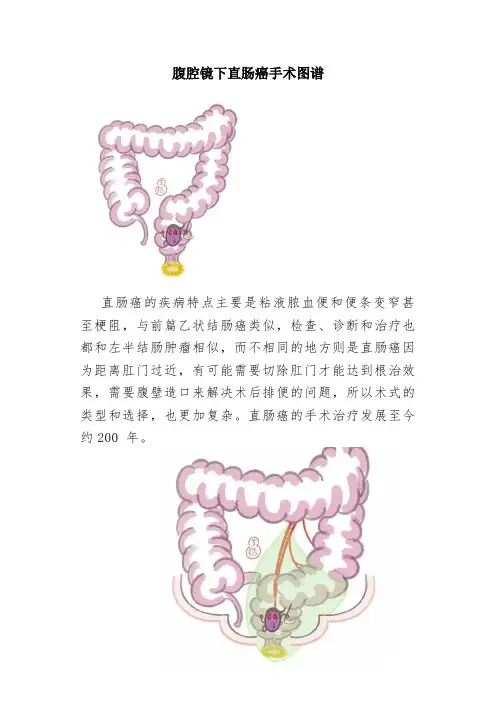
腹腔镜下直肠癌手术图谱直肠癌的疾病特点主要是粘液脓血便和便条变窄甚至梗阻,与前篇乙状结肠癌类似,检查、诊断和治疗也都和左半结肠肿瘤相似,而不相同的地方则是直肠癌因为距离肛门过近,有可能需要切除肛门才能达到根治效果,需要腹壁造口来解决术后排便的问题,所以术式的类型和选择,也更加复杂。
直肠癌的手术治疗发展至今约200 年。
1. 1879 年,奥地利 Carl Gussenbauer 医生首次实施了经腹腔入路切除近端直肠、将远端直肠缝闭后留置原位的手术。
此后,法国医生 Henri Hartmann 将该术式逐渐应用于乙状结肠癌和上段直肠癌手术中。
2. 1908 年,英国医生 Miles 提出了经腹会阴联合切除术(abdominoperineal resection,APR)。
他提出的手术五原则:(1)腹部结肠造瘘;(2)切除直肠,乙结肠及其供应血管;(3)切除直肠系膜;(4)清扫髂总动脉分叉上方的淋巴结;(5)清除提肛肌的扩大会阴部切除。
切除范围应该包括肿瘤本身(以及尽可能宽的会阴切口)、病变的肠管、系膜和肿瘤周围的淋巴结,而且应该实施整块切除。
3. 1948 年,美国的Mayo Clinic 的ClaudeF.Dixon 医生报道了经腹前切除术对中上段直肠癌的治疗结果,Dixon 术实现了中高位直肠癌的保肛要求。
以上三种术式分别以三位伟大的外科医生的名字Hartmann、Miles、Dixon 来命名。
1991 年,美国的 Jacobs 医生完成了首例腹腔镜结直肠手术,而目前直肠癌的腹腔镜手术已经成为了直肠癌手术的主流术式。
根据术前检查(结肠镜及病理,增强 CT 和 MR)判断为可切除的直肠癌,采取腹腔镜探查的手术方式,术前必须完善肛诊,确定能否保留肛门。
全麻成功后,截石位消毒铺单,头低右倾的体位。
首先,建立气腹和切口选择,与左半结肠切除类似。
A 观察孔,B、C 为主操作孔, D、E 为助手使用操作孔,如果保留肛门可选择 F 切口取出标本,体外操作。

经括约肌间切除术(ISR)的入路方式创新:从ISR国际专家共识谈起冯波;乃吉普·阿不都艾尼;蔡正昊【期刊名称】《临床外科杂志》【年(卷),期】2024(32)5【摘要】超低位直肠癌病人的保肛问题一直是结直肠外科学界关注的热点,也是当前迫切需要解决的难题之一。
1994年,经括约肌间切除术(intersphincteric resection,ISR)首次被报道用于超低位直肠癌的保肛手术[1],此后逐渐被视为针对超低位直肠癌病人手术提供保肛手段的重要措施,并在肿瘤根治和肛门功能保留方面得到了众多研究的支持[1-8]。
在ISR中,精确游离内外括约肌间隙(intersphincteric dissection,ISD)是一项极具挑战的关键环节。
手术难点是肿瘤位置过低以及手术视野的受限。
视野的局限性使得手术区域难以充分暴露,增加了误入错误解剖层面的风险。
目前,广泛采用的ISR入路包括经腹经肛联合入路、完全经腹入路及经肛外翻拖出式入路。
【总页数】4页(P453-456)【作者】冯波;乃吉普·阿不都艾尼;蔡正昊【作者单位】上海交通大学医学院附属瑞金医院普外科/上海市微创外科临床医学中心【正文语种】中文【中图分类】R73【相关文献】1.腹腔镜辅助括约肌间切除(ISR)超低位直肠癌保肛手术的可行性和安全性2.括约肌间入路挂线术与肛瘘切除术治疗经括约肌型肛瘘的对比研究3.极限保肛之低位直肠癌经括约肌间切除术(ISR)4.【评论】国际经括约肌间切除术标准化和优化小组(ISOG-ISR)关于解剖、定义、适应证、手术技术、标本描述和功能学结果的改良Delphi共识因版权原因,仅展示原文概要,查看原文内容请购买。



2024直肠癌伴肝转移盆腔放疗策略摘要肝脏是直肠癌最常见的转移部位,伴有可切除肝转移患者的生存较好。
盆腔放疗已成为直肠癌伴肝转移多学科管理的组成部分。
对千伴有不可切除肝转移患者,针对原发灶的姑息放疗能减少出血、梗阻等风险进而改善生活质量。
对千伴有可切除肝转移患者,盆腔放疗可有效降低局部复发率、使部分患者免千手术而提高生活质量、甚至提高患者总生存率。
目前,对千直肠癌伴肝转移患者盆腔放疗的标准化治疗模式没有达成共识,在如何筛选放疗获益人群、优化多学科协作以及放疗方案(长程放疗比短程放疗入器官保留等方面成为研究热点。
本文对近年来盆腔放疗在直肠癌伴肝转移中的研究进展作一综述,为直肠癌伴肝转移患者个体化盆腔放疗提供思路。
中国的直肠癌发病率高,约占结直肠癌总数的60%,肝脏是转移性结直肠癌(metastatic colorectal cancer, mCRC)最常见的转移部位[1]。
据报道,约20%的结直肠癌患者在初始诊断时已经发生肝转移[2]。
一般认为,在确诊时或确诊前发现的肝转移称为同时性肝转移,其预后较差。
同时性肝转移根据能否行外科切除,分为可切除性、潜在可切除性肝转移以及不可切除性肝转移。
随着多学科诊疗模式的发展,加强围手术期治疗成为结直肠癌肝转移(colorectal liver cancer metastasis, CRCLM)治疗的研究探寻方向。
直肠癌伴不可切除性肝转移的治疗策略以系统治疗为主,而对千直肠癌伴可切除或潜在可切除性肝转移的多学科协作治疗策略包括手术、化疗、放疗等。
据文献报道,手术后的mCRC患者的5年生存率可超过30%,在选择性的患者中可达到58%(3-4]。
其中盆腔或原发灶的放疗能够缓解症状、控制原发灶以及为后续手术或系统治疗提供帮助,在临床实践中常被采用。
近期的治疗指南和诊疗共识也推荐,将盆腔放疗作为直肠癌伴肝转移多模式治疗中的一部分。
本文就盆腔放疗在直肠癌伴肝转移治疗中的个体化应用和放疗策略选择进行讨论,并分享笔者对放疗模式的选择(包括姑息放疗以及围手术期放疗)以及器官保留策略的思考。


Miles术的手术笔记太和县中医院手术室崔辉一、病历介绍:病人姓名:李某某性别:男年龄:65岁系腹痛、大便带血半年余入院辅助检查:大便潜血实验阳性,电子结肠镜检显示直肠距离肛缘5厘米处见一环腔有约三分之二不规那么的溃疡物。
诊断:直肠恶性肿瘤拟施手术名称:经腹、会阴联合直肠癌根治术即Miles术二、应用解剖:直肠:直肠是大肠的结尾,肛缘起向上全长10—15厘米,周围多脂肪,位于膀胱和生殖器官的反面。
上端平第3骶椎处接乙状结肠,沿骶骨与尾骨前面下行,穿盆膈终于肛门,二者以盆膈为界。
直肠并非直,在矢状面上有两个弯曲,一是凸向后的弯曲称骶曲,距肛门7---8厘米;一是凸向前的弯曲称会阴曲,距肛门3---5厘米。
直肠与小骨盆腔脏器的毗邻关系男女不同,男性直肠的前面有膀胱、前列腺和精囊腺;女性那么有子宫和阴道。
因此临床指诊时经肛门可触查前列腺和精囊腺或子宫和阴道等。
三、手术适应症:Miles术的适应症:1. 肛管和肛门周围恶性肿瘤。
2. 直肠低位癌,肿瘤下缘距离齿线6厘米之内的(如肿瘤分化低,局部浸润深,可延长到8厘米之内)且无远距离转移者。
四、术前预备1.术前一日访视病人:客观介绍手术成效、并发症,让患者对疾病有正确的熟悉,主动配合各项医治方法;有条件时让病人与已同意Miles手术的康复患者交流,排除顾虑,减轻心理负担,同时给病人制造一个良好的环境,维持情绪稳固2.病人手术风险评估:手术切口为二类切口,手术类别为器官切除手术,手术时刻可能超过三小时3.术前依照手术核查表行三方核查4特殊物品预备:长电刀头、超声刀、温盐水、碘伏小纱布、凡士林纱布、石蜡油、凝胶体位垫、截石位腿架架、月牙凳等等。
5.待病人成立好麻醉后,协助医生摆放截石位:在摆放截石位时,支腿架外侧要垫上软垫或啫喱垫,腿架不宜太高,应与大腿在仰卧曲髋时的高度相等,腿架应拖在小腿肌肉饱满的部位,与小腿平行,双下肢分开约80°—90°,以幸免对腘窝的直接压迫,同时躲开了对腓骨的挤压,有利于幸免腓总神经及肌肉韧带的损伤。

Miles术与Dixon术在低位直肠癌患者围术期指标及疗效比较贾婷婷㊀张泽玉㊀㊀作者单位:617000四川省攀枝花市中心医院㊀㊀ʌ摘要ɔ㊀目的㊀对比分析采用经腹会阴联合直肠癌切除术(Miles术)与经腹前切除术(Dixon术)治疗低位直肠癌的围术期指标及疗效ꎮ方法㊀选择低位直肠癌患者60例ꎬ对其临床资料进行回顾性分析ꎮ按照手术方式分为Miles术组(29例)和Dixon术组(31例)ꎮMiles术组采用经腹会阴联合直肠癌切除术ꎬDixon术组采用经腹前切除术ꎬ2组均接受3年随访ꎮ对比2组手术时间㊁术中失血量㊁肛门排气时间㊁住院时间㊁淋巴结清除数量㊁环周切缘阳性率㊁术后1年生存质量评分(PAC ̄QOL)㊁排尿功能㊁男性患者性功能及并发症情况ꎬ并比较2组3年无瘤生存期㊁总生存期㊁局部复发率㊁远处转移率ꎮ结果㊀Dixon术组的手术时间㊁术中失血量㊁肛门排气时间㊁住院时间均少于Miles术组(P<0.05)ꎬPAC ̄QOL评分低于Miles术组(P<0.05)ꎬ排尿功能㊁男性患者勃起功能及射精功能优于Miles术组(P<0.05)ꎮ结论㊀Dixon术治疗低位直肠癌与Miles术相比ꎬ可明显缩短手术时间㊁肛门排气时间㊁住院时间ꎬ减少术中出血量ꎬ并可改善术后患者生活质量㊁排尿功能及男性患者的性功能ꎮ㊀㊀ʌ关键词ɔ㊀低位直肠癌ꎻMiles术ꎻDixon术㊀㊀DOI:10.3969/j.issn.1001 ̄5930.2020.02.041㊀㊀中图分类号:R735.3+7㊀㊀文献标识码:A㊀㊀文章编号:1001 ̄5930(2020)02 ̄0322 ̄04ComparisonofPerioperativeIndexesandEfficacybetweenMilesandDixoninPatientswithLowRectalCancerJIATingtingꎬZHANGZeyu.㊀PanzhihuaCentralHospitalꎬPanzhihua617000㊀㊀ʌAbstractɔ㊀Objective㊀Tocompareandanalyzetheperioperativeindexesandefficacyofabdominoperinealresection(Miles)andtransabdominalanteriorresection(Dixon)forlowrectalcancer.Methods㊀60casesofpatientswithlowrectalcancerwereselectedꎬandtheirclinicaldatawereretrospectivelyanalyzed.ThepatientsweredividedintoMilesgroup(29cases)andDixongroup(31cases)accordingtooperationmethods.MilesgroupwastreatedwithabdominoperinealresectionꎬandDixongroupwastreatedwithtransabdominalanteriorresectionꎬandthetwogroupswerefollowedfor3years.Theoperativetimeꎬintraoperativebloodlossꎬanalexhausttimeꎬhospitalstayꎬlymphnodeclearancequantityꎬpositiverateofcircumferentialresectionmarginꎬqualityoflifescore(PAC ̄QOL)1yearafteroperationꎬurinaryfunctionꎬsexualfunctionofmalepatientsandcomplicationswerecom ̄paredbetweenthe2groupsꎬandthe3 ̄yeardisease ̄freesurvivalꎬoverallsurvivalꎬlocalrecurrencerateanddistantmetastasisratewerecomparedbetweenthe2groups.Results㊀TheoperativetimeꎬintraoperativebloodlossꎬanalexhausttimeandhospitalstayinDixongroupwerelowerthanthoseofMilesgroup(P<0.05)ꎬandthePAC ̄QOLscorewaslowerthanthatofMilesgroup(P<0.05).TheurinaryfunctionanderectilefunctionandejaculationfunctionofmalepatientswerebetterthanthoseofMilesgroup(P<0.05).Conclusion㊀ComparedwithMilesꎬDixonforlowrectalcancercansignificantlyshortentheoperativetimeꎬanalex ̄hausttimeandhospitalstayꎬreducetheintraoperativebloodlossꎬandimprovethequalityoflifeꎬurinaryfunctionandsexualfunc ̄tionofmalepatientsafteroperation.㊀㊀ʌKeywordsɔ㊀LowrectalcancerꎻMilesꎻDixon(ThePracticalJournalofCancerꎬ2020ꎬ35:0322~0325)㊀㊀肿瘤位于肛门边缘以内7cm或在直肠下1/3部分为低位直肠癌ꎬ其发病率仅次于胃癌㊁食管癌ꎬ占全部直肠癌的70%以上ꎬ且病死率逐年升高[1 ̄3]ꎮ以往临床大多行经腹会阴联合直肠癌切除术(Miles术)治疗ꎬ适应证广且术后复发率低ꎬ但该手术需切除肛门ꎬ对患者的心理和生理产生严重影响ꎬ导致术后患者的生活质量严重下降ꎮ近年来ꎬ随着患者对术后生活质量要求不断提高及肠道吻合器械的不断改进ꎬ低位直肠癌保肛手术成为可能ꎮ经腹前切除术(Dixon术)无需切除肛门ꎬ不仅可达到根治的效果ꎬ还可最大程度降低术后排尿功能障碍及性功能障碍的发生率ꎬ明显提高患者术后的生存质量ꎮ大量研究表明ꎬDixon术治疗低位直肠癌可有效保留患者的生理功能[4]ꎮ本研究通过比较Miles术和Dixon术临床疗效ꎬ旨在为临床低位直肠癌术式选择提供参考依据ꎮ报告如下ꎮ1㊀资料与方法1.1㊀一般资料㊀㊀选取2014年5月至2015年5月本院低位直肠癌患者60例ꎬ诊断标准参照欧洲肿瘤学会«直肠癌指南»[5]ꎮ依据手术方式分为Miles术组(n=29例)和Dixon术组(n=31例)ꎮMiles术组:男性16例ꎬ女性13例ꎻ年龄33~75岁ꎬ平均(57.27ʃ5.62)岁ꎻ体重48~69kgꎬ平均(53.86ʃ3.42)kgꎻ其中腺癌26例ꎬ黏液细胞癌2例ꎬ腺瘤并癌变1例ꎻ分化程度:高分化10例ꎬ中分化15例ꎬ低分化4例ꎮDixon术组:男性17例ꎬ女性14例ꎻ年龄32~74岁ꎬ平均(57.02ʃ5.04)岁ꎻ体重48~68kgꎬ平均(53.23ʃ3.21)kgꎻ其中腺癌27例ꎬ黏液细胞癌3例ꎬ腺瘤并癌变1例ꎻ分化程度:高分化11例ꎬ中分化16例ꎬ低分化4例ꎮ2组患者的一般资料比较差异无统计学意义(P>0.05)ꎮ㊀㊀纳入标准:①临床通过电子肠镜和活检诊断为低位直肠癌者ꎻ②无远处转移者ꎻ③肿瘤下缘距离肛缘4~7cmꎻ④既往无盆腔感染㊁无其他恶性肿瘤ꎻ⑤既往无直肠㊁结肠相关手术史ꎻ⑥无意识障碍可正常沟通交流者ꎻ⑦伦理委员会批准ꎬ患者知情同意ꎮ㊀㊀排除标准:①严重脏器功能障碍ꎻ②入组前行放化疗治疗者ꎻ③入组前存在排尿困难或性功能障碍症状患者ꎻ④不愿配合治疗及随访者ꎻ⑤合并精神系统疾病ꎻ⑥合并手术禁忌证ꎮ1.2㊀方法㊀㊀2组患者术前一晚均进行灌肠ꎬ并停止经口进食或进水ꎬ术前30min颈静脉留置针予抗生素静脉点滴ꎮ2组均应用全直肠系膜切除技术行根治性开腹手术ꎮ㊀㊀Dixon术:解剖肠系膜下或直肠上血管ꎬ夹闭并离断ꎬ于肿瘤下缘2~5cm处通过线性切割吻合器将肠管切断ꎬ于肿瘤上缘10~15cm处将乙状结肠切断ꎬ游离腹膜反折部位下方直肠ꎬ腹膜外患者乙状结肠与直肠切端吻合部位ꎬ将标本移去ꎬ结肠近端放置吻合器钉座ꎬ缝合ꎬ肠段回纳ꎬ重建气腹ꎮ㊀㊀Miles术:直肠上血管以及游离乙状结肠处理方法与Dixon术一致ꎬ游离直肠后ꎬ在患者左下腹作4cm左右切口ꎬ将肠段取出ꎬ于肿瘤上缘10~15cm位置将包括乙状结肠以及其系膜㊁肛管㊁直肠㊁肛提肌和坐骨直肠窝内的组织以及肛门周围的皮肤和血管切除ꎬ清扫淋巴结ꎬ肛侧断端回纳腹腔ꎬ在患者腹部做永久性的结肠造口ꎬ将会阴部的伤口进行一期缝合ꎮ㊀㊀术后48h2组患者均给予抗生素抗感染治疗ꎬ持续用药24hꎮ术后1个月后对2组患者行化疗治疗ꎬ方案为FOLFOX4(氟尿嘧啶+四氢叶酸+奥沙利铂)ꎮ1.3㊀观察指标㊀㊀①统计对比治疗前后2组患者的手术时间㊁术中失血量㊁肛门排气时间㊁住院时间㊁淋巴结清除数量及环周切缘阳性率ꎻ淋巴结清除数采用盲法由病理科医生计数ꎻ根据NCCN标准[6]判定环周切缘阳性:肿瘤细胞浸润或周围细胞浸润距离切缘<1mm为环周切缘浸润阳性ꎬ反之则为阴性ꎮ②统计对比2组患者术前㊁术后1年生存质量㊁排尿功能㊁男性患者性功能及并发症情况ꎮ患者在术前及术后1年门诊随访时发放生存质量评分(PAC ̄QOL)表[7]ꎬ主要包括身体㊁心理及心情㊁恐惧及担忧事件㊁满足率4个方面ꎬ分数为1~5分ꎬ分值越高表示生活质量越低ꎻ排尿功能参照Saito等[8]的分级方法测定ꎻ性功能障碍包括勃起功能和射精功能ꎮ③比较2组患者术后局部复发率㊁远处转移率ꎬ并采用生存曲线分析其术后1㊁3年无瘤生存期㊁总生存期情况ꎮ术后第1年每3个月门诊或电话随访1次ꎬ第2㊁3年每6个月门诊或电话随访1次ꎬ术后每年复查至少一次ꎬ本次研究随访率为100%ꎮ1.4㊀统计学方法㊀㊀本研究中患者排尿功能㊁男性勃起功能及射精功能等级资料采用非参数Mann ̄WhitneyU检验ꎮ对于并发症发生率㊁局部复发率㊁远处转移率㊁环周切缘阳性率用率表示并采用χ2检验ꎮ对1㊁3年无瘤生存期和生存期采用Kaplan ̄meier法进行描述ꎬ并采用Log ̄rank检验对生存曲线进行比较ꎬP<0.05认为差异有统计学意义ꎮ2㊀结果2.1㊀2组患者围术期相关指标比较㊀㊀Dixon术组患者手术时间㊁肛门排气时间㊁住院时间短于Miles术组ꎬ术中出血量少于Miles术组(P<0.05)ꎬ淋巴结清除数量及环周切缘阳性率与Miles术组相比差异无统计学意义(P<0.05)ꎬ见表1ꎮ表1㊀2组患者围术期指标比较( xʃs)组别Dixon术组Miles术组t/χ2P手术时间/min152.38ʃ22.42186.75ʃ22.765.891<0.01术中出血量/ml82.58ʃ16.92148.64ʃ17.6514.801<0.01肛门排气时间/d2.29ʃ0.373.08ʃ0.635.969<0.01住院时间/d15.23ʃ2.4617.74ʃ2.573.865<0.01淋巴结清除数量/个9.04ʃ1.489.32ʃ1.620.7000.487环周切缘阳性率/%25.81(8/31)24.14(7/29)0.0220.8812.2㊀2组患者术前㊁术后1年生存质量㊁排尿功能㊁男性患者性功能比较㊀㊀Dixon术组患者术后1年PAC ̄QOL评分明显高于术前(P<0.05)ꎬ但明显低于Miles术组(P<0.05)ꎬ排尿功能㊁男性勃起功能及射精功能均优于Miles术组(P<0.05)ꎬ见表2ꎮ表2㊀2组患者术前㊁术后1年PAC ̄QOL评分㊁排尿功能㊁男性患者性功能比较组别PAC ̄QOL评分术前术后1年排尿功能/例Ⅰ级Ⅱ级Ⅲ级Ⅳ级勃起功能/例Ⅰ级Ⅱ级Ⅲ级射精功能/例Ⅰ级Ⅱ级Ⅲ级Dixon术组(n=31)9.85ʃ2.1653.75ʃ10.06ab216311051952Miles术组(n=29)10.04ʃ2.3269.34ʃ7.52a12872465447t/Z0.3295.8684.4625.0314.273P0.744<0.010.0350.0250.039㊀㊀注:a为与术前比较ꎬP<0.05ꎻb为与Miles术组比较ꎬP<0.05ꎮ2.3㊀2组患者术后并发症发生率㊁局部复发率和远处转移率比较㊀㊀Dixon术组患者出现并发症吻合口瘘2例ꎬ阴道穿孔1例ꎬ感染1例ꎬ发生率12.90%ꎬ局部复发率为6.45%ꎬ远处转移率为12.90%ꎮMiles术组出现并发症术后感染1例ꎬ肠梗阻1例ꎬ切口㊁吻合口出血1例ꎬ发生率10.34%ꎬ局部复发率为3.45%ꎬ远处转移率为17.24%ꎮ2组患者并发症发生率㊁局部复发率和远处转移率比较ꎬ差异均无统计学意义(P>0.05)ꎮ见表3ꎮ表3㊀2组患者术后并发症情况㊁局部复发率及远处转移率比较(例ꎬ%)组别例数并发症局部复发远处转移Dixon术组314(12.90)2(6.45)4(12.90)Miles术组293(10.34)1(3.45)5(17.24)χ20.0090.0040.221P0.9250.9530.6382.4㊀2组患者术后1㊁3年生存情况比较㊀㊀Dixon术组患者1㊁3年无瘤生存率分别为90.32%(28/31)㊁77.42%(24/31)ꎬMiles术组1㊁3年无瘤生存率分别为96.55%(28/29)㊁75.86%(22/29)ꎬ2组无瘤生存期的生存曲线分析显示ꎬ2组差异无统计学意义(P>0.05)ꎬ见图1ꎮDixon术组患者1㊁3年总生存率分别为96.77%(30/31)㊁87.10%(27/31)ꎬMiles术组1㊁3年总生存率分别为96.55%(28/29)㊁82.76%(24/29)ꎬ2组总生存期生存曲线分析显示ꎬ2组差异无统计学意义(P>0.05)ꎬ见图2ꎮ图1㊀患者无瘤生存时间分析图2㊀患者总生存时间分析3㊀讨论㊀㊀低位直肠癌患者治愈率和保肛率较低ꎬ患者术后生活质量受到严重影响ꎮ因此ꎬ保留完整的肛门功能对患者尤为重要ꎮMiles术为非保肛手术ꎬ在患者左下腹行永久性乙状结肠单腔造口ꎬ术后患者排尿与生殖功能均有可能受到影响ꎮDixon术具有保留患者原有肛门的优势ꎬ最大限度地降低了盆腔自主神经功能受损程度ꎬ患者术后即使出现一定程度的排尿与性功能障碍ꎬ大多在1年内可恢复正常[9 ̄11]ꎮ本研究中ꎬDix ̄on术组患者术后排尿和男性患者性功能均优于Miles术组ꎬ生存质量较高ꎬ这主要是由于Dixon术保留了肛门和会阴ꎬ降低了腹下神经㊁盆内脏神经受损程度ꎬ降低患者功能损伤情况ꎮ㊀㊀本研究结果显示ꎬ治疗后Dixon术组患者的手术时间㊁肛门排气时间㊁住院时间以及术中失血量均明显减少ꎬ该研究结果提示采用Dixon术创伤小ꎬ术后恢复快ꎮ原则上ꎬDixon术应尽可能将病灶彻底切除ꎬ与此同时ꎬ应彻底清扫患者癌灶的侧方淋巴结ꎬ手术中由于切除范围小ꎬ患者所受创伤较小ꎬ因此术后患者恢复较快ꎬDixon术具有创伤小㊁术中失血少㊁术后恢复快的优点[12 ̄13]ꎮ㊀㊀本研究显示2组患者并发症发生率无差异ꎬ这说明Dixon术治疗低位直肠癌是安全可行的ꎮ研究表明ꎬDixon术治疗低位直肠癌ꎬ术后并发症较少ꎬ安全性良好[14 ̄16]ꎮ本研究还显示ꎬDixon术组的淋巴结清除数量㊁环周切缘阳性率㊁局部复发率㊁远处转移率㊁3年无瘤生存率及总生存率与Miles术组比较无明显差异ꎬ这说明Dixon术与Miles术相比ꎬ淋巴结清除效果及预后效果相当ꎮ李坚等[12]的研究结果也证实了上述观点ꎬ低位直肠癌患者Dixon术后复发率㊁转移率及生存率与Miles术相比无差异ꎮ行Dixon术的关键在于掌握保肛手术相关适应证㊁完整切除直肠系膜及距肿瘤的远端切缘ꎬ进而保留肛门而不影响患者预后ꎮ㊀㊀综上所述ꎬ采用Dixon术治疗低位直肠癌具有微创㊁保留排尿功能及男性患者性功能的特点ꎬ可显著提高患者术后生存质量ꎮ参考文献[1]㊀王道荣ꎬ徐明皓ꎬ汤㊀东ꎬ等.改良式回肠末端自闭式造口术在腹腔镜低位直肠癌保肛术中的应用价值 J .中华消化外科杂志ꎬ2018ꎬ16(2):188 ̄193. [2]㊀FerociFꎬVannucchiAꎬBianchiPPꎬetal.Totalesorectalex ̄cisionformidandlowrectalcancer:laparoscopicvsroboticsurgery J .WorldJournalofGastroenterologyꎬ2016ꎬ22(13):3602 ̄3610.[3]㊀孙㊀戈ꎬ龚海峰ꎬ楼㊀征ꎬ等.极低位直肠癌拖出式适形切除术中使用25号管状吻合器研究 J .中国实用外科杂志ꎬ2018ꎬ38(4):449 ̄453.[4]㊀NanQ.Effectsofthreekindsofoperationintreatmentoflowrectalcancer J .MedicalJournalofNationalDefen ̄dingForcesinSouthwestChinaꎬ2017ꎬ23(12):879 ̄882. [5]㊀陈㊀功ꎬ王㊀屹.2017版欧洲肿瘤学会直肠癌指南解读 J .中华胃肠外科杂志ꎬ2017ꎬ20(11):223 ̄225. [6]㊀姚宏伟ꎬ刘荫华.基于循证医学证据的腹腔镜直肠癌手术疗效评价 J .中华外科杂志ꎬ2017ꎬ55(1):28 ̄31. [7]㊀张宇澄ꎬ盛宇伟ꎬ乔㊀治ꎬ等.结直肠癌患者术前GPS与术后并发症及预后的相关性 J .实用医学杂志ꎬ2018ꎬ34(10):1644 ̄1648.[8]㊀刘㊀流ꎬ朱志强ꎬ何义仁ꎬ等.束带提拉法在腹腔镜辅助中低位直肠癌前切除术中的应用 J .中国普通外科杂志ꎬ2017ꎬ26(10):1279 ̄1285.[9]㊀师文聪ꎬ王㊀楠ꎬ尹智渊ꎬ等.预防性造口对腹腔镜直肠癌低位前切除术后短期生活质量的影响 J .中国普通外科杂志ꎬ2018ꎬ27(4):420 ̄426.[10]㊀LiuDꎬHuangJ.ApplicationofsphincterpreservingDixonsurgerycombinedwithprophylacticileostomyinlowrectalcancer J .ChinJOperatProcedGeneralSurgꎬ2018ꎬ16(5):764 ̄765.[11]㊀高鹏飞.腹腔镜直肠癌根治术与传统开腹术的疗效比较 J .现代肿瘤医学ꎬ2017ꎬ25(14):2265 ̄2269. [12]㊀李㊀坚ꎬ彭㊀吒ꎬ何剪太.低位和超低位直肠癌保肛手术的现状及进展 J .中国内镜杂志ꎬ2018ꎬ24(04):77 ̄84. [13]㊀CaoCꎬLiuZMꎬShiGF.Clinicalapplicationofpull ̄throughproctectomyinlaparoscopicDixonsurgeryoflowrectalcancer J .JLaparoscSurgꎬ2015ꎬ23(11):579 ̄580.[14]㊀曾子威ꎬ康㊀亮.直肠癌吻合口常见并发症的研究现状 J .中华消化外科杂志ꎬ2018ꎬ14(2):204 ̄207. [15]㊀JiangGFꎬChenSWꎬJiangM.ClinicalapplicationvalueoftheLaparoscopicassistedDixonsurgeryongeriatricpa ̄tientswithlowrectalcancer J .JClinExperMedꎬ2017ꎬ26(7):856 ̄858.[16]㊀张永康ꎬ廖晓锋ꎬ晏㊀玮ꎬ等.3D腹腔镜下直肠癌根治术20例临床体会 J .中国微创外科杂志ꎬ2018ꎬ18(1):84 ̄85ꎬ94.(收稿日期2019-01-23㊀修回日期2019-07-25)(编辑:甘㊀艳)。


低位直肠癌新辅助治疗新进展摘要:中国的大肠癌以直肠癌占大多数,同时低位直肠癌多见,临床上,中下段直肠癌的治疗难点包括肛门保留、膀胱和性功能的损害及局部复发率高。
而Miles手术一直以来都是中、低位直肠癌的主要治疗手段,肛门改道手术十分常见。
由于肛门的位置与功能,器官功能的保全与生存质量的改善对于患者来说同样重要。
对于低位直肠癌患者而言,手术、放疗、化疗等手段的综合治疗运用显得尤其重要。
近年来临床逐渐以新辅助治疗作为低位直肠癌治疗的热门话题,本文主要介绍低位直肠癌新辅助治疗进展及相关研究热点。
关键词:低位直肠癌;新辅助治疗;进展随着生活水平的提高和生活方式的日益西方化,导致结直肠癌的发病率逐年上升,而我国结直肠癌流行病学特点直肠癌比结肠癌比例高,约为1.5:1;低位直肠癌所占比例高,腹膜返折以下直肠癌约占60%;临床分期偏晚,50%的直肠癌患者在初诊时即为中晚期。
直肠为大肠的终端,下界由齿状线与肛管分界,上端相当于第三骶椎水平与乙状结肠相连,长度约为12-15cm。
通常直肠分为3段:齿状线上5cm为直肠下段,5-10cm为中段,10-15cm为上段,肿瘤位于不同区段可进行不同手术术式[1]。
临床低位直肠癌的传统根治性手术治疗,尽管运用多种治疗手段,对直肠癌患者的生存率有所提升,但是对于患者而言,在生活质量方面的要求也越来越高,终生人工造瘘口带来的后遗症,严重影响了患者的生活质量,所以低位直肠癌在临床中的治疗不仅需要追求治愈,更关键是要在疾病控制治愈同时,可以将治疗过程中所产生的毒性、并发症尽量减少,确保患者的正常器官功能[2]。
近年来有研究证实可以采用术前放射治疗,对进展期直肠癌患者可以降低复发率[3],在近年来手术治疗技术及药物的飞速发展下,临床医生的实际治疗方案确定,也会与患者病症情况为依据做出决策,选择个体化新辅助治疗方法,达到预期的治疗效果,实现治疗损伤平衡[4]。
接下来将对近年来临床低位直肠癌新辅助治疗的相关研究,现综述如下:1 新辅助治疗优点1.1 肿瘤术前T降期肿瘤在降期及缩小均作为新辅助治疗方法获得显著疗效的基础,研究表示,术前放化疗后直肠癌肿呈T分期下降,从形态学上部分肿瘤已经完全消失,明显减少淋巴结转移数目,对直肠癌患者行新辅助放化疗治疗,能够明显提升直肠癌的切除率及RO切除率[5]。
从1cm到3cm:五位超低位直肠癌患者针刺保肛实录近年来,北京中医药大学第三临床医学院黄金昶团队,将围刺促血管正常化基础研究应用在超低位直肠癌保肛控便国际难题,在超低位直肠癌附近的八髎、腰阳关、长强、会阴等穴针刺配合新辅助化疗,临床取得令人欣喜的疗效,出色完成超低位直肠癌保肛手术前二传手角色,开拓针灸治疗肿瘤新领域。
结直肠癌是常见的恶性肿瘤之一。
据我国最新的癌症统计报告显示,2015年恶性肿瘤发病率和死亡率前十位中,结直肠癌分别位列第3和第5。
发病率仅次于肺癌和胃癌。
大肠癌约60-70%在直肠,直肠癌半数在低位。
国际著名杂志CA:A Cancer Journal for Clinicians发布了2020年美国结直肠癌统计报告,结直肠癌患者群体正向年轻化转变,在50岁以下的人群中,直肠肿瘤最常见(37%)。
目前直肠癌综合治疗的主要方法是外科手术治疗,虽然地位尤其超低位直肠癌手术延长了患者生存时间,但患者术后多有永久性结肠造口,也是患者需面临的新问题,造口会明显影响患者生活质量,因此目前越来越多的直肠癌患者不但要求保肛手术,而且期望控便自如等,力求疗效与功能并存,对于低位和超低位直肠癌,保肛控便是一项国际难题。
为创造低位直肠癌保肛条件,近年来NCCN指南对T4N0M0或T1-4N1-2M0直肠癌推荐单纯化疗或放化疗同步,但放疗会造成肛门功能与排尿功能以及性功能障碍,对低位直肠癌尤其超低位直肠癌有强烈保肛要求患者更容易接受单纯化疗。
提高化疗有效率增加保肛率尤显重要。
现代医学用抗血管生成药物配合化疗来提高大肠癌有效率,多用于转移性大肠癌尤其晚期大肠癌。
目前尚未有最佳证据表明术前使用靶向药物的有效性,不建议在临床试验外术前使用靶向抗血管生成药物。
黄金昶团队曾证实瘤体周围针刺可以增加肿瘤局部药物浓度,继而研究发现瘤体周围围刺可以明显促血管正常化,其作用不劣于贝伐珠单抗,最新研究明确针刺是通过改善肿瘤免疫微环境促血管正常化,达到血管靶向药物与免疫治疗同时并举。
针刺联合化疗不仅促血管正常化提高肿瘤局部药物浓度增强化疗疗效,还可以改善肿瘤免疫微环境,攻瘤驱邪与免疫扶正双赢。
通过针刺在低位直肠癌治疗上成功实现保肛控便,进一步证实了该团队这一研究观点的临床价值。
下面的文字是五位不同分期、不同阶段超低位直肠癌患者治疗经过的实录,供大家参考。
实录一:峰回路转,针刺圆了2cm保肛梦朱先生,典型云南人执拗,38岁,超低位直肠癌患者,肿瘤距肛缘2-4cm, 约占肛周面积的3/4,坚硬、固定,肿瘤侵犯肠浆液层与右侧提肛肌的界限尚不清楚,肠周还有肿大淋巴结,2016-10-20 (直肠)活检病理:高级别上皮内瘤变,cT4N2M0,Ⅲc期。
患者非常执着强烈要求保肛,肿瘤距肛缘2cm还浸透浆膜层与肛提肌界限不清,肠周淋巴结肿大,别说保肛,就是肿物也难以切除干净。
可患者目标就是一个“保肛”,绝不带粪兜子。
两个周期两个周期评估,先行6个周期联合化疗,瘤子缩小不明显,再次和患者商量,文质彬彬的朱先生还是两个字“保肛”,以超低位直肠癌手术擅长的外科主任2016年10月份请求我们中医技术支持,我们在化疗同时配合火针围刺,6个周期后瘤体消失,2017年6月21日ISR手术切除达到pCR,患者早在2017年11月造口还纳,过着正常人生活。
按目前普遍观点,低位T4的直肠癌患者不适合保肛,本来化疗疗效不理想,加用针刺却极大助力化疗,如同高超的二传手,使疗效达到pCR,外科医生顺顺利利切除。
不可否认针刺起了关键作用。
实录二:同舟共济,针刺攻克1cm保肛堡垒这是一位更具挑战性安徽朱性女患者,54岁,挑战的不是瘤子大小,而是距离,距肛缘仅1cm可见一约2.5cm的隆起肿物,环周约3/5,表质硬。
肠周有多个淋巴结,cT3N2M0,活检病理为直肠腺癌,ⅢB期,这个患者和朱先生一样,为了保肛辗转了北京多家医院,所有大夫统一答案,“先保命吧!这么低位直肠癌还保肛?!,保肛没有任何意义”。
可患者坚定要保肛,认为保肛比保命重要,绝不要人造肛门。
这个患者第一次化疗就结合了火针针刺。
6个周期,仅仅6个周期,肿瘤就临床完全缓解,于2017年8月13日ISR手术,pCR。
这个患者难就难在肿物距肛缘1cm,要保证手术切缘R0切除,必须让肿物缩到距肛缘2-3cm处,单纯化疗很难保证临床完全缓解,所以外科医生一致口径是让其保命,做人工造口,可患者的坚持和与针灸巧妙配合,争取到保肛。
实录三:合作共赢,山河仍在,快乐生活有的患者当肿物消失后不愿手术,采取等待观察,这在低位直肠癌有保肛/保功能需求者国际学术界比较支持的一种策略。
下面介绍的这个患者是我的一个老乡,65岁男性,因大便性状改变、间断便血就诊,CEA 6.55ng/nl,2016-11-09肠镜示:距肛门口3cm可见隆起性病变,占1/2周,表面黏膜粗糙,伴接触性出血。
盆腔MRI增强示直肠下段距肛门3.1cm处肠壁不规则增厚,长度约3cm,浆膜面光滑,直肠系膜清晰,未见淋巴结显示,T2N0M0可能大。
穿刺病理提示直肠腺癌。
考虑到患者远期的生活质量及强烈的保肛意愿,建议行新辅助化疗后再考虑择期手术。
XX医院采用FOLFOX6方案化疗6周期(2016年10月- 2017年1月),氟尿嘧啶联合亚叶酸钙方案4周期(2017年2月-5月),后因口腔粘膜炎疼痛、四肢末端皮肤变黑,改为奥沙利铂动脉灌注联合氟尿嘧啶微量泵持续泵入2周期(2017年6月- 8月)。
经多学科专家会诊,从第2周期化疗开始,于每周期化疗第1、3、5天(2016年11月-2017年8月)给予八髎、腰阳关、长强火针针刺,共配合化疗11周期。
2017年8月患者复查血清CEA 6.16ng/nl,肛门指检未扪及明显肿物,指套无血迹。
肠镜结果示:距肛门口3cm以下直肠前壁见不规则瘢痕,表面尚光滑,未见溃疡及肿物。
盆腔MRI示距肛门3cm见直肠前壁不规则瘢痕,表面尚光滑未见肿物及溃疡,肠腔无狭窄,病变长约0.7cm,yT1-2N0M0。
经评估达到临床完全缓解,后继续口服卡陪他滨观察治疗2周期(2017年9月-10月)。
患者在临床完全缓解后决定不做手术切除,结合国际NCCN 最新指南,采取了观察与等待,患者定期复查、长期随访,并坚持口服中药,2019年9月复查血清CEA 5.08ng/nl,肠镜示距肛门口3cm可见片状黏膜发白,边界尚清晰,可见部分血管略迂曲,未见明显异常。
盆腔MRI示直肠病变显示不清,较前片变化不大。
临床病灶消失后距2020年7月8日35个月。
以临床完全缓解有保肛/保功能需求者,学术界支持采取等待与观察为目的TNT策略,TNT策略是以放化疗为主方案,骨髓抑制明显、且会引起肛门功能与排尿功能以及性功能障碍。
本病例选用化疗联合针刺方法,副反应轻微,疗效显著。
当然了,从卫生经济学而言,费用明显减少了。
实录四:你有冲刺保肛梦想,针刺全力守护一位深圳直肠癌侵及精囊男性患者,61岁,2016年9月发现肿物距肛缘2-6cm直肠中分化腺癌,侵及直肠周围脂肪组织,与前列腺、尿道明显粘连,T4NxM0,不存在任何保肛可能,可这个患者特别倔,要保肛。
在XX医院先术前FOLFOX方案6个周期,瘤体明显缩小,但保肛困难,予5-FU、亚叶酸钙化疗4周期,瘤体没变化,又予腹腔动脉、肠系膜下动脉、双侧髂动脉奥沙利铂灌注化疗2周期;口服希罗达化疗2周期,FOLFOX方案2周期,2018年1月10日肠镜提示原位复发,病情进展,FOLFIRI化疗配合贝伐珠单抗2周期,病情还是进展。
已经化疗18次,患者心理身体承受着巨大痛苦,患者和医生都陷入深深的无奈之中,瘤体与前列腺紧密相连无法手术,患者强烈要求保肛,要求根治性切除,我建议他来我科室化疗,同时给科里主管医生下了死命令,我们化疗必须让瘤体缩小,必须能做手术。
我们2018年4月3日除常规化疗XELOX方案外,还给患者火针针刺腰阳关、八髎,针刺长强、会阴以及毫韧针松解耻骨联合与腹股沟疼痛点,熟料一个周期化疗后5月8日患者来诊时说胃肠外科专家肛门指诊发现瘤体变小变软与前列腺分开了,可以手术了。
后手术R0切除。
2020年1月初患者高兴的和我说,外科医生准备给他做还纳手术了,表情轻松自信。
我问他为何要保肛,患者说在体外挂个油箱(粪袋)总归不方便,出门坐飞机、聚会让人尴尬。
深圳患者辗转广州、上海、北京等地,咨询保肛手术,一次次咨询,一次次失落,终于有外科医生接手试试新辅助化疗看能否保肛。
前6次化疗瘤体缩小,可后面的化疗、靶向、动脉化疗却一次次敲打着脆弱的心,前后18次化疗,瘤体进展。
在别的医院化疗时虽然也做了针刺,但总是受时间、次数等限制。
我询问得知他在三附院能报销时,邀请来我科室化疗,主管医生很细心很努力,1次针刺配合化疗,也就一次,瘤体明显缩小,肿物与精囊分开了。
针刺为超低位直肠癌保肛,注入了强大力量,圆了患者强烈保肛梦想。
实录五:针刺独狼,深入虎穴再立保肛战功周某,女,38岁,北京人。
2018年1月2日在XX医院肠镜检查时发现直肠隆起性病变,病变近肛门口,呈盘状,大小约1.5cm,病理直肠中分化腺癌,1月16日XX肿瘤医院核磁直肠下段右前壁可见溃疡型病变,肠壁局限性不规则增厚,最厚处约9mm,DWI 呈高信号,增强扫描见不规则强化,病变穿透肌层,局部外膜面尚完整,病变超过肛提肌与直肠交界水平。
直肠周围系膜内见多发淋巴结,较大者约8x7mm:意见直肠下段占位,考虑恶性可能性大。
在XX医院XELOX方案化疗4周期,5月4日在XX肿瘤医院复查核磁,与1月16日对比,直肠下段右前壁增厚较前减轻,原最厚处9mm,现约4mm,以短T2信号为主,稍高强化,病变穿透肌层,病变下缘达肛提肌与直肠交界水平。
直肠周围系膜内多发淋巴结较前缩小,原较大者约8x7mm,现约5mm,意见直肠癌治疗后,较前好转,部分纤维化。
直肠周围多发淋巴结较前缩小。
外科医生无法手术,告知患者回家休养。
定期复查。
患者非常忧虑,6月2日来诊,八髎火针、抖腹直肌、毫韧针松左下腹结节+中药,7月3日核磁复查,与5月4日比较:直肠下段肠壁增厚不明显,局部以短T2信号为主,未见明显强化。
直肠周围系膜内小淋巴结同前,较大约5x4mm。
意见直肠癌治疗后,局部纤维化,未见确切残留病灶。
直肠肠周多发小淋巴结同前。
这是针刺让瘤体消失病例。
该患者CR后至2020-7-8日已经23个月。
有些肿瘤即使缩小因为瘤体位置太低也不能保肛手术,瘤体存在不能观察与等待,此时可以应用火针围刺让瘤体继续缩小直至消失,达到cCR,让不能保肛患者保肛,无忧的观察与等待。
传统针灸作为国粹,因其显著止痛作用传播到全球183个国家和地区;针灸治疗肿瘤作用已经引起美国等欧美国家高度重视,针刺在超低位直肠癌保肛过程发挥着极为重要作用,它不仅是重要二传手,必要时也可作为主攻手攻城拔寨。