高速逆流色谱分离技术
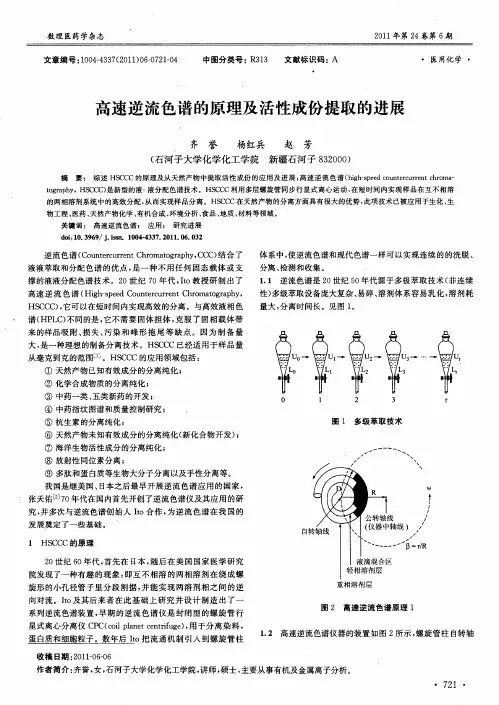
- 格式:doc
- 大小:32.50 KB
- 文档页数:8


高速逆流色谱原理(HSCCC:High Speed Counter-Current Chromatography)液相色谱系统构成高速逆流色谱系统构成TBE300A+ÄKTA Prime逆流色谱原理萃取:利用物质在两种互不相溶(或微溶)的溶剂中溶解度或分配系数的不同,使物质从一种溶剂内转移到另外一种溶剂中。
逆流色谱原理液-液分配色谱:利用样品中各组分在两相溶剂间分配比的差异,进行分离。
它是不用固态载体的全液态的液-液分配色谱技术.优点:不存在样品的不可逆吸附,理论回收率为100%极大地避免了样品的变性问题操作简单,无需太多样品前处理等。
HSES 流体静力平衡体系在充满下(上)相的螺旋管内慢慢注入上(下)相,最终会形成整个管柱里上下两相交替分段分布的状态。
无论哪一相作为流动相,都能建立起流体静力平衡状态。
如果流动相与管壁亲和性强,它会均衡沿管壁流过形成连续流,如果亲和性较弱,会形成小滴穿过固定相。
液滴逆流色谱(DCCC)旋转腔室逆流色谱(RLCCC)离心分配逆流色谱仪(CPC)利用离心力产生的恒定立场讲固定相保留在又管道连接的一系列腔体中。
优点:噪声小、平衡性好,多数溶剂系统都可在该仪器使用,流动相流速为数毫升每分钟。
由于死体积存在,两相溶剂难以充分混合,与同体积的流体动力学的逆流色谱仪相比分离效率差。
这类一起都是采用旋转密封接头,不可避免产生溶剂渗漏问题。
HDES流体动力平衡体系螺旋管力能保留住任一相充当的固定相,并能形成在数量上超过螺旋单元数的分配单元。
在螺旋管的各个部位,由大量小滴构成了两相间广阔的界面,这些小滴在支撑相里剧烈而稳定的震荡,减小了质点传递阻力,避免了使样品区带展宽的层流的产生。
螺旋管里不存在完全由流动相占据的无效空间,无论以哪一相做流动相,在整个螺旋管的有效空间里总是有一相会形成剧烈而稳定震动小滴,靠这样的运动和分布能开发出有效的逆流色谱仪。
两相不相溶的溶剂在一根绕自身轴旋转的螺旋管内,其中一相的小液滴会向首端迁移,另一相向尾端迁移。







高速逆流色谱法一次性分离制备藏药蓝玉簪龙胆中的三个化合物李姗;赵野;刘圆;张志锋【摘要】目的:通过高速逆流色谱法(HSCCC)从藏药材蓝玉簪龙胆中分离制备得到三个高纯度化合物.方法:选择乙酸乙酯-正丁醇-水(4∶0.5∶5,v/v/v)为二相溶剂系统,上下两相分别作为固定相、流动相,主机转速设置为900 r/min,流动相溶剂流速为2 mL/min,紫外检测波长为254nm,柱温为20℃.所采集的组分减压浓缩后烘干得到龙胆苦苷、异荭草素、异牡荆苷,应用ESI-MS/MS分析鉴定,并用HPLC测定其质量分数.结果:在260 min内可一步纯化150 mg藏药材蓝玉簪龙胆水粗提物中的龙胆苦苷、异荭草素、异牡荆苷,三者完全分离,纯度分别达到98.2%、94.5%、96.0%.结论:利用高速逆流色谱法可快速、简单、高效地富集蓝玉簪龙胆中龙胆苦苷、异荭草素、异牡荆苷三种化合物.【期刊名称】《西南民族大学学报(自然科学版)》【年(卷),期】2016(042)006【总页数】5页(P660-664)【关键词】高速逆流色谱;蓝玉簪龙胆;龙胆苦苷;异荭草素;异牡荆苷【作者】李姗;赵野;刘圆;张志锋【作者单位】西南民族大学药学院,四川成都610041;西南民族大学药学院,四川成都610041;西南民族大学青藏高原研究院,四川成都610041;西南民族大学青藏高原研究院,四川成都610041【正文语种】中文【中图分类】R284藏药蓝玉簪龙胆为龙胆科龙胆属植物蓝玉簪龙胆(Gentianaveitchiorum Hemsl.)的干燥地上部分,藏语学名为“邦见温保”[1-2].性寒、味苦;归肝、胆经;具清热解毒功效;现代药理研究表明蓝玉簪龙胆可减轻肝肺部的炎症,保护肝肺功能,抑制肝肺纤维化的形成[3-4].龙胆中主要化学成分是裂环烯醚萜苷及黄酮类化合物,杨红澎等使用传统分离方法从蓝玉簪龙胆花中分离鉴定了2α-羟基熊果酸、落干酸、远志脑苷(polygalacerebroside)、熊果酸、龙胆苦苷、异荭草素-3′-甲醚、异牡荆苷和异荭草素等化合物[5-6].高速逆流色谱(HSCCC)[7]是一种连续高效的快速液-液分配色谱分离技术,具有回收率高,连续高效,制备量大等特点,可直接用于分离制备粗提物[8-9].该法中化合物的分离只依赖于溶解性的不同,由此避免了因不可逆性吸附造成的样品损失及由于表面化学等诸因素引起的化学分析物变性,因而广泛应用于天然产物中活性物质的分离制备[10-11].本实验采用高效逆流色谱建立分离制备蓝玉簪龙胆中的三种化合物的方法,该操作简单,分离时间短,产物纯度高,对蓝玉簪龙胆化合物的分离及其药理药效的进一步研究具有重要意义.1.1 仪器与试剂高速逆流色谱仪(TBE-300B,TBE-20A,上海同田生化技术有限公司);Waterse2695高效液相色谱仪,含Waters 2489紫外/可见光分光光度检测器,Empower色谱工作站、自动进样器、四元梯度泵、柱温箱. UHPLC–PDA–QTOF–MS为Waters Acquity UHPLC I-Class系统(Waters,USA).质谱为双重四级杆飞行时间质谱和电喷雾电离质谱(ESI)(Waters MS Technologies,UK).藏药蓝玉簪龙胆采于四川省红原县,由四川大学张浩教授鉴定为龙胆科龙胆属植物蓝玉簪龙胆(Gentianaveitchiorum Hemsl.)全草;HSCCC分离所用的乙酸乙酯、正丁醇均为分析醇;HPLC分析中所用甲醇为色谱醇,水为超纯水;D101大孔树脂(西安蓝晓科技有限公司).1.2 方法1.2.1 蓝玉簪龙胆粗提物的制备将干燥的蓝玉簪龙胆2 kg粉碎,用75%乙醇浸泡3次,每次3 d,料液比为1∶20;过滤,滤渣纯水回流提取两次;滤液过D101大孔树脂,依次用水,10%,30%,50%,70%,100%六个梯度乙醇-水洗脱,分段收集洗脱液;减压浓缩.将浓缩得到的浸膏冷冻干燥至粉末,得到乙醇粗提浸膏及水粗提浸膏,干燥器中保存备用.准确称取150 mg水粗提物溶解于10 mL下相,4℃下保存备用.1.2.2 HPLC及UHPLC-PDA-QTOF-MS色谱分析条件采用HPLC法对HSCCC分离的各组分进行检测,并按照面积归一化法判断各组分的纯度.色谱柱: YMC-Triart C18柱(250 mm×4.6 mm,5 μm),甲醇(A)-水(B)为流动相梯度洗脱(0~50 min,20%~50%A);进样量为10 μL;流速:1 mL·min-1;检测波长:240 nm;柱温:35℃.采用UHPLC–PDA–QTOF–MS为结构鉴定,根据二级质谱碎片推测化合物结构.色谱柱:Acquity HSS C18柱(100 mm×2.1 mm,1.8 μm),0.1%乙酸水(A)和甲醇(B)为流动相,0~15 min,20~50%B梯度洗脱;进样量为1 μL;流速:0.2 mL· min-1;检测波长240 nm;柱温:35℃.质谱量子范围,m/z100~1 500;干燥气体的流量(N2)、800 L/h;干燥气体温度450℃;氮气,30 L/h;离子源温度100℃;毛细管电压2 500 V和筒内压力40 V.1.2.3 溶剂体系选择根据待分离物质的物理性质及溶剂极性,确定选用乙酸乙酯-正丁醇-水为两相溶剂体系,配置两相溶剂不同体积比(7∶0∶5,4∶0.5∶5,4∶1∶5,7∶1∶5)的溶剂体系.上相为固定相,下相为流动相,充分混匀后平衡6-10h,超声脱气20min,紫外检测波长为254nm.根据文献[12]计算分配系数K=Aupper/Alower,K值结果见表1.1.2.4 高速逆流色谱分离制备经过优化筛选出乙酸乙酯-正丁醇-水溶剂体系,将其充分混匀后再静置分层,上下两层分别为固定相、流动相.固定相溶剂以20 mL/min的流速泵入HSCCC螺旋管柱中,等到固定相溶剂流出约20 mL后停泵.主机设置为正转,转速调至900r/min,再以2 mL/min的流速泵入流动相溶剂,待流动相溶剂流出且达到两相动态平衡时,将100 mL水粗提物样品注入HSCCC仪中,打开色谱工作站采集数据:检测波长为254 nm,柱温为20℃.监测色谱图并收集各组分,浓缩后烘干.2.1 蓝玉簪龙胆水相粗提物的HPLC分析由图1可知,HPLC外标法分析蓝玉簪龙胆水相粗提物,测得提取物中三个化合物的含量分别为33.2%,36.5%,24.0%.2.2 HSCCC分离制备结果由表1可知乙酸乙酯-正丁醇-水(4∶0.5∶1)为最优溶剂体系,经微调后直接进行制备,分离谱图见图1,在该条件下,可分离出三个化合物,且重现性良好.2.2 纯度分析及结构鉴定组分I,II,III,IV减压浓缩后烘干分别得到23.2 mg,11.6 mg,5.1 mg,6.8 mg粉末,精确称取各组分3 mg,甲醇溶解后制成1 mg/mL样品,以1.2.2节中的色谱条件对收集的各组分进行检测,采用HPLC外标法测定,得到组分I为杂质,组分II纯度98.2%,组分III纯度94.5%,组分IV纯度96.0%.对三个组分采用ESI-MS/MS分析鉴定化合物(见图3-II),组分II分子离子峰为[M-H+COOH]-m/z 401.1084,分子式鉴定为C16H20O9,基于CID-MS2显示碎片峰为m/z 391.0801,376.0054,225.0128,179.0558,149.0548,112.9838质谱图数据与文献(13)中报道的龙胆苦苷质谱数据一致,分析鉴定结构为龙胆苦苷(如图3-II).组分III分子离子峰为[M-H]+m/z 447.0925,分子式为C21H20O11,基于CID-MS2显示碎片峰为m/ z285.0393,可能为[M-H-162]-,即脱去一个糖;碎片峰m/z 429.0815可能为苯环上两个羟基的缩合;碎片峰m/z 327.0503是失去一分子水和一分子P-hydroxyPhenyl-prop-enyl后得到,质谱图数据与文献(14-15)中报道的异荭草素质谱数据一致,即鉴定结构为异荭草素(如图3-III).组分IV分子离子峰为[M-H]-m/z 431.0976基于CID-MS2显示碎片峰为m/z 311.0548,295.0601,283.0601,269.0441,161.0244,117.0335,与文献(16)中报道的异牡荆苷质谱数据一致,即鉴定结构为异牡荆苷(如图3-IV).本实验采用高效逆流色谱实现了蓝玉簪龙胆中三种主要成分龙胆苦苷,异荭草素,异牡荆苷三种不同化合物的完全分离.通过多次验证获得最佳HSCCC分离体系为乙酸乙酯-正丁醇-水(4:0.5:5,v/v/ v),并成功通过一步纯化从150 mg蓝玉簪龙胆水相粗提物中获得龙胆苦苷,异荭草素,异牡荆苷三种不同化合物,纯度分别达到98.2%,94.5%,96.0%,分离时间260 min.龙胆苦苷是中国药典规定的龙胆类植物中的标志性成分,具有广谱的药理活性,黄酮类化合物也以成为国内外天然产物研究热点,本文中分离得到的两个黄酮类化合物在蓝玉簪龙胆水提物中含量很高,因此对蓝玉簪龙胆中的黄酮类物质研究具有较大的实用价值.本文方法可以一步纯化得到高纯度的龙胆苦苷和黄酮类化合物,更省时、简便,可为蓝玉簪龙胆的化合物纯化分离及其药理作用的进一步研究提供物质基础.【相关文献】[1]杨永昌.藏药志[M].西宁:青海人民出版社,1991.[2]帝玛尔·丹增彭措.晶珠本草[M].毛继祖,译.上海:上海科学技术出版社,1986.[3]侯颖,曹蔚,李涛,等.蓝玉簪颗粒治疗小鼠慢性支气管炎作用机理的研究[J].第四军医大学学报,2008,14:1331-1333.[4]ZHANG ZF,LIU Y,LU LY,et al.Hepatoprotective activity of Gentiana veitchiorum Hemsl.against carbon tetrachloride-induced hepatotoxicity in mice[J].Chinese Journal of Natural Medicines 2014,12(7):0488-0494.[5]杨红澎,确生,吴锡冬,等.蓝玉簪龙胆中苷类成分的研究[J].中国中药杂志,2008,33(21):2505-2507.[6]邹琼宇,梁健,廖循,等.蓝玉簪龙胆的化学成分研究[J].华西药学杂志,2010,5:512-514.[7]ITO Y,BOWMAN R L.Countercurrent chromatography:Liquid-liquid partition chromatography without solid support[J].Science,1970,167 (3916):281-283.[8]邸多隆,郑媛媛,陈小芬,等.高速逆流色谱技术分离纯化天然产物中黄酮类化合物的研究进展[J].分析化学,2011,39(02):269–275.[9]成超,尹鹭,曹学丽,等.儿茶素和表儿茶素异构体的高速逆流色谱分离制备[J].食品化学,2012,33(15):140–143.[10]ITOY,CONWAY W D.High speed countercurrent chromatography [M].New York:John Wiley,1996.[11]曹学丽.高速逆流色谱分离技术及应用[M].北京:化学工业出版社,2005.[12]MAN DAVA N B,ITOY.Counter current chromato graphy,theory andpractice[M].New york:Marcel Dekker,1998:443.[13]DANIIL N,OLENNIKOV,NINA I,et al.Iridoids and Flavonoids of Four Siberian Gentians:ChemicalProfile and Gastric Stimulatory Effect [J].Molecules,2015,20:19172-19188.[14]WANG EJ,MA YB,ZHANG XM,et al.Five alkaloids from vine stems of Diploclisia affinis[J].China Journal of Chinese Materia Medica,2008,33:2505-2507.[15]N SASAKI,Y NISHIZAKI,E YAMADA,et al.Identification of the glucosyltransferase that mediates direct flavone C-glucosylation in Gentiana triflora[J].FEBS Letters,2015,589:182-187.[16]HUANG MQ,ZHANG YP,XU SY,et al.Identification and quantification of phenolic compounds in Vitexnegundo L.var.cannabifolia(Siebold et Zucc)ingliquid chromatography combined with quadrupole time-of-flight andtriple quadrupole mass spectrometers[J].Journal of Pharmaceutical and Biomedical Analysis,2015,108:11-20.。

高速逆流色谱操作步骤和要点操作步骤:1 配液。
超声脱气约20 min,脱气后静置冷却至室温后泵液。
2 打开恒温水浴,将温度升至设定温度。
3 泵固定相。
以10~20 mL/min流速泵入固定相,检测器出口端流出固定相约20~50 mL后停泵。
4 平衡。
打开紫外检测器开始预热,正转转动主机至900 rpm(FWD为正转,REV为反转),同时以3 mL/min流速泵入流动相,至出口端流出流动相且此时紫外信号稳定,体系基本己平衡。
5 进样。
以体系的上、下相溶解一定量的样品,超声溶解均匀后,在装样注射器中倒入样品溶液,将进样六通问切换至load,推排气泡后吸液至样品全进入进样圈中,将load切换至inject,检测器、工作站调零开始记录。
6 接收流分。
工作站记录,设备运行时间为如5 min,保存后采集数据,保存。
7清洗。
断开泵与主机的连接,将主机进口与气管出口连接,吹气;将主机中溶剂吹出后,泵入约50 mL清洗液,吹气,重复此过程2~3次;最后一次长时间(1小时左右直至吹干)吹气时将主机内液体吹尽。
8 关机。
操作要点:本仪器适用于有机溶剂,316L不锈钢及PTFE材料可耐受的酸碱溶液。
1 本设备可承受的压力限制为2 MPa,请勿泵入不可溶解的固体颗粒。
2 设备运行前先检查连接管路是否正确,是否紧密;检测器波长是否正确。
3 配液时溶剂应混合均匀,自然分层澄清后可超声脱气,脱气时间不宜过长,脱气后如溶剂有温热则最好冷却静置至室温后使用。
4 样品溶解可为体系上相或下相,或同时两相溶解;不可以单一的溶剂来溶解进样,以免破坏主机内的体系平衡。
5 每次做完实验请及时清洗设备,一般清洗液为甲醇、乙醇等,如体系内含有酸、碱、盐等溶剂,建议先以纯净水清洗l~2次后,再以清洗液清洗。
6 日常清洗完设备后;如需继续进行实验,请设备放置2小时后重新平衡。
7 操作中如有气泡、流失或其他异常现象,可致电上海同田生物技术有限公司技术支持部************-8036。
溶菌酶研究现状2010级基地班马冬珂10104109关键词:溶菌酶基本性质活性检测酶学性质提取,分离,纯化纯度检测一:溶菌酶的基本性质:1907年,Nicolle最早发表了枯草杆菌溶菌因子的报告,两年后,Laschtschenko指出,鸡蛋也有较强溶菌活性,并把它命名为溶菌酶(Lysozyme,EC3.2.1.17)。
紧接着Fleming和Meyer等证实植物中也含有溶菌酶,以后人们对溶菌酶的特性有了更深入的认识。
【1】作用机制:溶菌酶是一种广泛存在于各种动植物有机物中的糖苷水解酶,作用于N一乙酰氨基葡萄糖和N一乙酰胞壁之间的β—1,4糖苷键,能使某些细菌细胞壁中的粘多糖成分分解,破坏肽聚糖支架,在内部渗透压的作用下,细胞胀裂,细菌裂解,而人和动物细胞无细胞壁结构,也无肽聚糖,故溶菌酶对人体细胞无毒性作用,但具有溶解细胞壁的能力。
【2】溶菌酶分子量的测定:溶菌酶原料相对分子质量测定采用SDSPAGE凝胶电泳法测定,分离胶浓度为12%,采用考马斯亮蓝染色。
溶菌酶是由129个氨基酸残基组成的碱性球蛋白,等电点在pH值10.8左右,分子量为14000,化学性质非常稳定。
当pH值在1.2—11.3的范围剧烈变化时,其结构几乎不变。
在酸性环境下,溶菌酶对热的稳定性很强;pH值低于4时,溶菌酶可以长期在室温下存放。
其纯品为白色或微黄、黄色的结晶体或无定型粉末,无异味,,微甜,易溶于水,遇碱易被破坏,不溶于乙醚. 280nm的消光系数为13.0。
酶活性可被该酶活性可被一些金属离子Cu2+,Fe2+,Zn2+(10-5~10-3M)以及N-乙酰葡萄糖胺所抑制,能被Mg2+,Ca2+(10-5~10-3M)、NaCl所激活。
应用:在国外,溶菌酶普遍的应用在食品的杀菌,保险,防腐以及微生物发酵和生物工程技术中菌体内容物的提取,如核酸,蛋白质,抗生素,酶等的提取,在医药和临床上,溶菌酶制成的各种药物具有抗菌抗病毒,消炎消肿,增强抗生素疗效等作用,检测血清尿中的酶的活性,临床上可用于诊断白血病。
高速逆流色谱法在中药有效成分分离中的应用研究【摘要】高速逆流色谱是近几年发展起来的新型色谱技术,由于其独特之处已被广泛应用于各个领域,本文就人们关心的热点中药有效成分的分离,采用新的色谱技术高速逆流色谱技术分离取得的成就进行总结,并展望未来的前景。
【关键词】高速逆流色谱法;中药有效成分;分离;应用中图分类号r283 文献标识码 b 文章编号1674-6805(2012)35-0156-01近年来,随着中国经济的高速发展,中草药已经越来越受到人们的关注。
而中药的有效成分复杂,如何获得高效的有效成分,分离效果成为研究的热点。
高速逆流色谱法(high-speed countercurrent chromatography,hsccc)具有分析能量大、分离效率高、结果重现性好等其他色谱无法替代的优点。
现高速逆流色谱技术这种新型的液-液分配色谱已广泛应用于医药、农林、化工等各领域[1]。
应用新型的高速逆流色谱分离成分复杂的中药有效成分可取得良好的效果,具体总结如下。
1 工作原理高速逆流色谱hsccc是应用不同物质在固液两相中的分配系数不同进行分离。
一台高速逆流色谱仪是由输液泵、分离柱、检测器、工作站、数据采集系统及馏分收集器等组成。
首先选择固定相,是将两相预先平衡好的溶剂中的一相填充满螺旋管柱,将流动相以一定的流速泵入高速旋转的螺旋管柱内。
在有液体流动相流出时,说明体系达到平衡,此时将样品注入高速逆流色谱体系中,螺旋管分离柱将依据不同成分在固液两相中的分配系数不同达到分离,依据工作站和数据采集系统将分离后的结果进行记录并积分处理。
在仪器运行的时候,可调节溶剂、固定相、流动相、样品浓度、柱温、洗脱方式、进样方式、流动相的流速及转速等使分离效果达到最好。
还需要根据所检测样品的特点,选择不同的检测器,uv-vis(紫外-可见光检测器)、elsd(蒸发光散射检测器)或者质谱检测器等[2]。
2 中药的有效成分各种植物中所含的有效成分分类为生物碱、黄酮、苷、萜、蒽醌、木脂素、香豆素、有机酸等。
四 川 大 学 硕士研究生课程考试试卷
姓名 唐昌云 学号 07 学院 华西药学院 专业 生药学
任课教师 王 曙 教 授 课程名称 高 等 生 药 学 课程成绩 考试时间 2012.12.31.
四川大学 高速逆流色谱分离技术的运用 1 发展历史 高速逆流色谱(HSCCC)是在1982年,美国国立卫生院的一个教授首先研究和发展起来的一种不同于传统液相色谱法的现代色谱分离制备技术。作为一种新的色谱技术,HSCCC分离系统可以理解为以螺旋管式离心分离仪代替HPLC的柱色谱系统。HSCCC不使用固相载体作固定相, 克服了固相载体带来的样品吸附、损失、污染和峰形拖尾等缺点。由于不需要固定相,HSCCC技术具有进样量大、无不可逆吸附等优于其他色谱技术的优点,此项技术已经被广泛地应用于医药、环境、化工等领域。 2 原理 2.1 色谱分离原理 高速逆流色谱分离原理结合了液液萃取和分配色谱的优点,是一种不需任何固态载体或支撑的液-液分配色谱技术,其基本分离原理与其他同类色谱技术相同,主要是利用物质在两相间分配系数的差别进行分配。而HSCCC将两溶剂的分配体系置于高速旋转的螺旋管内,螺旋管的运动形式,是在自身自转的基础上,同时绕一公转轴旋转,形成行星运动。由此加在分配体系上的离心力场不断发生变化,使两相溶剂充分的混合和分配,从而达到洗脱分离目的。因为样品中各组分在两相中分配系数不同,导致组分在螺旋柱中的移动速度不同,因而能使样品组分按分配系数的大小次序被依次洗脱下来的一种色谱分离技术。在流动相中分配比例大的先被洗脱, 在固定相中分配比例大的后被洗脱。 2.2 固定相的保留 在高速逆流色谱仪设计方面,其有两个轴,其中一个为公转轴,一个为自转轴,两个轴由一个电动机带动。仪器的公转轴呈水平方向,圆柱形的螺旋管支持件围绕此轴进行行星式运转,同时围绕自转轴进行自转。由于螺旋管柱的行星式运动产生了一个在强度和方向上变化的离心力场,使在螺旋柱中互不相溶的两相不断混合从而达到稳定的流体动力学平衡,两相分离成两层,重相占据螺旋管的每一段的外部,轻相占据每一段的内部,并且两相沿螺旋管形成一个清晰的线性界面。所以可以根据所用体系液体的流动趋势选用合适的模式,使得其中一相作为固定相保留在螺旋管中,另一相作为流动相并带着样品(溶质) 进入螺旋柱并不断反复穿过固定相。这一过程频率极高,当柱心以800r /min旋转时,频率超过每秒13次。流动相从固定相流动的相反方向泵入,以阻止固定相的运动,使固定相保留在色谱柱内,高速逆流色谱法就是利用了这种现象来实现高速分离的。 3 溶剂系统 3.1 溶剂体系的要求及分类 HSCCC是利用溶质在不同溶剂中的分配的分配系数不同进行分离的,所以在溶剂选择时要重点考虑溶质在两溶剂中的分配系数,那么其分离物质的关键是溶剂系统的选择。对于分离的溶剂体系, 应该满足以下几方面的要求:1)不造成样品的分解与变性,且不与之发生反应;2)对样品有足够高的溶解度;3)样品在溶剂体系中有合适的分配系数值(K应在0.5-2之间);4)溶剂体系的各组分应分成体积比例适合的两相, 以免浪费溶剂;5)固定相能实现足够高的保留,且要满足一定的要求(保留值越大峰形越好)。因而准确测定待分离组分在两相中的分配系数,便可选择出合适的溶剂系统。 常见的溶剂体系按极性分类有以下几种:1) 强极性溶剂体系;2) 中等极性溶剂体系;3) 弱极性溶剂体系;4) 极弱极性体系(无水体系);5)加酸体系等。这五种溶剂体系分别可以用于分离相应性质的天然产物。 3.1.1 强极性体系 正丁醇体系:该体系的基本两相由正丁醇和水组成,可根据需要在上下两相中加入不同体积比且极性位于正丁醇和水之间的惰性溶剂来调节溶剂系统的极性。一般加入甲醇、乙醇、丙酮作为调节剂,组成三元溶剂体系。该体系一般不是很常用。 醋酸乙酯体系:该体系是HSCCC分离常用的体系之一,基本两相由醋酸乙酯和水组成,可根据需要在上下两相中加入不同体积比且极性位于醋酸乙酯和水之间的惰性溶剂来调节溶剂系统的极性。一般加入甲醇、乙醇、正丁醇作为极性调节剂,组成三元或四元溶剂体系。用该类溶剂系统分离的物质基本上都属于苷类, 且大多数苷的苷元都比较简单,多数含有多个羟基,有的苷含有多个糖,常用于分离黄酮苷、苯丙素苷以及一些皂苷。最常用的溶剂体系有:醋酸乙酯-正丁醇-水、醋酸乙酯-甲醇-水、醋酸乙酯-乙醇-水、醋酸乙酯-正丁醇-乙醇-水。这些常用的体系极性相差不大,只有醋酸乙酯-乙醇-水的极性稍微小点,不常用于分离含有多个糖的苷。 3.1.2 中极性体系 甲基叔丁基醚体系:该体系的基本两相由甲基叔丁基醚和水组成,可根据需要在上下两相中加入不同体积比且极性位于甲基叔丁基醚和水之间的惰性溶剂来调节溶剂系统的极性。一般加入正丁醇、甲醇、乙醇、乙腈作为极性调节剂,组成四元溶剂体系,三元的甲基叔丁基醚体系不是很常见。可以用于分离含羟基不是很多的苷类和极性较大的萜苷,以及含有多个羟基和羧基的非苷类物质。甲基叔丁基醚体系和醋酸乙酯体系的极性相差很小。 氯仿体系:该体系是HSCCC分离常用的体系,基本两相由氯仿和水组成,可根据需要在上下两相中加入不同体积比且极性位于氯仿和水之间的惰性溶剂来调节溶剂系统的极性。一般加入正丁醇、甲醇、乙醇作为极性调节剂,组成三元或四元溶剂体系。其中运用最多的是氯仿-甲醇-水体系,氯仿体系可用于分离含有糖的苷, 也可分离不含有糖且含有一些羟基的苷元。但是甲醇在溶剂体系中的比例很接近或者大于氯仿在溶剂体系中的比例时,氯仿-甲醇-水体系可以分离含有多羟基的苷类物质,其极性甚至可以达到与醋酸乙酯体系极性似的程度。常用于分离黄酮、苯丙素、蒽醌、多酚及其苷。 3.1.3 弱极性体系 正己烷体系: 该体系是HSCCC分离常用的体系之一,基本两相由正己烷和水组成,可根据需要在上下两相中加入不同体积比且极性位于正己烷和水之间的惰性溶剂来调节溶剂系统的极性。一般加入正丁醇、甲醇、乙醇、醋酸乙酯、乙腈、氯仿作为极性调节剂,组成三元或四元溶剂体系。其中运用最多的是正己烷-醋酸乙酯-甲醇-水、正己烷-醋酸乙酯-乙醇-水、正己烷-甲醇-水、正己烷-乙醇-水、正己烷-醋酸乙酯-水。一般用正己烷体系分离小极性非苷类物质,被分离物质中极性基团很少。常用于分离黄酮、苯丙素、蒽醌和一些萜类化合物。其中正己烷-甲醇-水、正己烷-乙醇-水分离物质的极性很小,基本不含羟基。而正己烷-醋酸乙酯-水分离的物质极性最大,可以分离含有多个羟基的物质,甚至能分离苷类。而正己烷-醋酸乙酯-甲醇-水、正己烷-醋酸乙酯-乙醇-水,这两个溶剂体系的分离极性范围很广。 石油醚体系: 该体系的基本两相由石油醚和水组成,可根据需要在上下两相中加入不同体积比且极性位于石油醚和水之间的惰性溶剂来调节溶剂系统的极性。一般加入甲醇、乙醇、醋酸乙酯作为极性调节剂,组成三元或四元溶剂体系。其中运用最多的是石油醚-醋酸乙酯-甲醇-水。用该体系分离的大多数物质都不含有羟基,很少用该体系分离苷类物质,只有当苷元分子较复杂且极性很低时可以用于分离由该苷元组成的苷。降低石油醚的比例,也可以分离一小部分的苷。 3.1.4 极弱极性体系(无水体系) 现在大多数用于HSCCC分离的无水体系都是用乙腈代替水与小极性溶剂组成基本两相,再根据需要在上下两相中加入不同体积比且极性位于小极性溶剂和乙腈之间的惰性溶剂来调节溶剂系统的极性。该溶剂系统可以用来分离极性非常小的物质,这种物质一般含有较多碳,基本上不含有极性基团,适用于分离小极性的甾体、萜类以及多碳烷烃。常见的无水体系有正己烷体系,其基本两相由正己烷和乙腈组成。 3.1.5 加酸体系 在极性相对小的溶剂体系中加入酸碱会增大溶剂体系的极性。常在溶剂体系中加入盐酸、醋酸、三氟乙酸、磷酸盐。这种加了酸碱的溶剂体系常用于分离具有酸碱性质的物质,如生物碱、有机酸和酸性较强的黄酮类化合物。氯仿-甲醇-稀盐酸溶剂体系就常常用于分离生物碱类的物质,可以说氯仿-甲醇-稀酸体系是分离生物碱的专用体系。 3. 2 溶剂体系选择及组分分配系数的测定 选取一个合适的溶剂体系步骤:(1) 通过TLC或者HPLC预测被分离物质的极性。(2) 根据极性选择合适的分离体系。(3) 如果得知与被分离物质极性相似物质的分离体系,可以借鉴。在选择溶剂系统时就需要测定组分的分配系数, 而分配系数测定常采用高效液相色谱法或薄层色谱法,这两种方法都能够较准确地测出特定组分的分配系数值。HPLC法是将适量的样品分别溶于已平衡的两相溶剂,待分配平衡后,进行HPLC的测定,通过得到的色谱峰面积可精确计算出样品在两相间的分配系数。薄层色谱法则是利用样品在等体积上下相中分配平衡后用薄层色谱展开, 通过薄层色谱得到的斑点判断组分的分配情况。不同的体系,有着不同的平衡时间(不同溶剂系统中,从两相溶剂系统的上相与下相溶剂混合时,直到两相系统达到完全分层的时间),其影响着系统的分离效能,与固定相的保留率密切相关。 如果要同时分离多种物质,首先要预测被分离物质的极性,根据极性的大小来选择分离体系。如果被分离物质的极性都比较大, 可以选用醋酸乙酯体系;如果被分离物质一部分极性大,一部分极性中等可以选用氯仿体系;如果被分离物质一部分极性中等,一部分极性较小可以选用正己烷体系;如果被分离物质极性都较小可以选用石油醚体系。 4 实验操作及影响因素 4.1 实验操作 在进行分离纯化时,首先将固定相充满于色谱柱,而后色谱柱即围绕自身轴进行自转;同时围绕设备中心轴进行高速公转(即行星式运动),再将流动相泵入色谱柱。在此之前,首先选择预先平衡好的两相溶剂中的一相为固定相,并将其充满螺旋管柱,然后使螺旋管柱在一定的转速下高速旋转,同时以一定的流速将流动相泵入柱内。在体系达到流体动力学平衡后(即开始有流动相流出时),将待分离的样品注入体系。进样时,将样品组分溶于一定体积的的流动相之中,其组分将依据其在两相中分配系数的不同实现分离。同时,在注入固定相和流动相前,需配制溶剂系统,充分振荡后静置过夜;分离上下层溶剂,超声排气30min。而测试结束后用氮气将固定相推出, 可测得保留率,有时由于固定相的流失导致流出液乳化,一般要求固定相的保留值大于50%。 4.2 影响因素 由于高速逆流色谱是无需任何固态载体支撑的液-液色谱,其中作为固定相的液体在色谱柱中的保留程度对于高速逆流色谱的分离过程是十分重要。首先,所选择的溶剂体系对固定相保留率有很大的影响,如两相密度差、粘度、界面张力等。两相的密度差对固定相保留率的影响最大,固定相保留率和密度差基本呈线性关系。其次,还存在一些人为可以操控的条件会对固定相保留率产生影响,如高速逆流色谱的转速、流速、以及柱温等。其中,螺旋管柱的转速以及它产生的离心力场对两相的混合程度具有决定性的影响。因此,对于界面张力较高的溶剂系统,应使用较高的转速,以使两相之间能够剧烈的混合,从而促进分配和减少