公开课:铁、铜及其化合物的性质
- 格式:ppt
- 大小:2.15 MB
- 文档页数:22

第12讲 铁铜及其化合物一 铁的位置和物理性质1.铁及其化合物间的主线Fe―→⎩⎪⎨⎪⎧FeO Fe 2O 3Fe 3O 4―→⎩⎨⎧Fe OH2Fe OH 3―→⎩⎨⎧FeSO 4·7H 2OFeCl 32.铁及其化合物间的转化关系3.铁元素的变价 (1)单质铁①生成+2价:铁与S 、H +、Cu 2+、I 2等反应生成+2价。
如:Fe +SFeS 、Fe +Cu 2+===Fe 2++Cu 。
①生成+3价:铁与Cl 2、Br 2等反应生成+3价。
如2Fe +3Cl 2=====点燃2FeCl 3。
①生成+2、+3价:铁与H 2O 、O 2反应生成Fe 3O 4。
3Fe +4H 2O(g)=====高温Fe 3O 4+4H 2。
①铁与HNO 3反应:当Fe 过量生成+2价,3Fe +8H ++2NO -3===3Fe 2++2NO +4H 2O ; 当Fe 不足时生成+3价,Fe +4H ++NO -3===Fe 3++NO +2H 2O 。
(2)铁的化合物:FeO 、Fe 3O 4、Fe 2O 3、Fe(OH)2、Fe(OH)3、Fe 2+、Fe 3+等。
+2价铁具有还原性,与强氧化性物如HNO 3、Cl 2等发生氧化还原反应: 如:3FeO +10HNO 3===3Fe(NO 3)3+NO +5H 2O 。
+3价铁具有氧化性,与强还原性物质, 如:HI 、Fe 、Cu 、I -、S 2-等发生氧化还原反应,如:Fe 2O 3+6HI===2FeI 2+I 2+3H 2O,2Fe 3++Cu===2Fe 2++Cu 2+。
特别强调:①Fe 与一般酸反应生成Fe 2+,与酸的量无关,但Fe 与稀HNO 3反应时最终铁的价态与铁的量有关。
①铁与硫蒸气反应生成的是FeS 而不是Fe 2S 3;铁与碘蒸气反应生成的是FeI 2而不是FeI 3。
4.铁的氧化物特别强调:①FeO 、Fe 3O 4、Fe 2O 3与硝酸反应时均生成Fe 3+。

专题三:第二单元铁、铜的获取及性质——铁、铜及其化合物的应用【学海导航】1. 掌握铁、铜及其重要化合物的主要性质;2. 掌握F,与Fe3+的相互转化【主干知识】1.2. 233. Fe2+M Fe3+的检验★ 3、下列各组离子在水溶液中能大量共存的是E.Fe 2+、NO -、X 、Cl -【巩固练习】一.选择题(每小题有一个正确答案)1.向一定量的 FeQ Fe 、Fe sQ 的混合物中加入 100ml1mol • L -1的盐酸,恰好使混合物完全溶 解,放出224ml (标准状况)的气体,在所得溶液中加入 KSCN 溶液无血红色出现.若用足量的 CQ 在高温下还原相同的质量的此混合物,能得到铁的质量是 ( )A.11.2gB.5.6gC.2.8gD.无法计算2•某磁铁矿石200 t ,经分析其中含有铁元素 86 9 t (杂质中不含铁元素)。
则磁铁矿中Fe 3C 4的质量分数为A 50%B 60%C 65%D 70% 3.向铁和Fe 2Q 的混合物中加入足量稀 H b SQ ,充分反应后生成FeSQ 溶液,当生成的Fe 2+和H 2的物质的量之比为 4 : 1时,反应中关系量正确的是()【精彩例题】1.某 500mL 溶液中含 0.1 mol Fe 2+、0.2 mol Fe 3+,加入 0.2 mol 溶液中Fe 2+的物质的量浓度为(假设反应前后体积不变)2+、0.2 mol Fe 3+铁粉,待 ()Fe 3+完全还原后,-1 -1A . 0.4 mol • LB . 0.6 mol • L -1C . 0.8 mol • L.1.0 mol-L -11、★ 2.铁屑溶于过量的盐酸后,在加入下列物质, 会有三价铁生成的是 A 、硫酸 B 、氯水 C 硝酸锌D 、氯化铜3+2+A 、Fe 、Fe 、Cl -、QH B 、Fe 2+、 + + ______________ -H 、 Na 、NO C 、H> Fe 2+、SQ 2-、Cl、Fe 3+、 -+NO 、K 、ClA. 被氧化的铁与被还原的铁离子物质的量之比为B. 被氧化的铁与被还原的铁离子物质的量之比为C. 被氧化的铁与被还原的铁离子物质的量之比为D. 被氧化的铁与被还原的铁离子物质的量之比为 4. 根据 Fe+CuCl 2=FeCl 2+Cu; 性强弱顺序为2+ 2+ 3+A. Cu >Fe >Fe — 3+ — 2+ 2+C. Fe >Cu >Fe 5. 为除去FeSQ 溶液中的 A .烧碱溶液 B •浓氨水 C •镁粉 D •铁粉 6•把表面有氧化物的相同大小的铜片和铁片一起放入盐酸中充分反应,所得溶液中的金属离 子 ( ) A .是 Fe 3+和 C u 2+ B .是 Fe 2^ Cu 2+ C .是 Fe 2+ 和 Fe 3+ D .只有 Fe 2+ 7.在印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为 2FeCl 3+ Cu = 2FeCb + CuCb向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后下列结果不可能出现的是 () A .烧杯中有铜无铁 BC.烧杯中铁铜都有 D &将下列四种铁的化合物溶于稀盐酸,滴加 的是 A.FeS B.Fe 2Q★ 9.将3.48gFe 3C 4完全溶解在 全部转化为Fe 3+, C 「2C 2-还原为 A. 0.05mol/L B. 0.1mol/L ★ 10.将40 mL 1.5 mol • L 「1的CuSC 溶液与30 mL 3 mol • L 「1的NaOH 溶液混合,生成浅蓝 色沉淀,假如溶液中[Cu 2+ ]或[OH T ]都已变得很小,可忽略,则生成沉淀的组成( ) A Cu(OH) 2 B CuSO 4 • Cu(OH )2 C CuSO 4 • 2Cu(OH )2 D CuSO 4 • 3Cu(OH )2 2FeCl 3+Cu=2FeCl 2+CuCl 2 两个反应,判断 3+ 2+ 2+ B . Fe >Fe >Cu 2+ 3+ — 2+ D . Fe >Fe >Cu Fe 2(SO 4)3和CuSO,最好选用 B •浓氨水 C •镁粉 Fe 3+、( Fe 2+、Cu 2+的氧化 ) .烧杯中有铁无铜 •烧杯中铁铜都无 KSCN 溶液没有颜色变化,再加入氯水即呈红色 ( ) C.FeCI 3 D.Fe 2(SO 4)3100mL1mol/L 硫酸中,加入25mLKCr 2O 7溶液,恰好使溶液中 Fe 2+Cr 3+。


铁铜化学性质概括work Information Technology Company.2020YEAR铁、铜的性质(一)铁及其化合物的性质1、铁在周期表中的位置及结构铁位于第四周期第Ⅷ族,电子排布式为:1s22s22p63s23p63d64s2原子结构示意图为在化学反应中易失去两个或三个电子形成+2或+3价:Fe―2e―=Fe2+;Fe―3e―=Fe3+2、纯铁具有银白色光泽、密度大,熔沸点高,延展性、导电、导热性较好、能被磁铁吸引。
纯铁的抗腐蚀能力很强,通常我们所见的铁中由于含有碳等物质,抗腐蚀能力较弱,易发生电化腐蚀。
在酸性介质中发生:析氢腐蚀:负极:Fe-2e-=Fe2+;正极反应为:2H+=H2;在中性或碱性介质中发生:吸氧腐蚀:负极:Fe-2e-=Fe2+;正极反应为:2H2O+O2+4e- =4OH-3、化学性质:铁是较活泼的金属,易失去最外层和次外层的电子,常显+2、+3价,且Fe3+比Fe2+稳定。
(1)与非金属反应:铁与强氧化剂反应生成+3价铁的化合物,与弱氧化剂反应生成+2价铁的化合物。
如:3Fe+2O2Fe3O4;2Fe+3Cl22FeCl3;Fe+S FeS(2)与水反应:铁在加热至红热时能与水蒸气发生反应。
3Fe+4H2O(g)Fe3O4+4H2常温下,铁与水不起反应,但在水和空气里O2、CO2等共同作用下,铁易被腐蚀。
(3)与酸反应:非氧化性酸:Fe+2H+=Fe2++H2↑氧化性酸:常温下,铁遇浓硫酸、浓硝酸会钝化,加热条件下可发生氧化还原反应。
Fe+4HNO3(过量)=Fe(NO3)3+NO↑+2H2O3Fe(过量)+8HNO3=3Fe(NO3)2+2NO↑+4H2OFe+6HNO3(浓)Fe(NO3)3+3NO2↑+3H2O(4)与盐溶液反应:Fe+Cu2+=Fe2++Cu;Fe+2Fe3+=3Fe2+4、铁的重要化合物:铁的氧化物名称氧化亚铁氧化铁四氧化三铁化学式FeO Fe2O3 Fe3O4价态+2 +3 +2、+3俗名铁红磁性氧化铁名称氧化亚铁氧化铁四氧化三铁色态黑色粉末红棕色粉末黑色晶体溶解性不溶于水与HCl反应①②③与HNO3反应④⑤⑥与HI反应⑦⑧⑨特性不稳定。
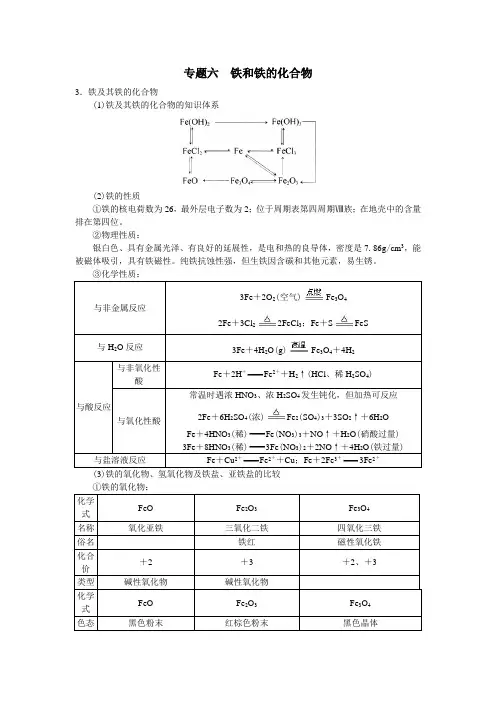
专题六 铁和铁的化合物3.铁及其铁的化合物(1)铁及其铁的化合物的知识体系(2)铁的性质①铁的核电荷数为26,最外层电子数为2;位于周期表第四周期Ⅷ族;在地壳中的含量排在第四位。
②物理性质:银白色、具有金属光泽、有良好的延展性,是电和热的良导体,密度是7.86g /cm 3,能被磁体吸引,具有铁磁性。
纯铁抗蚀性强,但生铁因含碳和其他元素,易生锈。
)2FeCl FeS +))+3Fe (3)铁的氧化物、氢氧化物及铁盐、亚铁盐的比较 ①铁的氧化物:+Fe+2Fe+2Al2Al8Al-Fe-Fe+++2FeO3Fe③铁盐、亚铁盐的性质:二价铁盐既有氧化性又有还原性,以还原性为主。
亚铁盐溶液在保存时,应在溶液中放少量铁粉防止被氧化,同时滴加少量的相应酸以防其水解。
硫酸亚铁在空气中变质的化学方程式:12FeSO4+3O2+6H2O4Fe2(SO4)3+4Fe(OH)3三价铁盐具有较强的氧化性:氯化铁腐蚀铜:Cu+2FeCl3CuCl2+2FeCl2氯化铁氧化二氧化硫:SO2+2FeCl3+2H2O H2SO4+2FeCl2+2HCl三价铁盐具有较强的水解性:Fe3++3H2O Fe(OH)3+3H+Fe3++3H2O Fe(OH)3(胶体)+3H+④Fe2+与Fe3+的检验、Fe2+与Fe3+与其他离子的共存:---OFe+、Fe+与其他离子的共存(4)铁的三角转化关系Fe→Fe2+:H+、Cu2+、Fe3+、S、I2Fe→Fe3+:Cl2、Br2、HNO3、浓H2SO4Fe2+→Fe3+:Cl2、Br2、O2、HNO3、浓H2SO4、KMnO4(H+)Fe3+→Fe2+:Fe、Cu、H2S、I-、SO2Fe→Fe3O4:O2、H2OFe3+、Fe2+、Fe3O4→Fe:CO、Al、H2Fe3+的变色情况①向Fe3+的溶液中加入KSCN溶液,溶液呈红色;②向Fe3+的溶液中加入NaOH溶液,生成红褐色沉淀;③将Fe3+的溶液中加入到KI淀粉溶液中,溶液变蓝色;④将饱和的Fe3+的盐溶液加入到沸水中,生成红褐色Fe(OH)3胶体;⑤向Fe3+的溶液中加入H2S气体,生成淡黄色沉淀;⑥向Fe3+的溶液中加入过量Fe粉,溶液变浅绿色;⑧向Fe3+的溶液中加入过量Cu粉,溶液变蓝绿色。

【校级公开课】第2单元课时2铁、铜及其化合物的应用教学设计一、学习目标(1)复习巩固已学的铁、铜的物理及化学性质;学习铁、铜的新的化学性质;学会用图示方法自主构建铁的不同价态相互转化的关系。
(2)采用实验探究的方法,掌握Fe3+、Fe2+的性质及相互转化条件,体验自主实验探究过程,培养学生分析问题和解决问题的能力。
(3)认识化学与人类生产、生活的密切关系。
体会铁、铜及其化合物的使用对人类生产、生活及人类身体健康的重要作用。
二、教学重点与难点教学重点:铁、铜及其化合物的性质,Fe3+与Fe2+的相互转化。
教学难点:Fe3+与Fe2+的相互转化。
三、设计思路主要采用网络信息技术与化学教学相结合,构建“基于数据的化学课堂个性化移动”教学模式。
让学生利用网络及个人移动终端——平板,课前教师推送微课视频让学生完成预习任务,课堂提出与生活密切相关的补铁药物说明书中的问题引入新课,激发学生的学习兴趣,带着问题,引导学生回顾前面学习的知识来比较铜与铁性质上的异同,从而找出铁、铜反应后产物的不同与氧化剂强弱的规律,同时,采取学生讨论、归纳知识与学生实验探究相结合的教学模式,通过根据教师提供的信息,由学生小组讨论,利用平板自主设计实验方案,实验探究Fe2+、Fe3+的性质以及Fe2+、Fe3+的相互转化关系,并用平板从而帮助学生构建“铁三角”关系。
四、教学用具:教室要求:智慧教室、移动学习终端——教师平板和学生平板、网络支持实验药品:0.1mol·L-1FeCl3溶液、0.1mol·L-1FeCl2溶液、KSCN溶液、铁粉、新制氯水、双氧水、KMnO4溶液、淀粉KI试纸五、教学过程【新课引入】展示小资料:铁是生物体必需元素之一,例如,人体血液中的血红蛋白和肌肉中的肌红蛋白具有输送和贮存氧的功能,它们都是有Fe(Ⅱ)卟啉组成的。
人体因铁的缺乏会引起贫血症。
【讲述】铁元素是维持生命活动不可缺少的微量元素,虽然人体中通常只含有3~5g铁元素,但铁元素在人体中却发挥着重要作用。

高一化学教案铁铜的化合物及性质【学海导航】1.掌握铁、铜及其重要化合物的主要性质;2.掌握Fe2+与Fe3+的相互转化【主干知识】1.铁的氧化物的性质比较:化学式FeOFe2O3Fe3O4俗名色态铁的价态水溶性稳定性与酸的反应共性2.Fe(OH)2和Fe(OH)3化学式Fe(OH)2Fe(OH)3状态化学性质制法★转化3.Fe2+与Fe3+的检验物质Fe2+Fe3+溶液颜色化学性质检验观察法碱法SCN-法氧化还原法4.氧化铜和氢氧化铜:化学式CuOCu(OH)2状态O化学性质制法转化【精彩例题】1.某500mL溶液中含0.1 mol Fe2+、0.2 mol Fe3+,加入0.2 mol 铁粉,待Fe3+完全还原后,溶液中Fe2+的物质的量浓度为(假设反应前后体积不变) ( )A.0.4 molL-1B.0.6 molL-1C.0.8 molL-1D.1.0 molL-11、★2.铁屑溶于过量的盐酸后,在加入下列物质,会有三价铁生成的是 ( )A、硫酸B、氯水C、硝酸锌D、氯化铜★3、下列各组离子在水溶液中能大量共存的是 ( )A、Fe3+、Fe2+、Cl-、OH-B、Fe2+、H+、Na+、NO3-C、H+、Fe2+、SO42-、Cl-D、Fe3+、NO3-、K+、Cl-E. Fe2+、NO3-、K+、Cl-【巩固练习】一.选择题(每小题有一个正确答案)1.向一定量的FeO、Fe、Fe3O4的混合物中加入100ml1molL-1的盐酸,恰好使混合物完全溶解,放出224ml(标准状况)的气体,在所得溶液中加入KSCN溶液无血红色出现.若用足量的CO在高温下还原相同的质量的此混合物,能得到铁的质量是 ( )A.11.2gB.5.6gC.2.8gD.无法计算2.某磁铁矿石200 t,经分析其中含有铁元素869 t (杂质中不含铁元素) 。
则磁铁矿中Fe3O4的质量分数为A 50%B 60%C 65%D 70%3.向铁和Fe2O3的混合物中加入足量稀H2SO4,充分反应后生成FeSO4溶液,当生成的Fe2+和H2的物质的量之比为4 ∶1时,反应中关系量正确的是 ( )A.被氧化的铁与被还原的铁离子物质的量之比为1∶1B.被氧化的铁与被还原的铁离子物质的量之比为2∶1C.被氧化的铁与被还原的铁离子物质的量之比为1∶2D.被氧化的铁与被还原的铁离子物质的量之比为1∶34.根据Fe+CuCl2=FeCl2+Cu;2FeCl3+Cu=2FeCl2+CuCl2两个反应,判断Fe3+、Fe2+、Cu2+的氧化性强弱顺序为 ( ) A.Cu2+Fe3+ B.Fe3+Cu2+C.Fe3+Fe2+D.Fe2+Cu2+5.为除去FeSO4溶液中的Fe2(SO4)3和CuSO4,最好选用 ( )A.烧碱溶液B.浓氨水C.镁粉D.铁粉6.把表面有氧化物的相同大小的铜片和铁片一起放入盐酸中充分反应,所得溶液中的金属离子 ( )A.是Fe3+和Cu2+B.是Fe2+和Cu2+C.是Fe2+和Fe3+D.只有Fe2+7.在印刷电路时常用氯化铁溶液作为腐蚀液,发生的反应为2FeCl3+Cu=2FeCl2+CuCl2向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后下列结果不可能出现的是( ) A.烧杯中有铜无铁 B.烧杯中有铁无铜C.烧杯中铁铜都有D.烧杯中铁铜都无8.将下列四种铁的化合物溶于稀盐酸,滴加KSCN溶液没有颜色变化,再加入氯水即呈红色的是 ( )A.FeSB.Fe2O3C.FeCl3D.Fe2(SO4)3★9.将3.48gFe3O4完全溶解在100mL1mol/L硫酸中,加入25mLK2Cr2O7溶液,恰好使溶液中Fe2+全部转化为Fe3+,Cr2O72-还原为Cr3+。



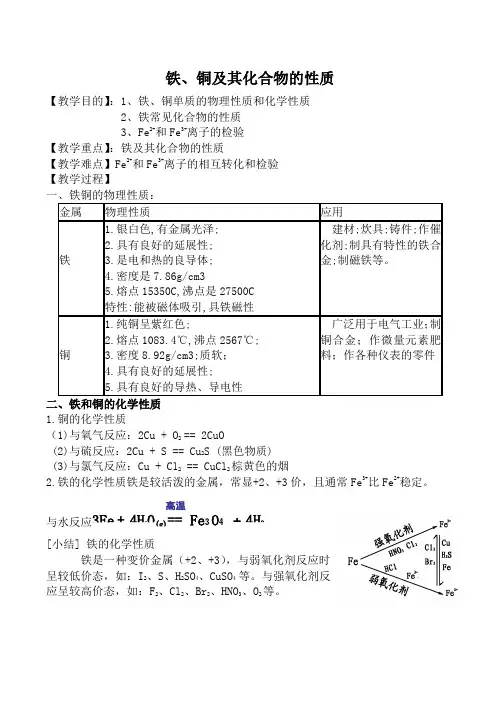
铁、铜及其化合物的性质【教学目的】:1、铁、铜单质的物理性质和化学性质2、铁常见化合物的性质3、Fe2+和Fe3+离子的检验【教学重点】:铁及其化合物的性质【教学难点】Fe2+和Fe3+离子的相互转化和检验【教学过程】金属物理性质应用铁1.银白色,有金属光泽;2.具有良好的延展性;3.是电和热的良导体;4.密度是7.86g/cm35.熔点15350C,沸点是27500C特性:能被磁体吸引,具铁磁性建材;炊具;铸件;作催化剂;制具有特性的铁合金;制磁铁等。
铜1.纯铜呈紫红色;2.熔点1083.4℃,沸点2567℃;3.密度8.92g/cm3;质软;4.具有良好的延展性;5.具有良好的导热、导电性广泛用于电气工业;制铜合金;作微量元素肥料;作各种仪表的零件1.铜的化学性质(1)与氧气反应:2Cu + O2== 2CuO(2)与硫反应:2Cu + S == Cu2S (黑色物质)(3)与氯气反应:Cu + Cl2 == CuCl2棕黄色的烟2.铁的化学性质铁是较活泼的金属,常显+2、+3价,且通常Fe3+比Fe2+稳定。
与水反应[小结] 铁的化学性质铁是一种变价金属(+2、+3),与弱氧化剂反应时呈较低价态,如:I2、S、H2SO4、CuSO4等。
与强氧化剂反应呈较高价态,如:F2、Cl2、Br2、HNO3、O2等。
高温+4H2Fe3 O44H2O3Fe(g)==+3、亚铁盐和铁盐①绿矾 (FeSO 4·7H 2O),制法:铁屑加稀硫酸---浓缩—冷却—绿色晶体。
用途:分析化学上常用作还原剂,制蓝黑墨水、染料,杀虫剂等。
②三氯化铁 (FeCl 3),制法:铁屑与氯气直接反应2Fe+3Cl 2==2FeCl 3 或Fe+HCl 再通Cl2---浓缩---冷却--FeCl 3·6H 2O [问1]:向FeCl 3溶液中投入镁粉,可能发生的反应有: [问2]:Fe 3+能使淀粉-KI 试纸变蓝,写出反应离子方程式。