第三节 《化学反应的利用》(第二课时)
- 格式:doc
- 大小:140.00 KB
- 文档页数:4



第三节化学反应的利用(第2课时)预习学案(15017)制作人:张立庆审核人:吴宏伟使用时间:2012.4.4教师寄语:谁若游戏人生,他就一事无成;谁不能主宰自己,便永远是一个奴隶。
[学习目标]了解原电池的工作原理[自主学习]二.化学反应为人类提供能源1.物质发生化学反应的实质是,当生成新化学键所释放的能量大于破坏化学键所吸收的的能量时,化学反应会。
2.人们可以利用化学反应将储存在物质内部的化学能转化为、等,从而使化学能成为能量的主要来源之一。
3.当把铜片和锌片用导线连接起来同时插入H2SO4溶液中时,由于金属锌比金属铜,锌原子容易电子被成Zn2+进入溶液中,锌片上的电子通过流向,溶液中的H+从铜片上电子被形成氢原子,氢原子再结合成从铜片上逸出。
因此,电池是利用反应将转化成的装置4.锌锰电池属于(又称),而汽车用的镍氢电池和锂电池属于(又称)。
燃料电池由于具等优点而应用于航天和军事领域。
5.光能转化为化学能最有说服力的例证莫过于。
6.人们不仅利用化学反应制造、提供,还利用化学反应开发了各种分析技术来确定等。
[预习检测]1.现有下列反应:A. 3H2+Fe2O3 △2Fe+3H2OB. Fe+CuSO4==Cu+FeSO4C. Ba(OH)2+H2SO4==BaSO4+2H2OD. NH4HCO3△3↑+CO2↑+H2O(1)属于氧化还原的反应是(用序号填空)(2)即属于置换反应又属于氧化还原反应的是(用序号填空)2.下列关于原电池的说法正确的是()A.在正极上发生氧化反应B.化学性质较活泼的金属为负极C.在外电路,电子流出正极D.是由电能转化为化学能的装置[自主学习]参考答案1、旧化学键断裂、新化学键形成,释放能量2、热能,电能3、活泼,失去,氧化,导线,获得,还原,氢气分子,氧化还原,化学能,电能4、干电池,一次电池,蓄电池,二次电池,有能量转化率高、能长时间提供电能5、绿色植物的光合作用6、丰富多彩的物质,赖以生存和发展的能量,各种物质的组成、结构以及测定物质有关组分的含量。


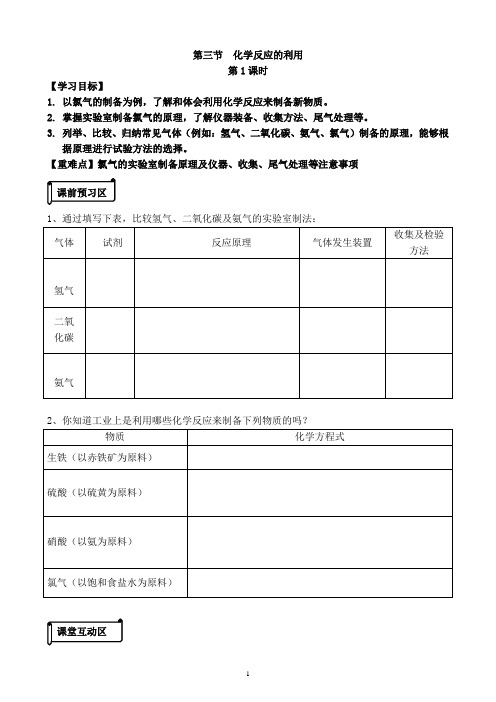
1 第三节 化学反应的利用 第1课时 【学习目标】 1. 以氯气的制备为例,了解和体会利用化学反应来制备新物质。 2. 掌握实验室制备氯气的原理,了解仪器装备、收集方法、尾气处理等。 3. 列举、比较、归纳常见气体(例如:氢气、二氧化碳、氨气、氯气)制备的原理,能够根据原理进行试验方法的选择。 【重难点】氯气的实验室制备原理及仪器、收集、尾气处理等注意事项
1、通过填写下表,比较氢气、二氧化碳及氨气的实验室制法: 气体 试剂 反应原理 气体发生装置 收集及检验方法
氢气 二氧 化碳
氨气 2、你知道工业上是利用哪些化学反应来制备下列物质的吗? 物质 化学方程式
生铁(以赤铁矿为原料)
硫酸(以硫黄为原料)
硝酸(以氨为原料) 氯气(以饱和食盐水为原料)
课堂互动区
课前预习区 2
【交流讨论】 1、到目前为止,你已经学习过哪些化学反应? 你对化学反应的实质、规律有了哪些了解? 2、化学反应与人们的日常生活和化工生产有着密切的联系。请你举例说明,在日常生活中和化工生产中,化学反应有哪些应用?
【活动•探究】 1、分析以下四个制取氯气的反应原理:从氧化-还原反应知识的角度分析,有什么共同之处?你认为哪个反应原理适合工业生产,哪些反应原理可以用在实验室中? ①
② ③ ④ 2、根据以下信息,选择哪些实验仪器组装成制取氯气的发生和收集装置较为合适? 物质 发生装置 收集装置 氢气 固—液 不加热型 向下排空气法、排水法 二氧化碳 固—液 不加热型 向上排空气法 氨气 固—固 加热型 向下排空气法
【整理归纳】 二、实验室制备氯气原理:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O
【演示实验】 连接制取氯气的发生装置和收集装置,以及尾气处理装置,制取氯气。(如图所示,在烧瓶里加入少量的二氧化锰粉末,通
过分液漏斗向烧瓶中加入适量密度为1.19g/cm3的浓盐酸,缓缓加热,使反应加速进行。观察试剂 浓盐酸、二氧化锰固体
1
《化学反应的利用 第2课时》
班级 姓名 学号
【要求】
1.了解原电池的工作原理,能写出简单电极反应式和电池反应方程式。
2.了解常见化学电源的种类及其工作原理,认识化学能与电能相互转化的实
际意义及其重要应用。
【课前预习案】
一、原电池的工作原理:
1、 原电池:利用氧化还原反应把化学能转变成电能的装置。
以Cu-Zn- H2SO4原电池为例说明其工作原理:
由于_____活泼,容易_____电子,锌原子失去电子被______
成Zn2+进入溶液,锌片的质量减小,失去的电子通过导线流向铜片, 溶液中
的______从铜片得到电子而被______形成氢原子, 氢原子再结合成氢气分
子从铜片上逸出。
电极反应式:负极: Zn -2e- = Zn2+ 正极: 2H++2e-=H2
总反应方程式:__________________(正极反应式+负极反应式)
电解质溶液中离子的移动方向:______离子移向正极, ______离子移向负极。
2、形成原电池的条件:
① 两个活泼性不同的电极 ② 有电解质溶液
③ 形成闭合回路 ④ 能自发的发生氧化还原反应
(从从理论上说,任何一个自发的氧化还原反应均可设计成原电池)
注:负极必须能与电解质溶液的粒子发生反应
二.电极反应式和原电池总反应式的书写
(1)负极——失电子,发生 反应(一般是负极本身失电子)
(2)正极——得电子,发生 反应(一般是溶液中阳离子在正极上得
电子或正极本身得电子)
(3)总反应式(即电池反应)= 正极反应式 + 负极反应式
例1.一原电池如右图所示:试写出该原电池的电极反应式和总
反应式:正极:
负极:
总式:
4、原电池正负极判定方法
①依据原电池两极材料:较活泼的金属作负极(K、Ca、Na太活泼,不能作
电极);较不活泼金属或可导电的非金属(石墨等)作正极。
Fe Cu
FeCl3溶液
2
②根据电流方向或电子流向:电流(内电路)由正极流向负极;电子则由负极
经外电路流向原电池的正极。
③根据电解质溶液中离子迁移方向:阳离子移向原电池正极,阴离子移向原
电池负极。
④根据原电池中反应类型:
正极:____电子,发生_____反应,现象是伴随金属的析出或H2的放出。
负极:____电子,发生_____反应,现象则是电极本身的消耗,质量减小。
【预习检测】
1.能够组成原电池装置的是( )
2、原电池的正极一定是( )
A、化学性质较活泼的金属 B、化学性质较不活泼的金属
C、电子流出的极 D、电子流入的极
3、把镁和铝用导线连接放入氢氧化钠溶液中,下列说法正确的是( )
A.不能形成原电池 B.形成原电池时铝为正极
C.形成原电池时铝为负极 D.形成原电池时镁为负极
4:(2007潮州)在理论上可用于设计原电池的化学反应是( )
A.2Al+2NaOH+2H2O=2NaAlO2+3H2
B.Ba(OH)2•8H2O+2NH4Cl=BaCl2+2NH3•H2O+8H2O
C.CaC2+2H2O=Ca(OH)2+C2H2 D.HCl+NaCl=NaCl+H2O
【课堂探究案】
一. 原电池的工作原理、形成及电极反应式的书写
例1、将铁片和铜片用导线连接置于同一稀盐酸溶液中,并经过一段时间后,
下列各叙述正确的是( )
A.负极有Cl2逸出,正极有H2逸出 B.负极附近Cl―的浓度减小
C.正极附近Cl―的浓度逐渐增大 D.溶液中Cl―的浓度基本不变
例2、下列装置是不是原电池?若是,指出正负极,并写出电极反应。
(1) A图:正极: 负极:
总式:
(2) B图:正极: 负极:
总式:
G
Zn
Cu
浓硫酸 G Ag Cu G Zn C G Zn Cu AgNO3溶液 甘油 稀硫酸
A
B C D
Z
C
3
Zn Cu
ZnSO4 CuSO
4
A图 B图
二.原电池原理应用
(一)、原电池的设计方法:
例3:利用下述反应:2Fe3+ + Cu == 2Fe2++ Cu2+设计一个原电池装置。
①画出装置图(标明电极材料和电解质溶液):
②写出电极反应式。
负极:
正极:
总反应式:
(二)判断金属活泼性
规律总结:金属活泼性强弱可以从一下几个方面判断
1.与水或酸反应的剧烈程度来判断 2.根据置换反应的规律来判断
3.根据原电池正负极来判断(负极金属活泼性比正极强)
4.根据金属活动性顺序表来判断
例4.有a、b、c、d四种金属,将a与b用导线连接起来,浸入电解质溶液
中,b不易腐蚀。将a和d分别投入等浓度的盐酸中,d比a反应剧烈,将
铜浸入b的盐溶液中,无明显变化。将铜浸入c的盐溶液中,有金属c析出。
据此可推知它们的活动性顺序由强到弱为 ( )
A.dcab B.dabc C.dbac D.badc
(三)、加快反应速率:形成原电池可加快某些反应的反应速率
例5:实验室用Zn与H2SO4制H2,用粗锌产生H2的速率比用纯Zn ,
在稀H2SO4中加入少量硫酸铜溶液,也同样会加快Zn与稀H2SO4产生H
2
的速率,这是因为 。
(四)金属的腐蚀(从理论上揭示钢铁腐蚀的主要原因)
(五)制造多种化学电源,如干电池、蓄电池、燃料电池等。
【随堂练习】
1.下列关于原电池的叙述正确的是 ( )
A.构成原电池的正极和负极必须是两种不同的金属
B.原电池是将化学能转变为电能的装置
C.原电池中电子流出的一极是负极,该极被还原
D.原电池放电时,外电路电流的方向是从负极到正极
2.某原电池的总反应式为:2Fe3++Fe == 3Fe2+,不能实现该反应的原电池
4
Fe C
FeCl3溶液
组成是( )
A.正极为铜,负极为铁,电解质溶液为FeCl3溶液
B.正极为碳,负极为铁,电解质溶液为Fe(NO3)3溶液
C.正极为铁,负极为锌,电解质溶液为Fe2(SO4)3溶液
D.正极为银,负极为铁,电解质溶液为CuSO4溶液
3.如图所示的装置中,在产生电流时,以下说法不正确的是( )
A.Fe是负极,C是正极 B.负极反应式为:Fe-3e-=Fe3+
C.内电路中阴离子移向Fe极 D.外电路电流由石墨电极流向
Fe电极
4、用锌和稀硫酸反应制取氢气时,加入少量CuSO4溶液的目的是( )
A.防止产生过多的氢气 B.降低产生氢气的速率
C. 提高产生氢气的量 D.加快反应速率
【课后拓展案】
1、下列各组物质中均含两种固体材料和一种溶液,当将两种固体材料插入
该组相应的溶液中形成闭合回路时,能形成电流的是( )
A.C、NaOH、C B.Zn、NH4Cl、C
C.Zn、CuSO4、Cu D.Cu、乙醇、Ag
2、 关于如图所示装置的叙述,正确的是( )
A.铜是阳极,铜片上有气泡产生B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片
D.氢离子在铜片表面被还原
3.锌电池具有容量大,污染小等优点,电池反应为:2Zn+O2==2ZnO,原料
为锌粒、电解液和空气。下列叙述正确的是( )
A.锌为正极,空气进入负极反应 B.锌为负极,发生还原反应
C.正极发生氧化反应 D.电解质溶液肯定不是酸溶液
4.如图所示原电池,下列说法正确的是( )
(提示:负极与电解质溶液发生反应)
A.该原电池的铁失电子,做原电池的负极
B.该装置中电子在外电路由铜极流向铁极
C.该装置中发生氧化反应的是铁极 D.该装置中铜极上有气泡产生
5、有两种金属A和B,用导线连接后插入到稀H2SO4中,观察到A极溶解,
B极上有气泡产生,根据电极现象判断出A是 极,B是 极;由原电
池原理可知,金属活动性______强,即原电池中,活动性强的金属为_____
极,活动性弱的金属为______极。
6.在Cu-Zn原电池中,200mLH2SO4 溶液的浓度为0.125mol/L , 若工作一段
时间后,从装置中共收集到 0.168L升气体,则流过导线的电子为
mol,溶液的H+浓度为 ?(溶液体积变化忽略不计)
Fe Cu
浓硝酸