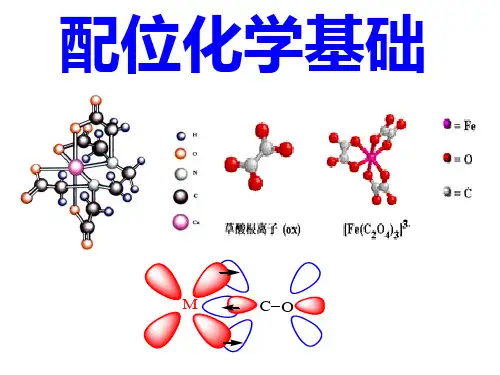
配位化学讲义KE
- 格式:ppt
- 大小:3.56 MB
- 文档页数:39



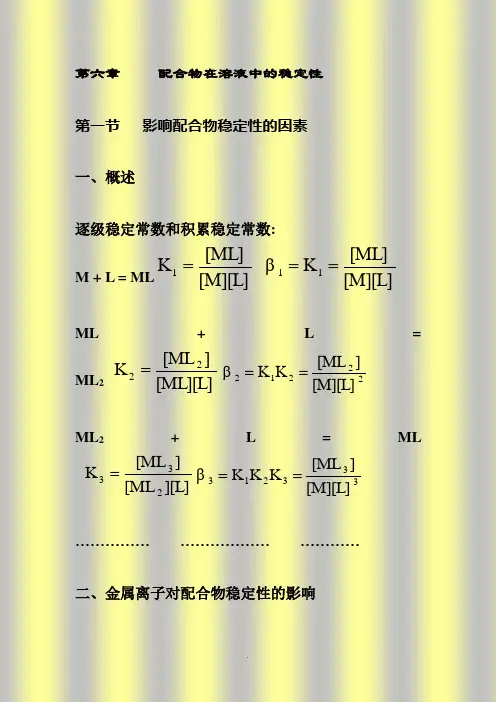
第一章配位化学的基础知识第一节配合物的基本概念研究配合物的化学称配位化学Coordination chemistry或称配合物化学Chemistry of Coordination Compounds络合物化学Complex Chemistry1891年Werner提出配位理论Werner配位理论的主要要点:1 配合物内中心离子(原子)有两种化合价,一种是主价,一种是副价,主价即表示氧化态,副价则表示配位数,3NH3NH3Cl3NHNH32 把配合物分成内界和外界3 提出了配合物的空间结构配合物的定义:凡是有含有孤对电子(或 电子)的离子或分子与具有能接受孤对电的适当空轨道的离子或分子或原子所结合而成的离子或分子经典的配合物配合物离子与异电荷离子构成的电中性化合物如KAu(CN)2带电荷的配合物称为配离子如Au(CN)2- , Ag(CN)2-配合物本身为分子如Ni(CO)4, [Pt(NH3)2Cl2]配合物的组成:[Cu (NH3)4]2+SO42-中心离子配位键配位原子配位体配位数配离子电荷外界离子中心离子(原子):金属离子配位体:与中心离子相结合的阴离子或分子配位原子配位体中直接与中心离子结合的原子称为配位原子配位原子在周期表中的位置:配位数:配合物中,与中心离子直接结合的配位原子的总数,多齿配体:第二节 配合物的稳定常数[Cu (NH 3)4]SO 4溶于水时,内外界之间完全离解[Cu(NH 3)4]SO 4=[Cu(NH 3)4]2+ + SO 42-[Cu(NH 3)4]2+ 进一步离解成[Cu(NH 3)3]2+ [Cu(NH 3)2]2+ [Cu(NH 3)]2+ Cu 2+氨的浓度高时可能形成[Cu(NH 3)6]2+1 配离子的逐级和积累稳定常数只讨论单核单配的情况配合物形成的反应方程式和平衡常可表示为:ML L M =+ (1)]][[][1L M ML K =2ML L ML =+ (2)]][[][22L ML ML K =n n ML L ML =+-1]][[][1L ML ML K n n n -=[ ] 浓度稳定常数 ( ) 活度稳定常数K 1, K 2,… , K n 称为逐级稳定常数(分步稳定常数) K 1-第一级稳定常数 K 2-第二级稳定常数, …K n -第n 级稳定常数如将(1)和(2)相加合并,则有:M +2L =ML 2相应的稳定常数表达式为:212222]][][][[]][[]][[][K K L M L ML ML ML L M ML ===β将(1)、(2)和(3)式相加,有:33ML L M =+321333]][[][K K K L M ML ==β对ML n ,则有:n ML nL M =+∏====ni i n n n n K K K K K L M ML 1321...]][[][β其中,.,21211K K K ==ββn βββ....21称为积累稳定常数另一种表示方法可采用不稳定常数稳定常数的数据汇编:A.E Martell and R.M. Smith :Critical stability constantsVol.1 Amino acid (1974) Vol.2 Amines (1975) Vol.3 Other organic ligand Vol.4 Inorganic complexes本校图书馆的分类号:54。

配位化学知识点总结一、配位化学的基本概念配位化学是研究金属离子(或原子)与配体之间形成的配位化合物的结构、性质和反应的化学分支。
首先,我们来了解一下什么是配体。
配体是能够提供孤对电子与中心金属离子(或原子)形成配位键的分子或离子。
常见的配体有水分子、氨分子、氯离子等。
而中心金属离子(或原子)则具有空的价电子轨道,可以接受配体提供的孤对电子。
配位键是一种特殊的共价键,由配体提供孤对电子进入中心金属离子(或原子)的空轨道而形成。
配位化合物则是由中心金属离子(或原子)与配体通过配位键结合形成的具有一定空间结构和化学性质的化合物。
二、配位化合物的组成配位化合物通常由内界和外界两部分组成。
内界是配位化合物的核心部分,由中心金属离子(或原子)与配体紧密结合而成。
例如,在Cu(NH₃)₄SO₄中,Cu(NH₃)₄²⁺就是内界。
外界则是与内界通过离子键结合的其他离子。
在上述例子中,SO₄²⁻就是外界。
中心金属离子(或原子)的化合价与配体的化合价之和等于配位化合物的总化合价。
配位数指的是直接与中心金属离子(或原子)结合的配体的数目。
常见的配位数有 2、4、6 等。
三、配位化合物的结构配位化合物具有特定的空间结构。
常见的配位几何构型有直线型、平面三角形、四面体、八面体等。
例如,配位数为 2 时,通常形成直线型结构;配位数为 4 时,可能是平面正方形或四面体结构;配位数为 6 时,多为八面体结构。
这些结构的形成取决于中心金属离子(或原子)的电子构型和配体的大小、形状等因素。
四、配位化合物的命名配位化合物的命名有一套严格的规则。
先命名外界离子,然后是内界。
内界的命名顺序为:配体名称在前,中心金属离子(或原子)名称在后。
配体的命名顺序遵循先无机配体,后有机配体;先阴离子配体,后中性分子配体。
对于同类配体,按配体中原子个数由少到多的顺序命名。
如果配体中含有多种原子,先列出阴离子配体,再列出中性分子配体。
研究发现:第四周期过渡金属离子与含O、N配位原子的配体的高自旋八面体配合物,其稳定性顺序如下:Mn2+<Fe2+< Co2+< Ni2+< Cu2+ >Zn2+CFSE(Dq) 0 -4 -8 -12 -6 0这称为Irving-Williams顺序,可用CFSE解释。
Ni2+<Cu2+,可用Jahn-Teller效应解释。
三、配体性质对配合物稳定性的影响1、碱性配位原子相同,结构类似的配体与同种金属离子形成配合物时,配体碱性越强,配合物越稳定。
例:Cu2+的配合物:配体lgK H lgK1BrCH2CO2H 2.86 1.59ICH2CO2H 4.05 1.91phCH2CO2H 4.311.982、螯合效应1)螯合效应:螯合环的形成使配合物稳定性与组成和结构相似的非螯合配合物相比大大提高,称为螯合效应。
例:[Ni(NH3)6]2+lgβ6 = 8.61;心原子的关系1、软硬酸、碱概念(指Lewis酸碱)硬酸:其接受电子对的原子(离子)正电荷高,变形性低。
如:Li+、Mg2+、Al3+。
软酸:其接受电子对的原子(离子)正电荷低,变形性高。
如:Cu+、Ag+、Au+。
硬碱:其给出电子对的原子变形性小,电负性大。
如: F-、OH-。
软碱:其给出电子对的原子变形性大,电负性小。
如: I-、S2-。
2、软硬酸碱规那么在配合物稳定性中的应用1)硬酸倾向于与硬碱结合;2)软酸倾向于与软碱结合;配位化学中,作为中心离子的硬酸与配位原子各不相同的配体形成配合物倾向为:F>Cl>Br>I (1)O>>S>Se>Te (2)N>>P>As>Sb (3)而与软酸中心离子形成配合物的倾向的顺序为:F < Cl < Br < I (4)O << S ~ Se ~ Te(5)N << P > As > Sb (6)对(6)的解释:σ键增强N << P > As > Sb空d轨道:无3d 4d 5d反馈π键减弱π键作用大于σ键。




配位化学知识点总结配位化学是化学的一个重要分支,它探讨的是化学中的配位作用,即两个或多个分子相互作用形成复合物。
在高分子材料、医药、冶金、土木工程和环境科学等领域应用广泛。
配位化学的基础知识和技能是化学专业学生和研究人员必备的求生技能之一。
本文将介绍配位化学的基本概念、重要原则以及主要应用。
一、配位化学的基本概念1. 配位体在化学中,配位体是指通过给体原子与金属中心之间的化学键与金属形成配合物的分子或离子。
著名的例子有氨、水、五硝基吡啶、乙二胺等。
2. 配位作用配位作用是指配位体的给体原子利用孤对电子与金属中心形成协同共振化学键的过程。
配位能力取决于给体原子的化学性质。
一般来说,仅具有孤对电子的原子或离子能够作为配位体。
在配位作用中,给体原子发生了电子的向金属中心的迁移,原子中的孤对电子与金属中心的未配对电子形成共价键。
3. 配位数配位数是一个复合物中与离子或分子互相作用的中心原子数量。
通常,金属离子具有高配位数,而范德瓦尔斯复合物和氢键配合物具有较低的配位数。
二、配位化学的重要原则1. 八面体配位八面体配位是指配合物中金属中心周围八个空间位置上配位体的均匀分布,也是最常见的配位几何形态之一。
一些典型的八面体配位化合物包括六氟合铁酸钾和硫脲铜硫脲。
2. 方阵配位方阵配位是一种由四个配位体组成的四面体形态的配位体,常见的方阵配位化合物包括四氟合镍和四氯合钴。
3. 配体场理论配体场理论是解释元素化学、配位化学和配位化合物性质的一种理论。
该理论通过将配位体组合成简单的场点,进而表征复合物的化学键结构和物理性质。
三、配位化学的主要应用1. 工业催化工业化学中的催化剂往往是由配位化合物构成,钯的催化反应、铂的催化脱氢和钨的催化氧化反应都是利用了配位体的协同作用完成的。
例如,五氯甲基钌配合物和卟啉钴配合物在氧气氧化和n 桥苯甲基乙烯二醇转移反应中均被用作催化剂。
2. 生物学知识生物配合物(例如血红蛋白和维生素B12)中的重要化学反应是由于配位体与活性中心原子之间的化学反应所形成的。