配合物讲义-超好-经典-全面
- 格式:doc
- 大小:411.50 KB
- 文档页数:11



配位化合物的讲义第一节配位化合物的基本概念(一)配位共价键由一个原子单方面提供l对电子与另一个有空轨道的原子(或离子)共用而形成的共价键,称为配位共价键(coordinate bond),简称配位键.在配位键中,提供电子对的原子称为电子对的给予体;接受电子对的原子称为电子对的接受体.配位键常用"→"表示,箭头指向电子对的接受体.例如,铵离子(NH)可看作是氨NH3分子与H+离子结合形成的.在氨分子中,氮原子的2p轨道上有一对没有与其他原子共用的电子,这对电子称为孤对电子,氢离子上具有1s空轨道.在氨分子与氢离子作用时,氨分子上的孤对电子进入氢离子的空轨道,与氢共用,形成配位键.在铵离子中,虽然1个N→H键和其他3个N-H键的形成过程不同,但一旦形成了铵离子,这4个氮氢键的性质完全相同.配位键是一种特殊的共价键,广泛存在于无机化合物中.凡一方有空轨道,另一方有未共用电子对时,两者就可能形成配位键.例如:HNO3,H2SO4及其盐中均存在着配位键.(二)配位化合物配位化合物简称配合物,是一类组成复杂,发展迅速,应用广泛的化合物.1.配位化合物的概念配位化合物是一类含有配位单元的复杂化合物.通常以酸,碱,盐形式存在,也可以电中性的配位分子形式存在.如[Cu(NH3)4]SO4,K4[Fe(CN)6],[Fe(CO)5]等.配位单元一般是指由金属原子或金属离子与其他分子或离子以配位键结合而形成的复杂离子或化合物.如[Cu(NH3)4]2+,[Fe(CN)6]4-,[Fe(CO)5],[PtCl2(NH3)2]等.离子型配位单元又称为配离子.根据配离子所带电荷的不同,可分为配阳离子和配阴离子,如[Cu(NH3)4]2+,[Fe(CN)6]4-.含有配位单元的化合物称为配位化合物(coordination compound).习惯上把配离子也称为配合物.2.配位化合物的组成配位化合物的核心是配位单元.通常把配位化合物分为内界和外界两个部分.内界是配离子,外界是反离子,内界和外界之间以离子键结合.现以硫酸四氨合铜(Ⅱ)为例来说明配合物的组成.(1)中心原子(或离子) 在配离子(或配位分子)中,接受孤对电子的阳离子或原子统称为中心原子(central atom).中心原子位于配位化合物的中心位置,是配合物的核心部分,也称为配合物的形成体.中心原子必须具有空轨道,可以接受孤对电子.常见的中心原子多为副族的金属离子或原子.如[Cu(NH3)4]2+的中心原子Cu2+,[Fe(CO)5]的中心原子Fe等.(2)配位体和配位原子在配合物中,与中心原子以配位键结合的阴离子或中性分子称为配位体(ligand),简称配体.如[Cu(NH3)4]SO4,K4[Fe(CN)6]和[Fe(CO)5]中的NH3,CN-和CO都是配位体.配位体中能提供孤对电子与中心原子以配位键相结合的原子称为配位原子(ligating atom).如NH3中的N,CN-中的C,CO中的C.常见的配位体有:NH3,H2O,CN-,SCN-,Cl-等.常见的配位原子有:N,O,C,S,Cl等.按配位体中配位原子的多少,配位体可分为单齿配位体和多齿配位体.含有一个配位原子的配位体为单齿配位体(monodentate ligand);含有两个或两个以上配位原子的配位体为多齿配位体(polydentate ligand).如:乙二胺乙二胺四乙酸根离子多齿配位体与中心原子形成的配合物也称为螯合物(chelate).(3)配位数在配合物中,与中心原子结合成键的配位原子的数目称为配位数(coordination number).如K4[Fe(CN)6]中有6个C原子与Fe2+成键,Fe2+的配位数是6.而[Cu(en)2] (OH)2中配位体en是双齿配位体,因此Cu2+的配位数是4而不是2.若配位体有两种(或两种以上),则配位数是配位原子数之和.如[Pt(NO2)2(NH3)4]Cl2中Pt4+的配位数是6.(4)配离子的电荷配离子的电荷数等于中心原子与配位体电荷数的代数和.例如,在[Cu(NH3)4]SO4中,配离子的电荷数为: +2,写作[Cu(NH3)4]2+.在K4[Fe(CN)6]中,配离子的电荷数为:-4,写作[Fe(CN)6]4-.由于配合物是电中性的,因此,外界离子的电荷总数和配离子的电荷总数相等,符号相反,所以配离子的电荷数也可以根据外界离子来确定.3.配合物的命名配合物的命名与一般无机化合物的命名原则相同.(1)配合物的命名顺序阴离子在前,阳离子在后,像一般无机化合物中的二元化合物,酸,碱,盐一样,命名为"某化某","某酸","氢氧化某"和"某酸某".(2)配离子的命名顺序配位体数目(中文数字表示)—配位体名称—合—中心原子名称—中心原子氧化值(罗马数字表示).有的配离子可用简称.(3)配位体命名顺序若配位体不止一种,则先无机配位体,后有机配位体;先阴离子,后中性分子.若均为中性分子或均为阴离子,可按配位原子元素符号英文字母顺序排列.不同配位体之间以圆点"·"分开,复杂的配位体名称写在圆括号中,以免混淆.下列是一些配合物的命名实例:[Ag(NH3)2]+ 二氨合银(Ⅰ)配离子 (银氨配离子)[Fe(CN)6]3- 六氰合铁(Ⅲ) 配离子[Fe(CO)5] 五羰基合铁(0)[Pt(NO2)2(NH3)4]2+ 二硝基·四氨合铂(Ⅳ)配离子[Co(NH3)5H2O]3+ 五氨·一水合钴(Ⅲ)配离子[Ag(NH3)2]OH 氢氧化二氨合银(I)[Cu(NH3)4]SO4 硫酸四氨合铜(Ⅱ)K3[Fe(CN)6] 六氰合铁(Ⅲ)酸钾 (铁氰化钾或赤血盐)H2[PtCl6] 六氯合铂(Ⅳ)酸[Pt(NO2)2(NH3)4]Cl2 二氯化二硝基·四氨合铂(Ⅳ)[Co(NH3)5H2O]Cl3 三氯化五氨·一水合钴(Ⅲ)第二节配合物的稳定性一,配离子的离解平衡将氨水加到硝酸银溶液中,则有[Ag(NH3)2]+配离子生成,反应式为:Ag++2NH3→[Ag(NH3)2]+此反应称为配合反应(也叫络合反应).由于配离子是由中心离子和配位体以配价键结合起来的,因此,在水溶液中比较稳定.但也并不是完全不能离解成简单离子,实质上和弱电解质类似,也有微弱的离解现象.(一)配合物的稳定常数配合物的稳定性,可以用生成配合物的平衡常数来表示,例如:应用化学平衡原理,可得:K值越大,表示形成配离子的倾向越大,此配合物越稳定.所以配离子的生成常数又称为稳定常数(Ks).(二)不稳定常数在水溶液中,[Ag(NH3)2]+是稳定的,不过像其他弱电解质一样也有少数[Ag(NH3)2] +发生离解,可用下式表示:则平衡常数表达式为:K不稳值愈大,表示配离子离解愈多,故称K不稳为配离子的不稳定常数. Ks和K 不稳互成倒数.二,配合平衡的移动金属离子Mn+和配位体A-生成配离子MA x (n-x)+,在水溶液中存在如下平衡:根据平衡移动原理,改变Mn+或A-的浓度,会使上述平衡发生移动.若在上述溶液中加入某种试剂使Mn+生成难溶化合物,或者改变Mn+的氧化状态,都会使平衡向左移动.若改变溶液的酸度使A-生成难离解的弱酸,也可使平衡向左移动.配合平衡同样是一种相对的平衡状态,它同溶液的pH值,沉淀反应,氧化还原反应等都有密切的关系.(一)与酸度的关系根据酸碱质子理论,所有的配位体都可以看作是一种碱.因此,在增加溶液中的H+浓度时,由于配位体同H+结合成弱酸面使配合平衡向右移动,配离子平衡遭到破坏,这种现象称为酸效应,例如:配位体的碱性愈强,溶液的pH值愈小,配离子愈易被破坏.金属离子在水中,都会有不同程度的水解作用.溶液的pH值愈大,愈有利于水解的进行.例如:Fe3+在碱性介质中容易发生水解反应,溶液的碱性愈强,水解愈彻底(生成Fe(OH)3沉淀).因此,在碱性介质中,由于Fe3+水解成难溶的Fe(OH)3沉淀而使平衡向右移动,因而[FeF6]3-遭到破坏,这种现象称为金属离子的水解效应.(二)与沉淀反应的关系当向含有氯化银沉淀的溶液中加入氨水时,沉淀即溶解.当在上述溶液中加入溴化钠溶液时,又有淡黄色的沉淀生成.由于AgBr的溶解度比AgCl的溶解度小得多,因而Br-争夺Ag+的能力比Cl-的大,所以能产生AgBr沉淀而不能产生AgCl沉淀.沉淀剂与金属离子生成沉淀的溶解度愈小,愈能使配离子破坏而生成沉淀.(三)与氧化还原反应的关系配合反应的发生可以改变金属离子的氧化能力.例如:当PbO2(Pt+)与盐酸反应时,其产物不是PbCl4,而是PbCl2和Cl2.但是当它形成[PbCl6]2-配离子后,Pb就能保持它的+4氧化态.配合反应影响氧化还原反应的方向.例如,Fe3+可以把I-氧化成I2:在加入F-后,由于生成[FeF6]3-,减少了Fe3+的浓度,使平衡向左移动.当我们考查配合反应对氧化还原反应的影响时,不仅要注意配离子的形成,而且还要注意配离子的稳定性.第三节螯合物(内络合物)一,螯合物的概念螯合物又称内络合物,是螯合物形成体(中心离子)和某些合乎一定条件的螯合剂(配位体)配合而成具有环状结构的配合物."螯合"即成环的意思,犹如螃蟹的两个螯把形成体(中心离子)钳住似的,故叫螯合物.形成螯合物的第一个条件是螯合剂必须有两个或两个以上都能给出电子对的配位原子(主要是N,O,S等原子).第二个条件是每两个能给出电子对的配位原子,必须隔着两个或三个其他原子,因为只有这样,才可以形成稳定的五原子环或六原子环.例如,在氨基乙酸根离子(H2N-CH2-COO-)中,给出电子的羟基氧和氨基氮之间,隔着两个碳原子,因此它可以形成稳定的具有五原子环的化合物.四原子环在螯合物中是不常见的,六原子以上的环也是比较少的.中心离子有一定的电荷数,同时也有一定的配位数.Cu(Ⅱ)带有二个正电荷,它的配位数为4.氨基乙酸根离子(H2N-CH2-COO-)既有氨基氮,都能给出电子对;氨基氮能满足中心离子的配位数,羟基氧则能使配位数和电荷数同时得到满足,因此Cu 2+和两个(H2N-C H2-COO-)螯合后,得到的是中性分子二氨基乙酸合铜(Ⅱ)(简称氨基乙酸酮)[Cu(H 2N-CH2-COO)2]由于羟基氧带有负电荷,故它与Cu 2+形成的配键通常用"-"表示. 螯合物的特殊稳定性是环形结构带给它们的特征之一.环愈多使螯合物愈稳定.通常所说的"螯合反应"就是指由于螯合而使化合物具有特殊的稳定性.由于螯合物的特殊稳定性,已很少能反映金属离子在未螯合前的性质.金属离子在形成螯合物后,在颜色,氧化还原稳定性,溶解度及晶形等性质发生了巨大的变化.很多金属螯合物具有特征性的颜色,而且这些螯合物可以溶解于有机溶剂中.利用这些特点,可以进行沉淀,溶剂萃取分离,比色定量等分析分离工作.二,螯合剂常用的螯合剂是氨螯合剂,是一类似以氨基二乙酸[HN(CH2COOH)2]为基体的螯合剂,它以N,O为螯合原子,与金属离子螯合时形成环状的螯合物.最常用的氨羧螯合剂是EDTA(乙二胺四乙酸或其二钠盐的统称).它的结构是:乙二胺四乙酸是四元酸,如果用Y表示它的酸根,则乙二胺四乙酸可以简写成H4Y. 由于乙二胺四乙酸在水中的溶解度比较小,而其二钠盐在水中的溶解度却比较大.因些在实际应用中人们常采用EDTA二钠盐.EDTA二钠盐含有2分子结晶水,用简式Na2H2Y·2H2O表示它.EDTA是四元酸,它在水中是分步离解.除碱金属离子外,EDTA几乎能与所有的金属离子形成稳定的金属螯合物.并且,在一般情况下,不论金属离子是几价,1个金属离子都能与1个EDTA酸根(Y4-)形成可溶性的稳定螯合物.例如:式中M表示金属离子,右上角的数字和符号表示离子的离子价.虽然,除碱金属离子外,各金属离子大多数能与EDTA形成螯合物,但它们的稳定性差别很大.EDTA是应用最广的一种氨羧螯合剂,用EDTA标准液可以滴定几十种金属离子,这个方法就称EDTA滴定法.目前所谓螯合滴定法主要是指EDTA滴定.三,螯合物在医学上的应用螯合物在自然界存在得比较广泛,并且对生命现象有着重要的作用.例如,血红素就是一种含铁的螯合物,它在人体内起着送氧的作用.维生素B12是含钴的螯合物,对恶性贫血有防治作用.胰岛素是含锌的螯合物,对调节体内的物质代谢(尤其是糖类代谢)有重要作用.有些螯合剂可用作重金属(Pb2+, Pt2+,Cd2+,Hg2+)中毒的解毒剂.如二巯基丙醇或EDTA二钠盐等可治疗金属中毒.因为它们能和有毒金属离子形成稳定的螯合物,水溶性螯合物可以从肾脏排出. 有些药物本身就是螯合物.例如,有些用于治疗疾病的某些金属离子,因其毒性,刺激性,难吸收性等不适合临床应用,将它们变成螯合物后就可以降低其毒性和刺激性,帮助吸收.另外在生化检验,药物分析,环境监测等方面也经常用到螯合物.。

配 合 物【初赛要求】配合物。
路易斯酸碱。
配位键。
重要而常见的配合物的中心离子(原子)和重要而常见的配体(水、羟离子、卤离子、拟卤离子、氨、酸根离子、不饱和烃等)。
螯合物及螯合效应。
重要而常见的配络合剂及其重要而常见的配合反应。
配合反应与酸碱反应、沉淀反应、氧化还原反应的联系(定性说明)。
配合物几何构型和异构现象基本概念和基本事实。
配合物的杂化轨道理论。
用杂化轨道理论说明配合物的磁性和稳定性。
八面体配合物的晶体场理论说明Ti(H 2O)63+的颜色。
软硬酸碱的基本概念和重要软酸软碱和硬酸硬碱。
【初识配合物】无水的硫酸铜晶体(白色)溶于水得到天蓝色的溶液,蒸发浓缩冷却结晶,得到天蓝色的五水合硫酸铜晶体。
结构分析证实,无论水溶液还是晶体,天蓝色都是四水合铜离子[Cu(H 2O)4]2+的颜色。
向硫酸铜溶液滴加氨水,先产生含铜化合物的沉淀,继续滴加过量的氨水,沉淀溶解,得到深蓝色的透明溶液,若是浓溶液,蒸发结晶,可以得到深蓝色的四氨合硫酸铜晶体。
结构分析证实,无论在氨水溶液里还是在晶体里,深蓝色都是四氨合铜离子[Cu(NH 3)4]2+的颜色。
取少量硫酸四氨合铜晶体用水溶解后滴加浓盐酸,用过量浓盐酸,最后得到的是黄色透明溶液,结构分析证实,其中存在四氯合铜酸根[CuCl 4]2-。
这种离子在晶体里也存在。
我们把象[Cu(H 2O)4]2+、[Cu(NH 3)4]2+、[CuCl 4]2-这样的由金属原子与中性分子或者阴离子结合形成的复杂离子叫做配离子(过去叫络离子),其中的金属原子是配离子形成体或中心原子,其中的H 2O 、NH 3、Cl -离子等叫做配体。
第一单元 配合物的定义、组成、类型与命名1.配合物定义:是由可以给出孤对电子或多个不定域电子的一定数目的离子或分子(称为配体)和具有接受孤对电子或多个不定域电子的原子或离子(统称中心原子)按一定的组成和空间构型所形成的化合物。
例如:配合物:配盐:[Cu(NH 3)4]SO 4 [Cu(H 2O)4]SO 4.H 2O 配酸:H 2[PtCl 6]配碱:[Cu(NH 3)4](OH)2此外还有:配离子:[Cu(NH 3)4]2+ [Ag(CN)2]-配合分子:Ni(CO)4 [Co(NH 3)3Cl 3]等等。


配位化学讲义第十一章无机小分子配合物第十一章无机小分子配体配合物小分子配体的过渡金属配合物,已成为配位化学中发展最快的领域之一。
现已证实,小分子通过与过渡金属离子的配位而活化,进而可引起许多重要的反应。
第一节金属羰基(CO)配合物一、概述金属羰基配合物是过渡金属元素与CO所形成的一类配合物。
1890年,Mond和Langer发现Ni(CO)4,这是第一个金属羰基配合物。
常温、常压Ni(粉) + CO Ni(CO)4 (无色液体,m .p.= -25℃)150℃Ni(CO)4Ni + 4CO这成为一种提纯Ni的工艺。
现已知道,所有过渡金属至少能生成一种羰基配合物,其中金属原子处于低价(包括零价)状态。
二、类型1、单核羰基配合物这类化合物都是疏水液体或易挥发的固体,能不同程度地溶于非极性溶剂。
M-C-O键是直线型的。
例:V(CO)6 黑色结晶,真空升华V-C, 2.008(3) ÅCr(CO)6Cr-C, 1.94(4) ÅMo(CO)6无色晶体,真空升华,Mo-C, 2.06(2)Å 八面体W(CO)6W-C, 2.06(4)ÅFe(CO)5黄色液体,m.p.=20℃,Fe-C,1.810(3)Å(轴向)三角b.p.=103℃ 1.833(2)Å(赤道)双锥Ni(CO)4无色液体,m.p.= -25℃,Ni-C,1.84(4)Å四面体2、双核和多核金属羰基配合物多核羰基配合物可以是均核的,如:Fe3(CO)12;也可以是异核的,如MnRe(CO)10。
M在这类化合物中,不仅有M-C-O 基团, 而且还有O —C 和M-M 键,且M μ2-CO 常与M-M 键同时存在。
即: O —C 例:(1)Mn 2(CO)10为黄色固体,m.p.151℃,Mn-Mn=2.93Å OC CO OC COOC M M CO M=Mn 、Tc 、ReOC CO OC CO(2) Fe 2(CO)9 金色固体,m.p.100℃(分解),难挥发 OC CO COOC Fe Fe CO Fe 2(CO)9OC CO OC CO(3)Fe 3(CO)12 绿黑色固体,m.p.140-150℃(分解)OCCOFeO COCC OOC Fe C C Fe OCOCO CO CO COFe 3(CO)12(4)M 3(CO)12 M=Ru 、OsOCCOO COCC OOCC C OCO CO CO MMM*金属原子体积越大,越易形成非桥式结构。



配合物的化学式、命名原则一配体位次(“原则”10.25)1化学式“原则”在IUPAC1970规定一致,即:(1)“在配位个体中如既有无机配体又有有机配体,则无机配体排列在前,有机配体排列在后。
”例:cis-[PtCl2(Ph3P)2]。
因此,如[Cr(en)2Cl2]Cl,[Co(en)2(NO2)(Cl)]SCN,[Pt(en)CO3]等都不符合(1)。
(2) “无机配体和有机配体中,先列出阴离子,后列出阳离子和中性分子。
”例:K[PtCl3NH3],[Co(N3)(NH3)5]SO4。
因此如[Co(NH3)5Cl]Cl2,[Pt(NH3)2Cl2],[Co (NH3)5(CO3)]+, [Co(NH3)3(OH2)Cl2]+,[Co(en)2(NO2)(Cl)]+,[Pt(en)(NH3)(CO3)]等都不符合(2)或(1)和(2)以及“原则”10.3(见下文)。
(3) “同类配体的名称,按配位原子元素符号的英文字母顺序排列。
”例:[Co(NH3)5H2O]3+。
据此不能写成[CoH2O(NH3)5]3+。
(4) “同类配体中若配位原子相同,则将含较少原子数的配体排在前面,较多原子数的配体列后。
”例:[PtNO2NH3NH2OH(Py)]Cl。
因此,[Co(NH3)3(NO2)3]不符合(4)。
2命名配体命名的顺序,按“原则”示例可知,与配位个体中中心离(原)子后的配体书写顺序(化学式)完全一致;IUPAC的规则却不同,是按配体的英文名称词头字母(例中有底线者)的英文字母顺序命名,故与化学式的顺序不一致;日本则按阴离子配体、阳离子配体、中性分子配体的顺序命名[2],与我国的“原则”大体一致。
例:(1)K3[Fe(CN)6]六氰合铁(Ⅲ)酸钾(stock方法),六氰合铁酸(3-)钾(Ewen—Basett方法);potassium hexa cyanoferrate(Ⅲ)或potassium hexa cyanoferrate(3-)(英)以下仅用stock方法。
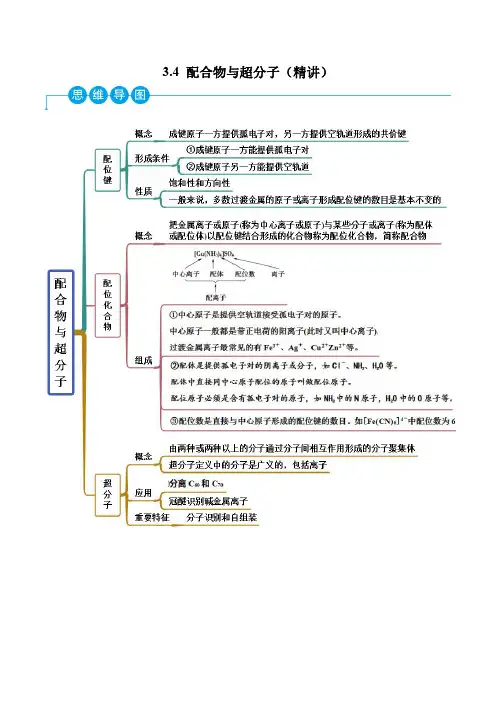
配合物知识点总结讲义一、概念配合物是指由一个或多个中性或带电的配体(通常为有机分子)与一个或多个金属离子(或原子)通过化学键结合而成的化合物。
配位化合物的形成是通过配体中的一个或多个孤对电子与金属中的空轨道形成化学键。
这种电子对与金属形成的键称为配位键,而形成的化合物称为配合物。
二、配位键配位键是指配体与金属中心之间的化学键。
配位键的形成是通过配位体中的孤对电子与金属中的空轨道形成的。
在配合物中,通常会形成多个配位键,形成多个配位键的配合物被称为多核配合物。
配位键的形成不仅是通过配位体中的孤对电子与金属中的空轨道形成的,还包括配体与金属形成的共价键。
共价键的形成主要取决于配体的受体能力和金属中心的给体能力。
受体能力越强的配体,形成的共价键就越强。
而给体能力越强的金属,形成的共价键也越强。
三、配合物的分类1. 根据配体的数量(1)单核配合物单核配合物是指一个金属中心与一个或多个配体通过化学键结合而成的配合物。
单核配合物是最常见的一种配合物。
例如[K4[Fe(CN)6],其中铁原子与6个氰根离子结合而成的配合物就是一个单核配合物。
(2)多核配合物多核配合物是指一个金属中心与两个或多个配体通过化学键结合而成的配合物。
多核配合物通常包含有金属中心与配体之间形成的金属-金属键。
例如[{Fe3(μ3-O)(μ-OH)(H2O)3}(NO3)6],其中三个铁原子通过氧原子形成金属-金属键,同时还与氢氧根离子以及水分子形成金属-配体键。
2. 根据配位键的类型(1)配位化合物配位化合物是指其中心金属原子或离子与一个或多个配体形成的配位键。
典型的配位化合物有氯化物、水合物等。
(2)离子配合物离子配合物是指其中心金属原子或离子与一个或多个离子形成的配位键。
典型的离子配合物有铁离子和硫离子形成的络合物等。
3. 根据配体的性质(1)有机配合物有机配合物是指其中心金属原子或离子与一个或多个有机配体形成的化合物。
例如以乙二胺为配体的金属配合物。
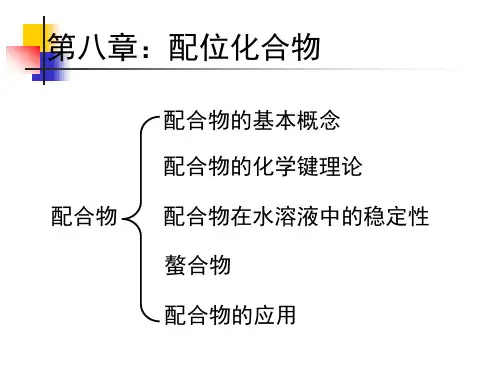
7配位化合物7.1 配位化合物的基本概念7.1.1 配合物的定义配位单元:由中心原子( 或离子) 和几个配体分子(或离子)以配位键相结合而形成的复杂离子(亦称配离子)或分子。
例:[Co(NH3)6]3+,[Cr(CN)6]3-,Ni(CO)4分别称作配阳离子、配阴离子、配位分子(即中性配位分子)。
配位化合物:凡是含有配位单元的化合物,简称配合物,也叫络合物。
如[Co(NH3)6]Cl3,K3[Cr(CN)6],Ni(CO)4注意:配合物和配离子通常不作严格区分,有时配离子也叫做配合物,故判断配合物的关键在于是否含有配位单元。
7.1.2 配合物的组成7.1.2.1 内界和外界(1)内界:配合物中配体和中心离子通过配位键结合,成为配合物的特征部分(在配合物化学式中以方括号表明),称为配合物的内界。
内界可以是配阳离子,也可以是配阴离子,还可以是中性分子。
(2)外界:与配离子带有异种电荷的方括号外的那部分称为外界,外界是简单离子。
如K3[Cr(CN)6] 之中,内界是[Cr(CN)6]3-,外界是K+。
注意:配合物可以无外界(如Ni(CO)4),但不能没有内界。
内界和外界之间以离子键结合,在水溶液中是完全电离的。
7.1.2.2 中心离子(或原子)中心离子(或原子)是配合物的核心部分,又称为配合物的形成体。
形成体可以是①金属离子(尤其是过渡金属离子),如[Cu(NH3)4]2+中的Cu2+;②中性原子,如Ni(CO)4,Fe(CO)5,Cr(CO)6中的Ni,Fe和Cr;③少数高氧化态的非金属元素,如[BF4]-,[SiF6]2-,[PF6]-中的B(Ⅲ)、Si(Ⅳ) 、P(Ⅴ)等。
7.1.2.3 配体、配位原子和配位数(1)配位体定义:在配合物中与中心离子结合的阴离子或中性分子,简称配体。
特征:①能提供孤对电子或不定域(或∏键)电子。
如[Cu(NH3)4]2+中的NH3;②能够提供∏键电子的配体如有机分子C2H4,乙二胺等。
(2)配位原子定义:配体中给出孤对电子与中心离子(或原子)直接形成配位键的原子。
常见的配位原子是N、C、O、S、F、Cl、Br、I等。
如果在一个配体中有两个原子都有孤对电子,其中电负性较小者为配位原子,如:C N:-中的C是配位原子。
分类:根据一个配体中所含配位原子数目的不同,可将配体分为单齿配体或多齿配体。
单齿配体:只含有一个配位原子的配体,如X-、NH3、CO、CN-等;多齿配体:含有两个或两个以上配位原子的配体。
例如乙二胺(∶NH2-CH2-CH2-H2N∶,用en表示)为双齿配体;乙二胺四乙酸(用EDTA表示,结构式见图7-1)为六齿配体,其中2个N,4个OH-中的O均可配位。
图7-1 乙二胺和乙二胺四乙酸的分子结构式(3)配位数定义:配位单元中,直接与中心离子(或原子)成键的配位原子的个数。
注意:配体的个数与配位数不是同一个概念。
对于单齿配位体的配合物,配位数等于配位体的总数;对于多齿配位体的配合物,配位数等于每种配体数目与该配体的配位原子数之积。
中心原子最常见的配位数为6、4和2,也有极少数的配位数为3、5、7、8等。
7.1.2.4 配离子的电荷配离子的电荷等于中心离子电荷和配位体总电荷的代数和。
现以[Cu(NH3)4]SO4和K4[Fe(CN)6]为例,以图表示配合物的组成关系如下。
图7-2 配合物的组成7.1.3 配合物的命名配合物的命名原则与一般无机化合物相同,所不同的只是对配离子的命名。
在配合物命名中先阴离子,后阳离子,阴阳离子之间加‘化’字或‘酸’字。
(1)配位阳离子的配合物若外界阴离子为简单离子的酸根(如Cl-),叫某化某,如[CrCl2(H2O) 4]Cl 一氯化二氯·四水合铬(Ⅲ);若外界阴离子为复杂离子的酸根(如SO42-),叫某酸某,如[Cu(NH3)4]SO4硫酸四氨合铜(Ⅱ);若外界阴离子为OH-离子,叫氢氧化某,如[Ag(NH3)2](OH) 氢氧化二氨合银(Ⅰ)。
(2)配位阴离子的配合物配位阴离子看成是酸根,如Cu2[SiF6] 叫六氟合硅( IV ) 酸亚铜;若外界为H+,在配位阴离子后加酸字,如H2[SiF6]叫六氟合硅( IV ) 酸。
在配位单元中,具体命名顺序为:配位体数—配位体名称—合—中心原子名称—中心原子氧化值加括号,用罗马数字注明。
(1)先配体后中心离子,配体与中心离子之间加‘合’字。
(2)配体前面用二、三、四……表示该配体个数。
(3)几种不同的配体之间加‘·’隔开。
(4)中心原子后面加括号,括号内写罗马数字(Ⅰ、Ⅱ…等)表示中心原子的氧化值。
(5)若配离子中的配体不止一种,在命名时配体的先后顺序按如下规定:1)先无机配体后有机配体2)先阴离子类配体,后分子类配体3)同类配体中,按配位原子的元素符号在英文字母表中的次序排4)某些配体具有相同的化学式,但由于配位原子不同而有不同的命名,例如:SCN- 硫氰根(S原子配位) NCS- 异硫氰根(N原子配位)-NO2- 硝基(N原子配位) ONO- 亚硝酸根(O原子配位)有些化合物还常用习惯名称或俗名,如K4[Fe(CN)6] 亚铁氰化钾俗称黄血盐;[Cu(NH3)4]2+铜氨离子K3[Fe(CN)6] 铁氰化钾俗称赤血盐;[Ag(NH3)2]+银氨离子7.2 配位化合物的价键理论1931年,鲍林将杂化轨道理论用于配合物结构中,用以说明配合物的化学键性质及空间构型,逐渐形成了价键理论。
价键理论认为,中心原子与配体是通过杂化了的共价配键结合的。
在形成配合物时,中心原子必须提供与配体孤电子对数相同的空轨道,接受配体提供的孤电子对,形成配位键(M←∶L,其中,M为中心原子或离子,L为配体)。
即中心原子空的杂化轨道同配位原子充满孤电子对的轨道相互重叠而形成配位键(这种配位键的本质是共价性的)。
中心原子杂化轨道类型决定配离子的空间构型和稳定性。
7.2.1 杂化轨道和配合物空间构型的关系7.2.1.1 sp杂化以[Ag(NH3)2]+ 为例:4d 5s5p sp杂化NH3NH3+Ag32[Ag(NH)]图7-3 [Ag(NH3)2]+配离子的形成sp杂化轨道的夹角为180°,空间伸展方向为直线形,配位数为2。
7.2.1.2 sp3杂化以[Zn(NH3)4] 2+ 为例:图7-4 [Zn(NH3)4] 2+配离子的形成sp3杂化轨道的夹角为109.5°,空间伸展方向指向正四面体的四个顶点,配离子的空间构型是正四面体,配位数为4。
7.2.1.3 dsp2杂化以[Ni(CN)4] 2- 为例:图7-5 [Ni(CN)4] 2-配离子的形成dsp2杂化轨道的键角为90°,配离子的空间构型是平面正方形,配位数为4。
7.2.1.4 sp3d2杂化以[FeF6] 3-为例:3d 4s 4p 4d3dsp 3d 2杂化F -F -F -F -F -F -Fe 3+[FeF 6]3-图7-6 [FeF 6] 3-配离子的形成以sp 3d 2杂化轨道形成的配离子为正八面体构型,配位数为6。
像F -配体不能使中心离子的价电子重排,这样的配体称为弱配体。
常见的弱配体有 F - 、Cl -、H 2O 等。
7.2.1.5 d 2sp 3杂化以[Fe(CN)6] 3- 为例:图7-7 [Fe(CN)6] 3-配离子的形成以d 2sp 3杂化轨道形成的配离子为正八面体构型,,配位数为6。
像CN - 配体使中心离子的价电子发生重排,这样的配体称为强配体。
常见的强配体有CO 、CN -、NO 2-等。
7.2.2 外轨型配合物和内轨型配合物中心原子使用空轨道接受配位体的孤对电子可有两种方式:外轨型配合物:如果中心原子不改变原有的电子层构型,提供的都是最外层轨道(ns 、np 、nd ),形成的配合物。
如采用sp 、sp 3、sp 3d 2杂化类型的配合物。
内轨型配合物:如果在形成配合物时,中心原子内层电子进行重排,改变了原来的电子层构型,腾出一部分次外层轨道[(n-1)d]参与杂化,形成的配合物。
如采用dsp 2、d 2sp 3杂化类型的配合物。
影响内、外轨型配合物形成的主要因素:一是配位原子的电负性。
电负性小的配位原子如CN -、CO 等强配体中的C ,易提供孤对电子,强迫中心离子的内层轨道电子发生重排,腾出能量低的空轨道,形成内轨型配合物;电负性大的配位原子如F -、H 2O 等弱配体中的F 和O ,不易提供孤对电子,对中心离子的内层轨道影响小,易形成外轨型配合物。
NH 3,Cl -等的配位原子电负性大小居中,则两类都有。
二是中心离子(电子构型、电荷)。
具有d 10构型的离子,如Zn 2+, Cd 2+, Hg 2+, Cu +, Ag +, Au + 无空(n-1)d 轨道,只能用外层轨道形成外轨型配合物;具有d 8构型的离子, 如Ni 2+、Pt 2+、Pb 2+,大多数情况下形成内轨型配合物;具有d 4~ d 7构型的离子,既可形成内轨型,也可形成外轨型配合物。
对于同一中心离子,外轨型配合物所用的杂化轨道比内轨型配合物的能量要高,形成的配位键的键能小,不稳定。
即内轨型配合物的稳定性比外轨型配合物的大。
7.2.3 价键理论的应用和局限性优点:简单明了,易于理解和接受,可以解释配离子的几何构型及某些化学性质和磁性等。
缺陷:不能定量地说明配合物的性质。
如不能解释配离子的颜色等。
7.3 配合物在水溶液中的性质—配位平衡7.3.1 配合物的不稳定常数与稳定常数7.3.1.1 配合物的不稳定常数以配合物[Cu(NH 3)4]SO 4为例,其离解分下列两种情况:[Cu(NH 3)4]SO 4→[Cu(NH 3)4]2++ SO 42- (1)强电解质的完全离解方式[Cu(NH 3)4]2+离解配位Cu 2+ +4NH 3 (2)弱电解质的部分离解方式(2)式离解反应(配位反应的逆反应)是可逆的,象这样配离子在一定条件下达到υ离解=υ配位的平衡状态,称为配离子的离解平衡,也称配位平衡。
它有固定的标准平衡常数,即:'2'43'234c (Cu ){c (NH )}K c ([Cu(NH )])++=不稳 K 不稳称为配离子不稳定常数或离解常数,也可用K d 表示。
K 不稳愈大表示离解反应进行程度愈大,配离子愈不稳定。
7.3.1.2 配合物的稳定常数配离子的生成反应如: Cu 2+ +4NH 3[Cu(NH 3)4]2+平衡常数为: '234'2'43c ([Cu(NH )])K c (Cu ){c (NH )}++=稳 K 稳称为配离子的稳定常数或生成常数,也可用β或f K 表示。
K 稳愈大表示配合反应进行程度愈大,配离子的稳定性愈大。