有机化学课件6.第六章芳烃
- 格式:pdf
- 大小:311.13 KB
- 文档页数:18










一、凯库勒构造式HI日一2歹、C —HIIIH —C 沁严匚一HIH苯的环状结构,即六个碳原子在同一平面上彼此连结成环,每个碳原子上都结合着一个氢原子。
为了满足碳的四价,凯库勒提出如下的构造式:二、闭合共轭体系近代物理方法测定,苯分子中的六个碳原子都是sp2杂化的,每个碳原子各以两个sp2杂化轨道分别与另外两个碳原子形成C-C 。
键,这样六个碳原子构成了一个平面正六边形。
使苯分子中的所有原子都在一个平面上,键角都是120°。
见图3-1(a)。
每个碳原子还有一个未参与杂化的p 轨道,它的对称轴垂直于此平面,与相邻的两个碳原子上的p 轨道分别从侧面平行重叠,形成一个闭合的共轭体系。
见图6-1(b)。
图6-1(a)苯的骨架图6-1(b)苯的环状共轭体系图6-1(c)苯的n 电子云 至今还没有更好的结构式表示苯的这种结构特点,出于习惯和解释问题的方便,仍用凯库勒式表示。
目前,为了描述苯分子中完全平均化的大n 键,也用下式表示苯的结构。
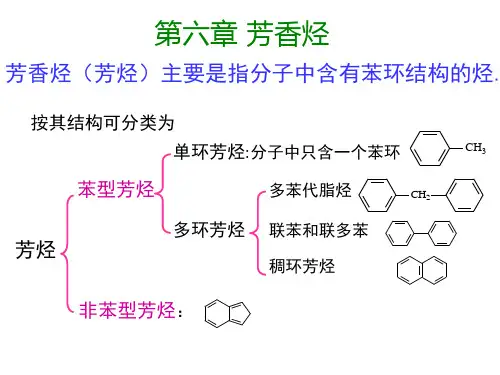
第二节单环芳烃的构造异构和命名第六章芳烃 第一节苯的结构或简写为1865年凯库勒(Kekule)首先提出了根据分子中所含苯环的数目和连接方式,芳香烃可分为如下几类:01单环芳烃例如:(苯)芳香烃多环芳烃例如: (联苯)稠环芳烃例如:(萘)一、单环芳烃的构造异构1.苯环上的支链不同,产生的构造异构当苯环上连有不同的支链时,产生异构现象。
如:当苯环支链有三个以上碳原子时,可能出现碳链排列方式不同,产生异构现象。
如:CH3CH2CH3丫咼X CH-CH3正丙苯异丙苯2.支链在环上的位置不同,产生的位置异构CH3衣屯当苯环上连有两个或两个以上支链时,可能出现支链在环上位置不同,产生异构现象。
如:邻二甲苯间二甲苯对二甲苯二、单环芳桂的命名1.苯的一元取代物只有一种时,以苯环为母体命名,烷基作取代基,称为“某烷基苯”,其中“基”字常省略。
若侧链为不饱和桂基(如烯基或烘基等),则以不饱和桂为母体命名,苯环作为取代基。
1CCCCCC
H
HHHH
H
苯成环
6C,6H等同
一种一取代碳四价
Kekule式
环己三烯
表示可用:也可用共振式的极限式:
+3H
2
H = -209 KJ/mol
+H2H = -120 KJ/mol
第六章 芳香烃 苯及化学性质类似于苯的烃称芳烃(Arene); 芳香烃不一定有芳香,但有芳香性。 6.1.苯的结构 1. 凯库勒式 凯库勒:
邻二取代应2种,但实际仅1种;Kekulé认为苯的双键不停地移动, 是互变的环己三烯:
Kekulé仅有共轭作用的朦胧想法,但他的环己三烯结构不能解释: 不饱和度很大的苯不能发生加成反应。
2.苯的稳定性和结构式
苯比Kekulé的环己三烯稳定 360 – 209 = 151 JK/mol (共振能) 近代仪器测试:6C、6H均同平面,∠CCC均为120°, C-C键介于单、双键之间,均为0.139nm。
碳均为sp2,形成闭环共轭的大π键。
CCCCCCHHHHHHCCCCCCHHHHHH 2苯胺NH2OHCHOCH2COOH aniline(common) phenol bezaldehyde phenyl acetic acid苯酚苯甲醛苯乙酸
CH3CH(CH3)2Br
NO
2
toluene(common) isopropylbenzene bromobenzene nitrobenzene
甲苯异丙苯溴苯硝基苯
邻二甲苯CH3
CH3
CH3
CH3
CH3H3CNO
2
Cl
o-xylene(common) m-xylene p-xylene m-nitrochlorobenzene间二甲苯对二甲苯间硝基氯苯
6.2.苯衍生物的命名 1. 一元取代 (1) 简单烷基、硝基、卤素,苯为母体:
(2) -NH2、-OH、-CHO、-COR、-COOH、CONR2等;苯作取代基: (3) 复杂烷基、烯基、炔基、一个以上苯基,苯作取代基:
2.二元取代 邻 o- (ortho) 1,2- 间 m- (meta) 1,3- 对 p- (para) 1,4-
(1)苯作母体时与一元取代类似:
2-甲基-3-苯基戊烷苯乙烯苯乙炔二苯甲烷CH=CH2CH3CHCHCH2CH3C6H5CH3CCHC6H5CH2C6H
5
2-methyl-3- styrene(common) phenylacetylene diphenylmethanephenylpentane 3
邻苯二甲酸COOHNH2COOHH2N o-benzenedicarboxylic acid p-benzenediamine对苯二胺
邻氨基苯甲酸COOHNH2
HOSO3HNH2
H3C
o-aminobenzoic acid m-aminophenol p-methylbenzene sulfonic acid间氨基苯酚对甲基苯磺酸
fastEπ-complexslowHHHE+σ-complex
fast
ESEArEH+
+
1,3,5-三甲基苯H3CCH3H3CBrH2NHO
COOH
HOCl2-氨基-4-溴苯酚3-羟基-2-氯苯甲酸
(2)有主官能团,苯与它一起作母体。 两基团相同:
两基团不同,选主官能团; 母体官能团次序:-COOH > -SO3H > -COOR > -CONH2 > -CN >
-CHO > -COR > -OH > -NH2
3.三元取代 与二元取代类似,需编号、选主官能团。
6.3.苯衍生物的化学性质 苯衍生物具有“特殊”的稳定性,苯环大π键不易加成和氧化,而环上氢易取代,该性质称芳香性(Aromaticity)。
1.亲电取代(Electrophilic Substitution) 4
HX+
X+ X2
X-X+ X
+ HX
硝酰正离子+HNO
3
H2SO4
50-60 oC
NO2
+ H2O
HONO2H2SO4NO2 + H2O
..
FeX3XX
X+ FeX
4
Ph-F, Ph-IPh-N
2
F2,I2,反应性低;
(1)卤化(Halogenation)
(2)硝化(Nitration)
硝基苯比苯难,烷基苯比苯易:
+Cl2
FeCl3
Cl
+HCl
+Br2
FeBr3
Br
+HBr
+HNO3(fume)
H2SO4
100 oC
NO2
NO
2
NO2
+HNO
3
H2SO4
30 oC
CH3
CH
3NO2+
CH3
NO2 5
PhH + SO3
Ph
PhSO3HH
SO3
+ H2SO4
SO3H+ H2O
+ RClAlCl3
R
Mechanism:R-Cl + AlCl3R + AlCl4
R+H
RHR
(3)磺化(Sulfonation)
SO3, H
+
均易离去,
是可逆反应。
蒸去水,平衡右移;蒸去苯,平衡左移。 磺酸基可作保护基:
(4)付-克反应 a. Friedel-Crafts alkylation
+ H2SO4(concetrated)SO3H+ H2O
+ SO3
HSO3+
HSO3SO3H
H
H3C1. H2SO4
2. Cl2, Fe
3. H3O
H3C
Cl 6+ RCClAlCl3
CR
Mechanism:RC-Cl + AlCl3RC + AlCl4
+HCORHCOROOOORCO
+(CH3)3CCH2OH
BF3CCH2CH
3
CH3
CH3
+H
OAlCl3
1,2-C shift
缺点:伯卤烷易重排;易形成多烷基苯;苯环连吸电子基不反应。 其它产生C+的也可作烷基化试剂:
b. Friedel-Crafts acylation
例:
优点:无重排、无多取代。 HNO3
H2SO4
CH2CH2CH2CH3
CH3CH2CH2COCl COCH2CH2CH3
TMAlCl3
CH2CH2CH2CH3
Zn-Hg
HCl
NO2
PhH+ClCH2CH2FAlBr3PhCH2CH2Cl
3Ph-H+CHCl3
AlCl3Ph3CH
PhH+CH3CH2CH2ClAlCl3PhCH(CH3)21,2-Hshift
PhH+(CH3)2CHCH2Cl
AlCl3PhC(CH3)
3
R-:3o>2o>1o;X-:F->Cl>Br>I 7 (5)氯甲基化反应
2.加成反应 特殊条件下:
3.侧链的反应 (1)卤代
+ 3H2
Pt
+ 3Cl2
Pt
ClClClClClCl
CH2ClMechanism:H2CO++ HClZnCl
2
H2COHH2COHH2COHPh-HHCH2OHH2COH2CH2H2O
ClCH2Cl
NaNH3(l), EtOH
Mechanism:e (NH3)...
EtOH
.
HH1. e (NH3)2. EtOHHH
HH电子与负电荷应远离。
NaNH3(l), EtOH
CH2CH3CH2CH3
负电荷不在推电子基上。区域选择性
例:
Birch反应:对位加氢