实验十六、丙二酸对琥珀酸脱氢酶的竞争性抑制作用
- 格式:doc
- 大小:48.00 KB
- 文档页数:2

实验四酶的竞争性抑制作用〔琥珀酸脱氢酶〕【目的】证明组织中有琥珀酸脱氢酶活性以及丙二酸对此酶有竞争性抑制作用。
【原理】在化学结构上与底物类似的抑制,能与底物竞争和酶分子的活性中心结合,抑制酶的活性。
其抑制的程度随抑制剂与底物两者浓度的比例而定。
如果底物浓度不变,酶活性的抑制程度随抑制剂的浓度增加。
反之,假设抑制的浓度不变那么酶活性随底物浓度的增加而逐渐恢复,这种类型的抑制称之竞争性抑制。
草酸、丙二酸等与琥珀酸的结构相似,能竞争性抑制琥珀酸脱氢酶的活性。
琥珀酸脱氢酶属于黄素酶类脱氢酶,其作用是催化琥珀酸〔即丁二酸〕脱氢氧化成延胡索酸〔即反丁烯二酸〕。
在生理情况下,脱下的氢可经呼吸链的传递,最后与氧结合成水,并释放出能量。
但在体外可用甲烯蓝〔蓝色〕作为氢受体,接受琥珀酸脱下的氢而被复原成甲烯白〔白色〕。
借其颜色的消退可鉴定琥珀酸脱氢酶的作用。
且可通过其颜色消退的快慢来观察该酶活性的抑制程度。
根据这一原理,通过本实验观察草酸对琥珀酸脱氢酶活性的影响。
【实验仪器与材料】1.pH7.4磷酸缓冲液;2.0.25%琥珀酸钠溶液;3.5%草酸钠溶液;4.0.01%甲烯蓝溶液。
【实验步骤】1.肝糜液的制备。
取小白鼠一只,断头处死,立即剖腹将肝脏全部取出,置于一研钵中,参加玻璃砂少许,充分研碎至糊状,参加pH7.4的磷酸缓冲液7ml,搅匀后倒入一圆底离心管中,离心约2min 〔3000r/min〕,将上清液倒于另一试管中备用。
此即为含有琥珀酸脱氧酶的肝糜液。
2.另取中试管5支,标号,按表4-4操作。
摇匀,静置的37℃的水浴中〔此后勿再摇动!〕,注意观察各管的颜色变化,并记录各管颜色消退的顺序和时间,并分析之。
【实验结果】【结果分析】【思考题】1.丙二酸对琥珀酸脱氢酶的抑制作用属于哪一种?结合实验结果给以解释。
2.本实验中的第3支试管有何意义?实验日期成绩指导老师。

实验十琥珀酸脱氢酶的作用及其竞争性抑制一、实验目的1、掌握竞争性抑制概念及作用机理。
2、了解在无氧情况下观察脱氢酶作用的简单方法。
二、实验原理存在于心肌、骨骼肌、肝脏等组织中琥珀酸脱氨酸,能使琥珀酸脱氢而成延胡索酸,脱下氢可使甲烯蓝退色,还原为甲稀白。
反应如下:草酸、丙二酸等在结构上与琥珀酸相似,可与琥珀酸竞争与琥珀酸脱氢酸的活性中心结合。
若酶已与丙二酸等结合,则不能再与琥珀酸结合而使之脱氢,产生抑制作用,且抑制程度取决于琥珀酸与抑制剂在反应体系中浓度的相对比例,所以这种抑制是竞争性抑制。
本实验通过观察在由不同浓度的琥珀酸与丙二酸组成的反应体系中使等量甲稀蓝退色反应时间,从而验证丙二酸对琥珀酸的竞争性抑制作用。
这样,便可以显示琥珀酸脱氢酶的作用。
三、实验仪器、材料和试剂1、仪器:恒温水浴锅,研钵或组织匀浆机2、材料和试剂(1)新鲜兔肝(2) 0、10mol/L磷酸盐缓冲液(pH7、4):0、1mol/L NaH2PO419 ml 加0、1mol/LNa2HPO481ml。
(3)0、093 mol/L琥珀酸钠溶液:取琥珀酸钠1、5g溶于100 ml蒸馏水中。
(4)0、10 mol/L丙二酸钠溶液:取丙二酸钠1、5g溶于100 ml蒸馏水中。
(5)0、02%甲稀蓝溶液。
(6)液体石蜡。
四、实验操作新鲜兔肝立即剪碎,放于组织匀浆机中研碎,加入pH7、4的0、10 mol/L磷酸盐缓冲液,制备成200 g/L的肝匀浆液备用。
取五支试管分别编号,按下表配制反应体系:试剂管号0、093 mol/l琥珀酸钠0、10 mol/l丙二酸钠0、10mol/l(pH7、4)磷酸缓冲液肝匀浆液0、02%甲烯蓝11ml2ml1ml3滴21、5ml0、5ml1ml1ml3滴31ml1ml2ml3滴42ml1ml1ml3滴51ml1ml1ml1ml3滴将各管溶液混匀后加一薄层液体石蜡后静置(此时不可摇动!),观察各管中的颜色变化,并记录各管颜色完全变化的时间。
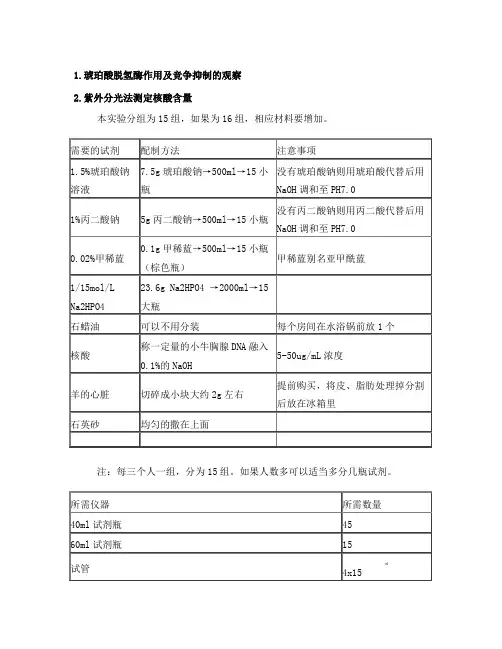
1.琥珀酸脱氢酶作用及竞争抑制的观察2.紫外分光法测定核酸含量本实验分组为15组,如果为16组,相应材料要增加。
需要的试剂配制方法注意事项1.5%琥珀酸钠溶液7.5g琥珀酸钠→500ml→15小瓶没有琥珀酸钠则用琥珀酸代替后用NaOH调和至PH7.01%丙二酸钠5g丙二酸钠→500ml→15小瓶没有丙二酸钠则用丙二酸代替后用NaOH调和至PH7.00.02%甲稀蓝0.1g甲稀蓝→500ml→15小瓶(棕色瓶)甲稀蓝别名亚甲酰蓝1/15mol/L Na2HPO4 23.6g Na2HPO4 →2000ml→15大瓶石蜡油可以不用分装每个房间在水浴锅前放1个核酸称一定量的小牛胸腺DNA融入0.1%的NaOH5-50ug/mL浓度羊的心脏切碎成小块大约2g左右提前购买,将皮、脂肪处理掉分割后放在冰箱里石英砂均匀的撒在上面注:每三个人一组,分为15组。
如果人数多可以适当多分几瓶试剂。
所需仪器所需数量40ml试剂瓶4560ml试剂瓶15试管4x152x15 共90个移液管(优先10ml的本次用5ml移液管)15研钵15种类数量心脏提取液151.5%琥珀酸钠151%丙二酸钠150.02%甲稀蓝15蒸馏水15液体石蜡 2胶头滴管共77个紫外吸收法测定核酸含量1、实验目的:1.掌握紫外吸收法测定核酸含量的原理2.掌握利用紫外线分光度计测定核酸含量二、实验原理:DNA和RNA都有吸收紫外线的性质,最大吸收峰在260nm波长处紫外线吸收是嘌呤、嘧啶碱基具有共轭双健系统(-C=C一C=C 一),能够强烈吸收250~280nm 波长的紫外光。
等书上112页三、实验试剂与器材DNA样品紫外分光光度计四、实验步骤1.取DNA样品5ml,于紫外分光光度计上测定260nm与280nm处的OD值按下式按下式计算核酸浓度计算核酸浓度 DNA的质量浓度(mg/l)=OD260nm/0.020xL x稀释倍数计算核酸纯度=OD260nm/OD280nm2.取DNA样品5ml,沸水浴中加热5min于紫外分光光度计上,测260nm处的OD值比较DNA前后吸光度OD的差异。
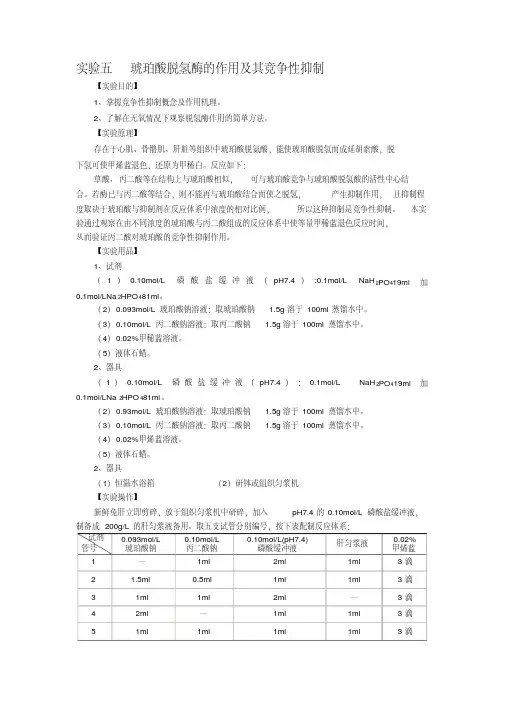
实验五琥珀酸脱氢酶的作用及其竞争性抑制【实验目的】1、掌握竞争性抑制概念及作用机理。
2、了解在无氧情况下观察脱氢酶作用的简单方法。
【实验原理】存在于心肌、骨骼肌、肝脏等组织中琥珀酸脱氨酸,能使琥珀酸脱氢而成延胡索酸,脱下氢可使甲烯蓝退色,还原为甲稀白。
反应如下:草酸、丙二酸等在结构上与琥珀酸相似,可与琥珀酸竞争与琥珀酸脱氢酸的活性中心结合。
若酶已与丙二酸等结合,则不能再与琥珀酸结合而使之脱氢,产生抑制作用,且抑制程度取决于琥珀酸与抑制剂在反应体系中浓度的相对比例,所以这种抑制是竞争性抑制。
本实验通过观察在由不同浓度的琥珀酸与丙二酸组成的反应体系中使等量甲稀蓝退色反应时间,从而验证丙二酸对琥珀酸的竞争性抑制作用。
【实验用品】1、试剂(1)0.10mol/L磷酸盐缓冲液(pH7.4):0.1mol/L NaH2PO419ml 加0.1mol/LNa2HPO481ml。
(2)0.093mol/L琥珀酸钠溶液:取琥珀酸钠 1.5g溶于100ml蒸馏水中。
(3)0.10mol/L丙二酸钠溶液:取丙二酸钠 1.5g溶于100ml蒸馏水中。
(4)0.02%甲稀蓝溶液。
(5)液体石蜡。
2、器具(1)0.10mol/L磷酸盐缓冲液(pH7.4):0.1mol/L NaH2PO419ml加0.1mol/LNa2HPO481ml。
(2)0.93mol/L琥珀酸钠溶液:取琥珀酸钠 1.5g溶于100ml蒸馏水中。
(3)0.10mol/L丙二酸钠溶液:取丙二酸钠 1.5g溶于100ml蒸馏水中。
(4)0.02%甲烯蓝溶液。
(5)液体石蜡。
2、器具(1)恒温水浴箱(2)研钵或组织匀浆机【实验操作】新鲜免肝立即剪碎,放于组织匀浆机中研碎,加入pH7.4的0.10mol/L磷酸盐缓冲液,制备成200g/L的肝匀浆液备用。
取五支试管分别编号,按下表配制反应体系:试剂管号0.093mol/L琥珀酸钠0.10mol/L丙二酸钠0.10mol/L(pH7.4)磷酸缓冲液肝匀浆液0.02%甲烯蓝1 —1ml 2ml 1ml 3滴2 1.5ml 0.5ml 1ml 1ml 3滴3 1ml 1ml 2ml —3滴4 2ml —1ml 1ml 3滴5 1ml 1ml 1ml 1ml 3滴将各管溶液混匀后加一薄层液体石蜡后静置(此时不可摇动!),观察各管中的颜色变化,并记录各管颜色完全变化的时间。

实验三琥珀酸脱氢酶的作用及其竞争性抑制的观察一、基本原理脱氢酶的作用在于激活并脱下底物上的氢,使之通过一系列传递体最后传给氧而生成水。
在缺氧的条件下,适当的受氢体也可接受脱氢酶从底物上脱下的氢。
因此,选用适当的受氢体便可以观察到脱氢酶的作用。
琥珀酸脱氢酶能使琥珀酸脱氢生成延胡索酸,并将脱下的氢交给受氢体。
当在缺氧的条件下用甲烯蓝(美蓝,蓝色物质)作为受氢体时,甲烯蓝被氢还原生成甲烯白(美白,无色物质),其反应如下:CH2—COOH 琥珀酸脱氢酶HC—COOH| + MB ——————→‖+ MB·2HCH2—COOH 无氧条件HOOC—CH琥珀酸甲烯蓝(兰色)延胡索酸甲烯白(无色)根据这种蓝色转变为无色的变化过程,就可以判断出琥珀酸脱氢酶起了催化作用。
丙二酸的结构与琥珀酸相似,可与琥珀酸竞相结合琥珀酸脱氢酶的活性中心,从而抑制该酶的活性,是琥珀酸脱氢酶的竞争性抑制剂。
这种抑制作用即属酶的竞争性抑制作用。
试剂及器材二、试剂及器材1.1.5% (w/v)琥珀酸钠溶液: 2.1% (w/v)丙二酸钠溶液:3. 0.02% (w/v)甲烯蓝溶液4. 1/15mol/L Na2HPO4溶液:5. 液体石蜡油6 手术剪,镊子7.研钵,净细砂8.恒温水浴锅, 酒精灯9.离心机及离心管10. 刻度吸管和滴管三、操作步骤1.猪心脏提取液的制备:(1)称取新鲜猪心脏1.5—2g放置研钵中剪碎;(2)加入等体积的净细砂1/15mol/LNa2HPO4溶液3—4 ml,然后将之研磨成匀浆;(3)再加入1/15mol/L Na2HPO4溶液6—7ml,放置30min,不时摇动;(4)于2000rpm离心10min,取上清备用。
2.取4支试管,按下表编号操作:2_52010421555103225_55(煮沸)2225_5510.02% 甲烯蓝(滴)蒸馏水(滴)1%丙二酸钠(滴)1.5%琥珀酸(滴)心脏提取液(滴)试管号3.加好试剂后混匀,然后立即在各试管中加入一层(约5-10滴)液体石蜡油。

实验五琥珀酸脱氢酶的作用及其竞争性抑制【实验目的】1、掌握竞争性抑制概念及作用机理。
2、了解在无氧情况下观察脱氢酶作用的简单方法。
【实验原理】存在于心肌、骨骼肌、肝脏等组织中琥珀酸脱氨酸,能使琥珀酸脱氢而成延胡索酸,脱下氢可使甲烯蓝退色,还原为甲稀白。
反应如下:草酸、丙二酸等在结构上与琥珀酸相似,可与琥珀酸竞争与琥珀酸脱氢酸的活性中心结合。
若酶已与丙二酸等结合,则不能再与琥珀酸结合而使之脱氢,产生抑制作用,且抑制程度取决于琥珀酸与抑制剂在反应体系中浓度的相对比例,所以这种抑制是竞争性抑制。
本实验通过观察在由不同浓度的琥珀酸与丙二酸组成的反应体系中使等量甲稀蓝退色反应时间,从而验证丙二酸对琥珀酸的竞争性抑制作用。
【实验用品】1、试剂(1)0.10mol/L磷酸盐缓冲液(pH7.4):0.1mol/L NaH2PO419ml 加 0.1mol/LNa2HPO481ml。
(2)0.093mol/L琥珀酸钠溶液:取琥珀酸钠1.5g溶于100ml蒸馏水中。
(3)0.10mol/L丙二酸钠溶液:取丙二酸钠1.5g溶于100ml蒸馏水中。
(4)0.02%甲稀蓝溶液。
(5)液体石蜡。
2、器具(1)0.10mol/L磷酸盐缓冲液(pH7.4):0.1mol/L NaH2PO419ml加0.1mol/LNa2HPO481ml。
(2)0.93mol/L琥珀酸钠溶液:取琥珀酸钠1.5g溶于100ml蒸馏水中。
(3)0.10mol/L丙二酸钠溶液:取丙二酸钠1.5g溶于100ml蒸馏水中。
(4)0.02%甲烯蓝溶液。
(5)液体石蜡。
2、器具(1)恒温水浴箱(2)研钵或组织匀浆机【实验操作】新鲜免肝立即剪碎,放于组织匀浆机中研碎,加入pH7.4的0.10mol/L磷酸盐缓冲液,1—1ml2ml1ml3滴2 1.5ml0.5ml1ml1ml3滴31ml1ml2ml—3滴42ml—1ml1ml3滴51ml1ml1ml1ml3滴将各管溶液混匀后加一薄层液体石蜡后静置(此时不可摇动!),观察各管中的颜色变化,并记录各管颜色完全变化的时间。
实验十六:丙二酸对琥珀酸脱氢酶的竞争性抑制作用
【实验名称】:丙二酸对琥珀酸脱氢酶的竞争性抑制作用
09救援一班第三大组李岚宇2009222336
室温:25℃
(一)实验目的:1、学习和掌握竞争性抑制作用的特点。
2、观察丙二酸对琥珀酸脱氢酶的竞争性抑制作用。
(二)实验原理:化学结构与酶作用的底物结构相似的物质,可与底物竞争结合酶的活性中心,使酶的活性降低甚至丧失,这种抑制作用称为竞争性抑制作用。
琥珀酸脱氢酶是机体内参与三羧酸循环的一种重要的脱氢酶,其辅基为FAD,如心肌中的琥珀酸脱氢酶在缺氧的情况下,可使琥珀酸脱氢生成延胡索酸,脱下之氢可将蓝色的甲烯蓝还原成无色的甲烯白。
这样,便可以显示琥珀酸脱氢酶的作用。
丙二酸的化学结构与琥珀酸相似,它能与琥珀酸竞争而和琥珀酸脱氢酶结合。
若琥珀酸脱氢酶已与丙二酸结合,则不能再催化琥珀酸脱氢,这种现象称为竞争性抑制。
如相对地增加琥珀酸的浓度,则可减轻丙二酸的抑制作用。
(三)实验材料与仪器:
1器材大白鼠、手术剪、镊子、磁盘、匀浆器、量筒、烧杯、纱布、滤纸、试管及试管架、恒温水箱、电热水浴锅
2试剂0.2mol/L琥珀酸溶液、0.02mol/L琥珀酸溶液、0.2mol/L丙二酸溶液、0.02mol/L 丙二酸溶液、1/15mol/L磷酸缓冲液、0.02%甲烯蓝、液体石蜡。
(四)实验步骤:
1、酶提取液的制备:去大白鼠的肝脏、心脏、肾脏,用冷水洗3次,加入1/15mol/L磷酸缓冲液pH 在7.4。
在匀浆器中进行匀浆,然后用纱布过滤,用干净的烧杯收集过滤的备用。
2、取试管6支,编号,在按图步骤操作,
酶提取液(ml)磷酸
缓冲
液
(ml)
0.2mol/L
琥珀酸
(滴)
0.02mol/
L琥珀酸
(滴)
0.2mol/L
丙二酸溶
液(滴)
0.02mol/L
丙二酸溶液
(滴)
蒸馏
水
(滴)
甲烯
蓝
(滴
)
褪色时间
(分钟)
试管1 2 - 8 - - - 8 3 3分33秒试管2 2 - 8 - - 8 - 3 5分30秒试管3 2 - 8 - 8 - - 3 6分04秒试管4 2 - - 8 8 - - 3 7分28秒试管5 - 2 8 - - - 8 3 无限大试管6 2 - 8 - - - 8 3 无限大试管6,在酶提取液先在100℃的水浴加热煮沸5min。
各管溶液立即混均匀,沿试管壁加入液体石蜡,约0.5cm,各管置于37℃的水浴中保温,切勿摇动试管,随时观察比较各试管颜色的变化,记录褪色时间。
(五)实验结果记录:
表1
(六)实验讨论:
1、酶提取液中有琥珀酸脱氢酶活性,表1所示,在试管1中没有抑制剂,但琥珀酸依然能脱氢,使得甲烯蓝反应得甲烯白。
2、各管的褪色有明显的时间差别,褪色时间随[I]/[S]逐渐增大,而增大。
3、丙二酸对琥珀酸脱氢酶抑制作用的类型是竞争性抑制,其特点:最大反应速率Vmax不变,米氏常数Km增大,竞争性抑制可以通过增大底物浓度来减轻抑制程度。
4、本实验中5号、6号试管的作用是做对照,5号试管和1号试管做对照,说明酶提取液中有琥珀酸脱氢酶的存在,6号试管中的酶提取液在100℃的水浴加热煮沸过,所以琥珀酸脱氢酶是失活的。
【注意事项】:
1、酶提取液的制备应操作迅速,以防止酶活性降低。
2、加入液体石蜡的作用是隔绝空气,以避免空气中的氧气对实验造成影响,因此加石蜡时试管壁要倾斜,注意不要产生气泡。
3、37℃水浴保温过程中,不能摇动试管,避免空气中的氧气接触反应溶液,使得还原型的甲烯白重新氧化成蓝色。
4.、37℃水浴保温过程中,要注意随时观察各试管的褪色情况。
5、实验结果结束后,一定要洗干净试管内的液体石蜡。
2010年10月9号。