大鼠抗酒石酸酸性磷酸酶 (TRAP))说明书活性
- 格式:doc
- 大小:122.50 KB
- 文档页数:8

骨标记物临床意义一、骨标记物的概述骨标记物是一类反映骨代谢和骨形成过程的生物标志物,其在临床诊断、病情监测和治疗评估等方面具有重要价值。
骨标记物可以分为以下两类:1.骨形成标志物:如骨钙素(BGP)、Ⅰ型胶原羧基端前肽(P1NP)等,它们在骨形成过程中起到关键作用,水平升高表明骨形成活跃。
2.骨吸收标志物:如抗酒石酸盐酸性磷酸酶(TRAP)、钙离子浓度等,它们与骨吸收过程密切相关,水平升高提示骨吸收增加。
二、骨标记物的临床应用骨标记物在临床应用中主要包括以下方面:1.诊断骨质疏松症:通过检测骨形成和骨吸收标志物,有助于评估患者骨质疏松症的风险和发展程度。
2.评估骨折风险:骨标记物水平低下时,提示骨折风险增加,需采取相应预防措施。
3.监测骨代谢性疾病:如甲状旁腺功能亢进症、骨代谢异常等,骨标记物检测有助于病情监测和治疗效果评估。
4.评估骨移植和骨科手术效果:骨标记物水平的变化可作为评估骨移植和骨科手术疗效的指标。
三、常见骨标记物的临床意义1.钙离子浓度:钙离子是骨形成和骨吸收的关键调节因子,其浓度变化反映骨代谢状态。
2.骨碱性磷酸酶(BALP):主要来源于成骨细胞,活性升高表明骨形成活跃。
3.骨钙素(BGP):由骨细胞分泌,水平升高提示骨形成增加。
4.Ⅰ型胶原羧基端前肽(P1NP)和Ⅰ型胶原羧基端肽(PYD):为骨胶原降解产物,水平升高表示骨形成增加。
5.抗酒石酸盐酸性磷酸酶(TRAP):来源于破骨细胞,活性升高提示骨吸收增加。
四、骨标记物在临床应用中的注意事项1.骨标记物的检测方法:采用酶联免疫吸附法(ELISA)等方法进行检测。
2.结果的解释和评估:需结合患者年龄、性别、骨密度等相关因素,综合分析骨标记物水平。
3.与其他检测方法的结合应用:如双能X线吸收法、骨密度测量等,以获得更全面的诊断依据。
五、未来发展趋势与展望1.新型骨标记物的研发:随着科学技术的进步,新型骨标记物将不断涌现,为临床诊断提供更多依据。

抗酒石酸酸性磷酸酶5b(TRACP 5b)定量测定一、简介和用途、适用范围大量的抗酒石酸酸性磷酸酶(TRACP)是由骨吸收的破骨细胞和有活力的巨噬细胞所释放的。
在血液循环中的TRACP有TRACP 5b 和TRACP 5a二种形式, TRACP 5b 来源于破骨细胞,而TRACP 5a来源于巨噬细胞。
由破骨细胞刚分泌到血液中的TRACP 5b是有活性的酶,但当TRACP 5b在血液循环中被清除之前已无活性,并被降解为碎片。
这样TRACP 5b不会因肝、肾功能受损而在血液中积蓄。
血清中TRACP 5b均来源于破骨细胞,此酶在昼夜的活性水平变化不明显,且不受进食的影响,故可在一天的任何时候都可以采集标本进行检验。
此试剂盒依据测定由破骨细胞释放的TRACP 5b的特异性测定方法。
它可以用于测定骨吸收亢进的病人,如原发性骨质疏松和肾性骨病,也可以预测骨折的危险性,并便于了解抗骨吸收治疗的效果。
在肿瘤病人中,当TRACP 5b 的活力增高提示肿瘤骨转移。
在体外,培养基中TRACP 5b的活力大小代表了破骨细胞数量的多少,因此应用于此试剂盒在进行人的破骨细胞培养时,可用于检测破骨细胞的数量。
二、试验原理测试孔内已包被抗TRACP单克隆抗体→加入校准液、质控品和样品→加入释放剂→有活性的TRACP 5b从结合蛋白质上离解→TRACP 5b与孔内包被的抗TRACP单克隆抗体结合→加入底物pNPP孵育→加入终止液终止反应→在酶标仪上检测结果。
此试验的优点1、所测定的TRACP 5b是由破骨细胞专一释放的。
2、此试验对TRACP 5a或其它磷酸酶没有干扰。
3、溶血不影响结果。
4、不受昼夜变化的影响。
5、不受肝脏、肾脏疾病的影响。
6、不受进食的影响。
7、酶标板容易拆卸,方便检测。
三、试剂盒(一)组成1、酶标板:96孔,已包被抗—TRACP抗体。
2、质控液:3×0.5ml。
3、校准液:3×0.5ml(3×1U/L,3×5U/L,3×10U/L)。

钙磷对体外培养大鼠破骨细胞的影响顾建红1,刘俊栋1,2,翟必华1,3,刘学忠1,卞建春1,刘宗平1*(1. 扬州大学兽医学院,扬州 225009;2. 江苏畜牧兽医职业技术学院,泰州 225300;3.福建进出口检验检疫局,福州 350001)摘要:通过成骨细胞(osteoblast, OB)与脾细胞共培养在体外诱导脾细胞转化为破骨细胞(Osteoclasts, OC),转化过程中分别加入5 mmol/L、3 mmol/L的钙(Calcium, Ca)或磷(Phosphorus, P)及不同浓度比例的钙磷,对照不添加钙磷因子。
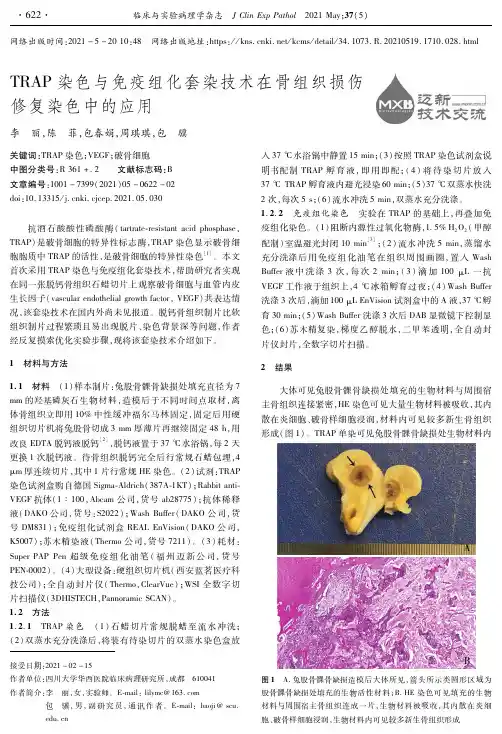
采用形态学观察、抗酒石酸酸性磷酸酶(TRAP)染色计数、扫描电镜观察象牙片吸收陷窝,研究钙磷因子作用下OC的生成和活化。
结果表明,培养液中Ca、P浓度分别为3 mmol/L及5 mmol/L 对OC的生成及活化均有显著抑制作用(P<0.05),5 mmol/L Ca与对照组比较差异极显著(P<0.01)。
Ca:P 为2:1组对OC生成和活化的抑制作用最强。
认为钙磷通过抑制OC生成和活化,从而抑制OC的骨吸收活性。
关键词:破骨细胞;磷;钙;抗酒石酸酸性磷酸酶;吸收陷窝Effects of calcium and phosphoruson Rat’s osteoclasts formation and activationGu Jianhong 1, Liu Jundong1,2, Zhai Bihua1,3, Liu Xuezhong1,Bian Jianchun1, Liu Zongping1*(1. College of Veterinary Medicine, Yangzhou University, Jiangsu, Yangzhou 225009, China;2. Jiangsu Animal Husbandry & Veterinary College, Jiangsu, Taizhou 225300, China;3. Fujian Entry-Exit Inspection and Quarantine Bureau, Fuzhou 350001, China)Abstract: Osteoclasts were obtained by a co-culture system with rat spleen cells and osteoblasts. In the conversion process, different strengths of calcium, phosphorus and different concentration ratios of calcium to phosphorus were added to the co-culture system. The formation and activation of osteoclasts was detected by morphologic observation, histochemical staining for tartrate-resistant acid phosphatase (TRAP) and detection of lacunar resorption through scanning electron micrograph. The formation and activation of osteoclasts were inhibited by high concentration of calcium and phosphorus (p<0.05). Compared with control, the difference of high concentration group was very significant. Moreover, osteoclasts formation and activation were inhibited by the ratio of calcium to phosphorus (2:1) mostly. Calcium and Phosphorus inhibit bone absorbing activity by inhibiting formation and activation of osteoclasts.Keyword: osteoclast; phosphorus; calcium; tartrate-resistant acid phosphatase; lacunar resorption 钙、磷或维生素D代谢紊乱是引起动物骨营养不良的主要原因。

中医不同治法对骨质疏松症大鼠抗酒石酸酸性磷酸酶含量影响的比较研究杨芳;朱辉;郑洪新;王剑;林庶茹【摘要】目的观察中医不同治法对糖皮质激素诱导骨质疏松症大鼠骨抗酒石酸酸性磷酸酶含量的影响,探讨中医防治骨质疏松症的作用机制.方法将120只雌雄各半的大鼠随机分为正常对照组、模型对照组、补肾中药组、健脾中药组、活血化瘀中药组和骨疏康中药组6个组,用地塞米松肌注造模.实验结束后,腹主动脉取血处死大鼠,用酶联免疫法检测各组大鼠血清抗酒石酸酸性磷酸酶的含量.结果与正常组比较,模型组大鼠血清TRACP含量升高极为显著(P<0.01);与模型组比较,各治疗组大鼠血清TRACP含量均明显降低,其中以补肾组和骨疏康组降低最为明显,与其他各组比较具有极显著差异(P<0.01).结论补肾方法通过降低抗酒石酸酸性磷酸酶含量对骨质疏松症具有一定的防治作用.【期刊名称】《中国骨质疏松杂志》【年(卷),期】2016(022)004【总页数】3页(P393-395)【关键词】骨质疏松症;抗酒石酸酸性磷酸酶;补肾方法;中医【作者】杨芳;朱辉;郑洪新;王剑;林庶茹【作者单位】辽宁中医药大学,沈阳110847;辽宁中医药大学,沈阳110847;辽宁中医药大学,沈阳110847;辽宁中医药大学,沈阳110847;辽宁中医药大学,沈阳110847【正文语种】中文【中图分类】R-332骨质疏松(osteoporosis,OP)是以骨量减少、骨微观结构退化为特征,致使骨的脆性增加以及易于发生骨折的一种全身性骨骼疾病。
糖皮质激素(glucocorticoid,GC)是引起骨质疏松症的最常见的药物,长期接受GC治疗者都有发生骨质疏松的危险,而这种由GC治疗所导致的骨质疏松症即成为糖皮质激素性骨质疏松症(glucocorticoid induced osteoporosis,GIO)。
本实验研究以中医学整体观念为指导思想,采用分子生物学的技术,观察补肾、健脾、活血化瘀方法对糖皮质激素性骨质疏松症大鼠的抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRACP)含量的影响。

雄激素受体抑制剂对大鼠成骨细胞的作用分析杨政兴;陈忠铭;刘美宝;陈夏韧【期刊名称】《临床合理用药杂志》【年(卷),期】2017(10)34【摘要】目的分析雄激素受体抑制剂对大鼠成骨细胞的作用。
方法采用LNCaP人前列腺癌细胞建立原发性裸鼠前列腺癌模型,其中实验组21只应用雄性激素受体抑制剂——比卡鲁胺进行饲喂给药,对照组7只注射生理盐水,另选择未荷瘤裸鼠6只为空白组,比较给药前后3组裸鼠血清睾酮、雄激素、骨源性碱性磷酸酶(BALP)和抗酒石酸酸性磷酸酶5b(TRAP-5b)水平。
结果 LNCaP人前列腺癌细胞荷瘤小鼠及空白组裸鼠生长情况均正常,精神状态较好,均无实验过程中死亡。
于实验组比卡鲁胺给药1周后,3组各项指标比较差异均无统计学意义(P>0.05);比卡鲁胺给药4周后,实验组睾酮水平明显低于对照组和空白组(P<0.05),雌激素水平高于对照组和空白组(P<0.05),3组BALP和TRAP-56比较差异均无统计学意义(P>0.05)。
结论雄性激素受体抑制剂可以治疗及缓解前列腺癌症状,但同时可引起患者骨质疏松的不良反应,应合理适量使用。
【总页数】2页(P80-81)【作者】杨政兴;陈忠铭;刘美宝;陈夏韧【作者单位】厦门大学附属福州第二医院【正文语种】中文【中图分类】R973.2【相关文献】1.雄激素对大鼠胎颅盖骨成骨细胞雌激素受体基因表达的影响2.雄激素受体在大鼠睾丸发育过程中的表达及雄激素对其表达的调节作用3.雄性受体大鼠同种肾移植慢性排斥反应中性激素、性别、雄激素受体拮抗剂的作用4.雄性大鼠成骨细胞内雄激素受体表达对骨代谢的影响因版权原因,仅展示原文概要,查看原文内容请购买。

抗酒石酸酸性磷酸酶染色液使用说明货号:G4561有效期:6个月有效。
产品内容:名称规格(4×10ml)保存试剂(A):TRAP固定液50ml4℃避光试剂(B):TRAP孵育液B1:AS-BI Buffer1ml-20℃避光B2:GBC染色液0.1ml4℃避光B3:TRAP Buffer9ml RT避光临用前,按B1:B2:B3=10:1:90混合,即为TRAP孵育液,即配即用。
试剂(C):苏木素染色液10ml4℃避光试剂(D):甲基绿染色液10ml RT避光产品说明:酸性磷酸酶(acid phosphatase,ACP)分布极广泛,遍布各种组织,主要存在于细胞的溶酶体内,所以常作为溶酶体标志酶。
溶酶体外的酸性磷酸酶存在于内质网和胞质内。
各种动物中的酸性磷酸酶各有不同,酸性磷酸酶的适宜pH为4.5~5.5。
存在于正常人肺泡巨噬细胞和白血病人脾脏的抗酒石酸酸性磷酸酶(Tartrate-resistnt acid phosphatase,TRAP)均在细胞滤泡中,并不是释放入血液。
血液中的TRAP绝大多数来源于破骨细胞,因此可以通过测量血液中的TRAP了解破骨细胞的功能状态。
抗酒石酸酸性磷酸酶染色液以萘酚AS-BI为底物,在酸性pH下被酸性磷酸酶水解释放出磷酸和萘酚,萘酚不重氮盐偶联生成有色产物,定位于细胞质中,若细胞内的ACP有抗酒石酸的活性,则呈阳性反应。
该染色液可用于新鲜血涂片、细胞涂片,亦可用于冰冻切片、石蜡切片。
自备材料:1、蒸馏水、恒温箱2、载玻片、推玻片3、光学显微镜操作步骤(仅供参考):(一)血液、细胞涂片:1、推片:取新鲜血液或骨髓涂片置于载坡片上,推玻片于载玻片保持30度,置于血液或细胞滴液的正前方,稍往后移不血液或细胞滴液接触使后者沿推片下缘散开,再匀速沿载玻片平面平稳向前滑动至铺满血膜为止。
2、自然晾干,TRAP固定液4℃固定30s~3min,多数情况下30~60s即可。



破骨细胞trap染色步骤破骨细胞(osteoclasts)是一种在骨组织内进行重要功能的多核巨噬细胞。
破骨细胞能够吸附到骨表面,通过溶酶体释放酸性蛋白酶,降低骨矩阵的pH值,从而溶解败坏的骨组织。
trap染色是一种常用的破骨细胞特异性染色方法,能够准确地识别并观察破骨细胞的形态和活性。
trap染色的原理基于破骨细胞在酸性环境中释放的酸性磷酸酶(tartrate-resistant acid phosphatase,TRAP)活性。
TRAP是一种破骨细胞特异性的酶,能够催化酸性磷酸酶反应。
在trap染色中,使用一种叫做红碱性磷酸酶耐受的反应试剂,能够在破骨细胞所在的区域产生红棕色沉淀物,从而可视化破骨细胞的分布和形态。
下面是trap染色的步骤:1. 取得骨组织标本并保持其完整性。
可以使用钳子、锯子等工具在实验室条件下取得骨组织标本。
确保取得的标本相对完整,不要过分损伤,以保持破骨细胞的形态和活性。
2. 固定标本。
使用4%的中性缓冲福尔马林或其他适当的固定液固定标本。
固定可以使标本保存并保持其形态结构,同时也有助于切片过程。
3. 制备切片。
将固定的骨组织标本进行切片处理。
通常使用切片机或显微刀将骨组织切成较薄的片段,一般为4-10 μm。
切片的厚度可以根据实验的需要进行调整。
4. trap染色。
将切片放置在含有trap染色试剂的反应液中,通常包括硝酸钒、酒石酸和4-硝基苯胺等。
将切片和反应液放置在37℃的恒温箱中进行染色反应,通常需要1-2小时。
反应时间可以根据实验条件进行调整。
5. 停止反应。
当标本呈现所需的染色强度时,使用缓冲液将反应停止。
多数情况下,使用去离子水或含有6%硫酸的缓冲液进行停止反应。
停止反应有助于保持染色效果和标本结构。
6. 洗涤和干燥。
将标本在流动水中洗涤,去除多余的染色试剂。
然后用纯净水冲洗几次,最后用纸巾轻轻吸干。
7. 封片和观察。
将切片放在显微镜玻璃片上,使用透明的封片剂封闭标本。
小鼠抗酒石酸酸性磷酸酶 (TRAP)酶联免疫分析(ELISA)最近更新时间:2011年3月8日提供商:上海研辉生物科技有限公司资料大小:0K文件类型:下载次数:0次资料类型:浏览次数:48次相关产品:详细介绍:小鼠抗酒石酸酸性磷酸酶(TRAP)酶联免疫分析(ELISA)试剂盒使用说明书本试剂仅供研究使用目的:本试剂盒用于测定小鼠血清,血浆及相关液体样本中抗酒石酸酸性磷酸酶(TRAP)的含量。
实验原理:本试剂盒应用双抗原夹心法测定标本中小鼠抗酒石酸酸性磷酸酶(TRAP)水平。
用纯化的抗原包被微孔板,制成固相抗原,往包被抗原的微孔中依次加入抗酒石酸酸性磷酸酶(TRAP),再与HRP标记的抗原结合,形成抗原-抗体-酶标抗原复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的抗酒石酸酸性磷酸酶(TRAP)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中小鼠抗酒石酸酸性磷酸酶(TRAP)浓度。
样本处理及要求:1. 血清:室温血液自然凝固10-20分钟,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如出现沉淀,应再次离心。
2. 血浆:应根据标本的要求选择EDTA或柠檬酸钠作为抗凝剂,混合10-20分钟后,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如有沉淀形成,应该再次离心。
3. 尿液:用无菌管收集,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如有沉淀形成,应再次离心。
胸腹水、脑脊液参照实行。
4. 细胞培养上清:检测分泌性的成份时,用无菌管收集。
离心20分钟左右(2000-3000转/分)。
仔细收集上清。
检测细胞内的成份时,用PBS(PH7.2-7.4)稀释细胞悬液,细胞浓度达到100万/ml左右。
通过反复冻融,以使细胞破坏并放出细胞内成份。
人抗酒石酸酸性磷酸酶(TRAP)酶联免疫分析(ELISA)试剂盒使用说明书本试剂仅供研究使用目的:本试剂盒用于测定人血清,血浆及相关液体样本中抗酒石酸酸性磷酸酶(TRAP)的含量。
实验原理:本试剂盒应用双抗原夹心法测定标本中人抗酒石酸酸性磷酸酶(TRAP)水平。
用纯化的人TRAP抗原包被微孔板,制成固相抗原,往包被抗原的微孔中依次加入TRAP抗体,再与HRP标记的酒石酸酸性磷酸酶抗原结合,形成抗原-抗体-酶标抗原复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的抗酒石酸酸性磷酸酶(TRAP)呈正相关。
用酶标仪在450nm 波长下测定吸光度(OD值),通过标准曲线计算样品中人抗酒石酸酸性磷酸酶(TRAP)浓度。
试剂盒组成:样本处理及要求:1. 血清:室温血液自然凝固10-20分钟,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如出现沉淀,应再次离心。
2. 血浆:应根据标本的要求选择EDTA或柠檬酸钠作为抗凝剂,混合10-20分钟后,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如有沉淀形成,应该再次离心。
3. 尿液:用无菌管收集,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如有沉淀形成,应再次离心。
胸腹水、脑脊液参照实行。
4. 细胞培养上清:检测分泌性的成份时,用无菌管收集。
离心20分钟左右(2000-3000转/分)。
仔细收集上清。
检测细胞内的成份时,用PBS(PH7.2-7.4)稀释细胞悬液,细胞浓度达到100万/ml左右。
通过反复冻融,以使细胞破坏并放出细胞内成份。
离心20分钟左右(2000-3000转/分)。
仔细收集上清。
保存过程中如有沉淀形成,应再次离心。
5. 组织标本:切割标本后,称取重量。
加入一定量的PBS,PH7.4。
用液氮迅速冷冻保存备用。
trap染色原理染色是一种用于对细胞、组织或病原体进行可视化的方法,以研究其结构、功能以及相关疾病的技术。
其中,trap染色是一种特殊的染色技术,用于检测和可视化细胞内和组织中的酸性磷酸酶活性。
本文将详细介绍trap染色的原理及其在生物实验中的应用。
trap染色的原理基于细胞中酸性磷酸酶(acid phosphatase)的活性。
酸性磷酸酶是一类催化酸性环境下磷酸酯水解反应的酶,它可以使底物产生染色反应。
而trap染色通常使用一种底物叫做naphthol AS-MX phosphate,通过活性的酸性磷酸酶作用后,底物分解成一种酚类产物,再与已经添加的染料(通常是Fast Red)反应形成红色的染色产物。
这种染色产物的形成,可以通过显微镜观察并记录结构和相关的细胞或组织。
所以,为了进行trap染色,一般需要准备以下试剂和材料:1.10%缓冲氧化铅溶液:用于抑制内源性碱性磷酸酶的活性。
2. naphthol AS-MX phosphate:trap活性底物。
3. Fast Red TR盐:染色试剂,通常为红色。
4.缓冲液:用于将上述试剂和样品混合,保持酸性环境,常用的缓冲液包括醋酸钠缓冲液和酒石酸缓冲液等。
具体的trap染色步骤如下:1.准备与样品相匹配的缓冲液,并在适当的温度下预温。
2.处理样品:根据需要,可以对细胞、组织进行固定、切片和染色前处理等步骤。
3. 清洗:将已处理的样品进行清洗,去除与trap染色无关的组织液和其他杂质。
4. 添加底物:将样品放入所选择的缓冲液中,并添加naphthol AS-MX phosphate作为底物。
根据所研究的细胞和标本,可以选择不同浓度的底物。
5. trap反应:将样品置于所选的缓冲液中,保持适当的酸性条件,使酸性磷酸酶与底物发生反应。
反应时间通常为1-2小时,具体时间取决于样品和所用条件的不同。
6. 停止反应:通过快速冲洗样品来停止trap反应。
7. 添加染色试剂:在缓冲液中加入Fast Red TR盐,使其与底物反应,生成红色的染色产物。