第一章 酶学基础
- 格式:ppt
- 大小:2.60 MB
- 文档页数:39

酶工程复习提纲第一章绪论1.酶及酶工程的概念。
酶:是生物体内一类具有催化活性和特殊空间构象的生物大分子物质。
酶工程:利用酶的催化作用,在一定的生物反应器中,将相应的原料转化成所需产品的一门工程技术。
(名词解释) 2.了解酶学的发展历史,尤其是一些关键事件。
1833年,Payen和Persoz发现了淀粉酶。
1878年,Kuhne首次将酵母中进行乙醇发酵的物质称为酶。
给酶一个统一的名词,叫Enzyme,这个词来自希腊文,其意思“在酵母中”。
1902年,Henri提出中间产物学说。
1913年,Michaelis and Menton推导出酶催化反应的基本动力学方程,米氏方程:V=VmS/(Km+S)。
1926年,Summer分离纯化得到脲酶结晶。
人们开始接受“酶是具有生物催化功能的蛋白质”。
Cech and Altman于1982和1983年发现具有催化活性的RNA即核酸类酶,1989年获诺贝尔化学奖。
现已鉴定出5000多种酶,上千种酶已得到结晶,而且每年都有新酶被发现。
3.了解酶在医药、食品、轻工业方面的应用。
医药:(1)用酶进行疾病的诊断:通过酶活力变化进行疾病诊断,谷丙转氨酶/谷草转氨酶用于诊断肝病、心肌梗塞等,酶活力升高;葡萄糖氧化酶用于测定血糖含量,诊断糖尿病。
(2)用酶进行疾病的治疗:来源于蛋清、细菌的溶菌酶用于治疗各种细菌性和病毒性疾病;来源于动物、蛇、细菌、酵母等的凝血酶用于治疗各种出血病;来源于蚯蚓、尿液、微生物的纤溶酶用于溶血栓。
(3)用酶制造各种药物:来源于微生物的青霉素酰化酶用于制造半合成青霉素和头孢菌素;来源于动物、植物、微生物的蛋白酶用于生产L-氨基酸。
食品:生产低聚果糖,原料为蔗糖,所需酶为果糖基转移酶、蔗糖酶α(黑曲霉、担子菌);生产低聚异麦芽糖,原料为淀粉,所需酶为α-淀粉酶、β-淀粉酶、真菌α-淀粉酶(米曲霉)、α-葡萄糖苷酶(黑曲霉)、普鲁兰酶、糖化型α-淀粉酶(枯草杆菌)。

第一章绪论第一节酶的发现及研究历史最早的酶学实验: 1783年, 意大利科学家Spallanzani发现鸟的胃液能将肉类分解消化。
酶的最早发现者:1810年,药物学家Planche在植物根中发现一种能使创木脂氧化变蓝的物质,并分离出了这种耐热且水溶性的物质。
最早的酶制剂:1833年,Payen和Persoz用酒精处理麦芽提取液,分离出了一种能溶于水和稀酒精,不溶于浓酒精,对热不稳定的白色无定形粉末,取名为diastase(淀粉酶)。
它能使淀粉转化为糖,不久后用于棉布退浆。
1971年,第一届国际酶工程学术会议在美国召开,主题即是固定化酶,进一步开展了对微生物细胞固定化的研究。
第二节酶学概论一、什么是酶1酶是一类具有特殊催化功能的蛋白质2酶的化学本质是蛋白质。
主要依据是:①酶经酸碱水解后的最终产物是氨基酸,酶能被蛋白酶水解而失活。
②酶是具有空间结构的生物大分子,凡使蛋白质变性的因素都可使酶变性失活。
③酶是两性电解质,在不同pH下呈现不同的离子状态,在电场中向某一电极泳动,各自具有特定的等电点。
④酶和蛋白质一样,具有不能通过半透膜等胶体性质。
⑤酶也有蛋白质所具有的化学呈色反应。
3酶具有蛋白质的一切理化性质。
它也是亲水胶体,具有两性电解质性质,凡能引起蛋白质变性的因素均可致使酶失活二、酶的化学组成1单纯蛋白质的酶类2缀合蛋白质的酶类蛋白质---脱辅酶非蛋白质小分子---辅因子物质或金属离子全酶= 脱辅酶+ 辅因子三、酶的催化作用(一)酶和一般催化剂的共性①凡是催化剂均能加快化学反应的速度,而本身在反应前后都没有结构和性质上的改变。
②只能催化热力学上允许进行的化学反应,而不能实现热力学上不能进行的反应。
③只能缩短反应达到平衡所需的时间,而不能改变平衡点。
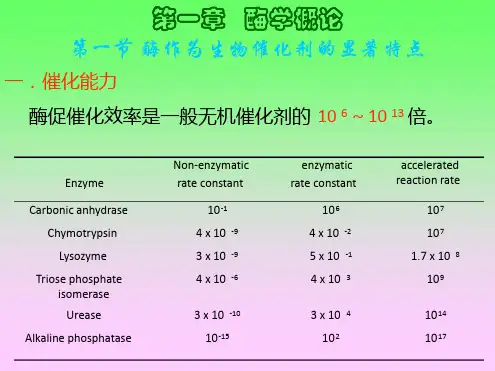
(二)酶作为生物催化剂的特点1.反应条件温和2. 酶易失活3.酶具有很高的催化效率酶作为催化剂比一般催化剂更显著地降低活化能,催化效率更高活化能:在一定温度下1摩尔底物全部进入活化态所需要的自由能(kJ/mol)反应所需的活化能愈高,反应速率就愈慢4.酶具有高度专一性5.酶活性受到调节和控制细胞内酶的调节和控制主要方式:a调节酶的浓度酶浓度的调节主要有2种方式:诱导或抑制酶的合成调节酶的降解b通过激素调节酶活性c反馈抑制调节酶活性d抑制剂和激活剂对酶活性的调节e其他调节方式反馈抑制:许多小分子物质的合成是由一连串的反应组成的,催化此物质生成的第一步的酶,往往被它们终端产物抑制。


① 酶工程:由酶学与化学工程技术、基因工程技术、微生物学技术相结合而产生的一门新技术,是工业上有目的地设计一定的反应器和反应条件,利用酶的催化功能,在常温常压下催化化学反应,生产人类所需产品或者服务于其它目的地一门应用技术。
② 比活力:指在特定条件下,单位质量的蛋白质或者 RNA 所拥有的酶活力单位数。
③ 酶活力:也称为酶活性,是指酶催化某一化学反应的能力。
其大小可用在一定条件下,酶催化某一化学反应的速度来表示,酶催化反应速度愈大,酶活力愈高。
④ 酶活国际单位 : 1961 年国际酶学会议规定:在特定条件(25℃,其它为最适条件 )下,每分钟内能转化1 μmol 底物或者催化1 μmol 产物形成所需要的酶量为 1 个酶活力单位,即为国际单位(IU)。
⑤ 酶反应动力学:指主要研究酶反应速度规律及各种因素对酶反应速度影响的科学。
酶的研究简史如下:(1)不清晰的应用:酿酒、造酱、制饴、治病等。
(2)酶学的产生: 1777 年,意大利物理学家 Spallanzani 的山鹰实验; 1822 年,美国外科医生 Beaumont 研究食物在胃里的消化; 19 世纪 30 年代,德国科学家施旺获得胃蛋白酶。
1684 年,比利时医生Helment 提出 ferment—引起酿酒过程中物质变化的因素(酵素);1833 年,法国化学家 Payen 和Person 用酒精处理麦芽抽提液,得到淀粉酶; 1878 年,德国科学家 K hne 提出 enzyme—从活生物体中分离得到的酶,意思是“在酵母中”(希腊文)。
(3)酶学的迅速发展(理论研究): 1926 年,美国康乃尔大学的”独臂学者”萨姆纳博士从刀豆中提取出脲酶结晶,并证明具有蛋白质的性质;1930 年,美国的生物化学家 Northrop 分离得到了胃蛋白酶、胰蛋白酶、胰凝乳蛋白酶结晶,确立了酶的化学本质。
I.酶工程发展如下:①1894 年,日本的高峰让吉用米曲霉制备淀粉酶,酶技术走向商业化:②1908 年,德国的Rohm 用动物胰脏制得胰蛋白酶,皮革软化及洗涤;③1911 年, Wallerstein 从木瓜中获得木瓜蛋白酶,用于啤酒的澄清;④1949 年,用微生物液体深层培养法进行-淀粉酶的发酵生产,揭开了近代酶工业的序幕;⑤1960 年,法国科学家 Jacob 和 Monod 提出的控制子学说,阐明了酶生物合成的调节机制,通过酶的诱导和解除阻遏,可显著提高酶的产量;⑥1971 年各国科学家开始使用“酶工程”这一位词。

生物化学大一酶知识点总结酶作为生物体内的催化剂,在生命体系中扮演着至关重要的角色。
了解和掌握酶的基本知识对于生物化学的学习至关重要。
本文将对大一生物化学中的酶知识点进行总结,并帮助读者全面了解酶的结构、功能以及与底物的相互作用。
以下是酶的相关知识点总结:1. 酶的定义和特性- 酶是一种生物催化剂,可以加速化学反应的速率,但在反应结束后酶本身不发生改变。
- 酶可以在更温和的条件下进行反应,促进底物分子之间的相互作用。
- 酶具有高度的反应特异性,因为其活性位点能够与特定的底物结合,而不影响其他分子。
2. 酶的分类- 酶可以根据底物的种类分为氧化酶、还原酶、水解酶、合成酶等。
- 根据反应位置,酶可分为细胞质酶、溶液中酶和膜酶等。
- 酶还可以通过命名法分类,如葡萄糖氧化酶、乳酸脱氢酶等。
3. 酶的结构- 酶通常由蛋白质组成,但也有一些例外,如核酸酶。
- 酶的结构包括原核生物酶和真核生物酶,其中原核生物酶结构较为简单。
- 酶的构象通常由原子团体组成,如氨基酸残基和辅助因子。
4. 酶的活性- 酶的活性受到环境因素的影响,如温度、pH值和底物浓度。
- 酶的最适温度和最适pH值可以通过对酶的研究和实验确定。
- 酶底物的浓度会影响酶的活性,过高或过低的底物浓度可能抑制酶的催化效果。
5. 酶的底物结合- 酶通过与底物的特异性相互作用来催化化学反应。
- 酶底物结合的过程可以通过解离常数(Km值)和最大反应速率(Vmax值)来描述。
- 酶底物复合物的形成可以通过米氏方程来表示,即v =Vmax*[S]/(Km+[S])。
6. 酶的抑制- 酶的活性可以被抑制剂所抑制,分为竞争性抑制和非竞争性抑制。
- 竞争性抑制剂与酶的底物竞争结合,降低反应速率。
- 非竞争性抑制剂通过与酶的其他部位结合而不是活性位点,影响酶的构象。
7. 酶与温度的关系- 温度是影响酶活性的重要因素,酶活性随温度的升高而增加,但超过一定温度后酶的构象可以被破坏。


《酶⼯程》复习⼤纲答案详解《酶⼯程》复习⼤纲试题题型:名词解释,判断题,选择题,简答题,论述题,实验设计题。
第⼀章酶⼯程基础⼀、名词解释:酶:指⽣物体产⽣的具有催化活性的⽣物⼤分⼦。
酶⼯程:由酶学与化学⼯程技术、基因⼯程技术、微⽣物学技术相结合⽽产⽣的⼀门新技术,是⼯业上有⽬的地设计⼀定的反应器和反应条件,利⽤酶的催化功能,在常温常压下催化化学反应,⽣产⼈类所需产品或服务于其它⽬的地⼀门应⽤技术。
转换数:酶使底物每分钟变化的分⼦数。
催化周期:单位时间内每个酶分⼦将底物分⼦转换成产物的最⼤值,即每摩尔酶单位时间催化底物转化为产物的摩尔数。
酶活⼒:也称为酶活性,是指酶催化某⼀化学反应的能⼒。
其⼤⼩可⽤在⼀定条件下,酶催化某⼀化学反应的速度来表⽰,酶催化反应速度愈⼤,酶活⼒愈⾼。
⽐活⼒:指在特定条件下,单位质量的蛋⽩质或RNA所拥有的酶活⼒单位数。
酶活国际单位IU: 1961年国际酶学会议规定:在特定条件(25℃,其它为最适条件)下,每分钟内能转化1µmol底物或催化1µmol产物形成所需要的酶量为1个酶活⼒单位,即为国际单位(IU)。
催量kat:每秒钟转化 1 摩尔底物(被反应物)所需的酶活⼒为1个katal ,简称 kat⼆、问答题1、酶催化的特点有哪些?⾼效性:酶的催化效率⽐⽆机催化剂更⾼,使得反应速率更快;专⼀性:⼀种酶只能催化⼀种或⼀类底物,如蛋⽩酶只能催化蛋⽩质⽔解成多肽、⼆肽酶可催化各种氨基酸脱⽔缩合形成的⼆肽;温和性:是指酶所催化的化学反应⼀般是在较温和的条件下进⾏的.活性可调节性:包括抑制剂和激活剂调节、反馈抑制调节、共价修饰调节和变构调节等. 有些酶的催化性与辅因⼦有关.易变性:由于⼤多数酶是蛋⽩质,因⽽会被⾼温、强酸、强碱等破坏2、影响酶催化作⽤的因素有哪些?◇1温度:酶促反应在⼀定温度范围内反应速度随温度的升⾼⽽加快;但当温度升⾼到⼀定限度时,酶促反应速度不仅不再加快反⽽随着温度的升⾼⽽下降。



酶工程复习要点名词解释:1、酶活性中心:只有少数特异的氨基酸残基与底物结合及催化作用。
这些特异的氨基酸残基比较集中的区域,即与酶活力直接相关的区域称为没得活性中心或活性部位。
2、酶别构调节的定义:某些小分子物质与酶的非催化部位或别位特异地结合,引起酶蛋白构象的变化,从而改变酶活性的方式。
能发生别构效应的酶称为别构酶。
3、效应物:与别构酶的别构中心结合,能调节酶的反应速率和代谢过程的物质。
4、同促效应和异促效应:当一个效应物分子和酶结合后,影响另一个相同的效应物分子与酶的另一部位结合称为同促效应;如果一分子效应物和酶结合后,影响另一不同的效应物分子与酶的另一部位结合则称为异促效应。
一个效应物分子与别构酶的别构中心结合后对第二个效应物分子结合的影响称为协同效应。
当一个效应物分子与酶蛋白的一个部位结合后,可使另一部位对效应物亲和力增高的效应称为正协同效应,反之称为负协同效应。
5、酶的专一性:酶对催化的反应和反应物有严格的选择性。
1、结构专一性:分为绝对专一性和相对专一性2、立体异构专一性:分为光学专一性和几何专一性6、酶原的激活:分子内肽键的一处或多处断裂,进而使分子构象发生某种改变,形成酶的活性中心。
7、酶原:有些酶在细胞内合成及初分泌时是没有活性的酶的前体,称为酶原。
8、酶活力:又称为酶活性,是指酶催化某一化学反应的能力。
9、抑制剂:能降低酶的活性,使酶促反应速率减慢的物质10、分解代谢物阻遏:是指细胞内同时有两种分解底物(碳源或氮源)存在时,利用快的那种分解底物会阻遏利用慢的底物有关酶合成的现象。
11、反馈阻遏作用:是指酶催化作用的产物或代谢途径的末端产物使该酶的生物合成受阻的过程。
12、操纵子:原核基因组中,由几个功能相关的结构基因及其调控区组成一个基因表达的协同单位,这种单位称为操纵子。
操纵子分:诱导型操纵子、阻遏型操纵子13、效应物:效应物是一类低相对分子质量的信号物质(如糖类及其衍生物、氨基酸和核苷酸等),包括诱导物和辅阻遏物两种。